鸦胆子中黄酮及其抗炎、抗补体活性的研究
2020-02-02郭文静吴佳辉熊紫微冯育林杨世林
何 潇,郭文静,吴佳辉,熊紫微,谭 婷,冯育林,,杨世林,温 泉*
1江西中医药大学;2创新药物与高效节能降耗制药设备国家重点实验室,南昌 330006
鸦胆子是苦木科鸦胆子Bruceajavanica(L.) Merr.的干燥成熟果实,主要分布于我国的广东、广西等地区。全世界鸦胆子属植物有6种,我国有2种,为鸦胆子和柔毛鸦胆子,均不同程度地作为民间传统用药,具有多种药理活性。据2020版《中国药典》记载,鸦胆子具有良好的清热解毒、截疟、止痢、腐蚀赘疣等作用,内用治疗各种疟疾、痢疾,外用治疗赘疣、鸡眼等[1]。现代药理活性研究表明,鸦胆子有抗炎、拒食、抗疟、抗病毒、抗溃疡、降血糖和除草等多方面的作用[2]。鸦胆子含有丰富的化学成分,主要包括苦木内酯类、三萜类、生物碱类、黄酮类、脂肪酸类等化合物,文献报道及研究发现鸦胆子中的黄酮类化合物主要以木犀草素及其衍生物为主[3]。虽然之前已有文献报道过相关黄酮类成分的抗炎及抗补体活性[4],但大多是非同一骨架类型之间的活性比较,而本研究对从鸦胆子中分离得到一系列木犀草素骨架类型的黄酮进行分析,这对于阐明这类黄酮的抗炎、抗补体活性构效关系具有重要参考意义。
目前,有关黄酮类化合物体外抗炎作用机制的研究主要集中在小鼠单核巨噬细胞(RAW264.7),而对小鼠肺泡巨噬细胞(MH-S)的研究鲜有报道。肺泡巨噬细胞是急性肺损伤发病使动环节的关键靶细胞,是抵御外来入侵者进入肺组织的第一道防线,研究发现,肺泡巨噬细胞可以调节气道中的促炎和抗炎反应,对肺部炎症起着关键性作用[5]。本文首次研究了鸦胆子果实中木犀草素骨架类型黄酮化合物在MH-S细胞中的抗炎效果,阐明其构效关系,并研究了黄酮的抗补体活性及其构效关系,为进一步阐明木犀草素骨架类型黄酮的抗炎与抗补体之间的关系提供了研究基础。
1 材料与方法
1.1 仪器与试剂
Bruker Avance 600型核磁共振仪(德国布鲁克公司);Triple TOF 5600高分辨质谱仪(美国AB Sciex公司);HPLC:LC-XR20(日本岛津公司);Agilent 1100 Series制备液相色谱(美国Agilent公司); HP20大孔吸附树脂(日本三菱公司);Sephadex LH-20凝胶(美国GE Healthcare公司);YMC-Pack ODS-A HPLC半制备柱(250 mm×20 mm,5 μm,日本);YMC-Pack ODS-A HPLC半制备柱(250 mm×10 mm,5μm,日本);柱色谱硅胶、薄层色谱硅胶板(青岛海洋化工厂分厂)。
小鼠肺泡巨噬细胞株(MH-S );CCK-8(大连美伦生物技术有限公司);磺胺(Sigma公司,美国);N-1-萘乙二胺盐酸盐(Sigma公司,美国);96孔细胞培养板;1640培养基(Solarbio公司,美国);PBS(Solarbio公司,美国);胰蛋白酶(Solarbio公司,美国);BI血清(FBS,澳洲);脂多糖(LPS,Sigma公司,美国);95%磷酸(国药)。
鸦胆子药材来自广西省(2016年11月),由江西中医药大学钟国跃教授鉴定为苦木科鸦胆子属植物鸦胆子的干燥成熟果实,标本(YD20161107)保存于江西中医药大学中药固体制剂制造技术国家工程研究中心。
1.2 实验方法
1.2.1 提取分离
取鸦胆子药材20 kg,粉碎后用石油醚脱脂3次,待药渣挥干石油醚后,用95%乙醇进行提取,每次2 h,合并提取液,滤过,减压浓缩至无醇味,得粗浸膏。浸膏加适量蒸馏水溶解,用乙酸乙酯萃取得459 g浸膏,之后上样于HP-20大孔吸附树脂,依次用水和30%、60%、95%乙醇洗脱,取60%乙醇洗脱部位浸膏157 g,经硅胶柱色谱分离,以二氯甲烷-甲醇(20∶1、10∶1、5∶1、2∶1、1∶1、0∶1)梯度洗脱后,各部位再经制备液相(乙腈-0.1%甲酸水36∶64)分离,得化合物2(8.9 mg)、4(10.6 mg)、9(4.4 mg),经制备液相(乙腈-0.1%甲酸水28∶72)分离,得化合物1(3.4 mg)、5(6.8 mg)、7(20.0 mg),经制备液相(乙腈-0.1%甲酸水33∶67)分离,得化合物3(3.5 mg)、6(10.8 mg)、11(9.8 mg),经制备液相(乙腈-0.1%甲酸水18∶82)分离,得化合物8(6.7 mg)、10(9.0 mg)、12(7.8 mg)。
1.2.2 活性测定
CCK-8法细胞毒性试验:取对数生长期的MH-S细胞接种于96孔板中(1×104个细胞/孔),37 ℃、5% CO2培养过夜,弃去上清,将含不同药物浓度化合物1~12(100、50、25、12.5、6.25 μmol/L)的细胞培养液100 μL/孔加入96孔板中,另设正常细胞对照组中加入无药物的细胞培养液,每组6个副孔。37 ℃、5% CO2培养24 h后,弃去上清液加入10%的CCK-8溶液,每孔100 μL,酶标仪450 nm处测定吸光度(OD值),计算细胞活力。
1.2.3 NO抑制试验
采用Griess法检测对LPS刺激下的MH-S细胞分泌NO的抑制作用。取对数生长期MH-S细胞接种于96孔板中(5×104个细胞/孔),37 ℃、5% CO2条件下培养24 h后,弃去旧培养基,给药组每孔加入100 μL含药1640完全培养基,模型组每孔加入100 μL空白1640完全培养基,空白对照组每孔加入200 μL空白1640完全培养基,培养1 h后,除空白对照组外,每孔加入100 μL的LPS(2 μg/mL)溶液,继续培养24 h,24 h后,取出96孔板于显微镜下观察细胞状态,后每孔吸取100 μL上清液于新的96孔板中,加入Griess Ⅰ液50 μL,放置到细胞培养箱中培养10 min,取出,再加入Griess Ⅱ液50 μL,放置培养箱中10 min,取出,摇床振摇5 min,用酶标仪在550 nm处测其OD值,计算NO抑制率。
1.2.4 补体经典途径测试
将样品溶于DMSO,不同浓度的样品(BBS缓冲液稀释)加入临界浓度的补体(1∶1稀释的豚鼠血清),溶血素和2%绵羊红细胞(SRDC)。根据文献[6],配制中药测定组、中药对照组、补体组以及全溶血组样品。放置37 ℃水浴30 min后,低温(4℃)离心(3 000 rpm)5 min后,分别取每个样品上清0.2 mL于96孔板,用酶标仪在405 nm下测定吸光度(A)值。计算出不同浓度的中药测定组的各溶血抑制率,以供试品浓度为横坐标(X),溶血抑制率为纵坐标(Y),利用Graphpad Prism 7.0软件,计算半数抑制溶血浓度(CH50)。
抑制率=[1-(A中药测定-A中药对照)/A补体]×100%
2 结果与讨论
2.1 结构鉴定
化合物1黄色针晶(甲醇);mp.325~327 ℃,ESI-MS:m/z287 [M+H]+,1H NMR(600 MHz,DMSO-d6)δ:7.40(2H,m,H-2′,6′),6.85(1H,d,J=8.8 Hz,H-5′),6.54(1H,s,H-3),6.45(1H,d,J=2.0 Hz,H-8),6.17(1H,d,J=2.0 Hz,H-6);13C NMR(150 MHz,DMSO-d6)δ:165.6(C-2),103.7(C-3),182.5(C-4),162.9(C-5),99.7(C-6),164.6(C-7),94.6(C-8),158.3(C-9),104.8(C-10),122.7(C-1′),114.4(C-2′),147.6(C-3′),151.5(C-4′),116.6(C-5′),119.3(C-6′)。以上波谱数据与文献[7]报道的基本一致,故鉴定化合物1为木犀草素,结构见图1。
化合物2淡黄色粉末(甲醇);mp.340~341 ℃,ESI-MS:m/z271 [M+H]+,1H NMR(600 MHz,DMSO-d6)δ:7.93(2H,d,J=8.4 Hz,H-2′,H-6′),6.94(2H,d,J=8.4 Hz,H-3′,H-5′),6.76(1H,s,H-3),6.18(1H,d,J=2.0 Hz,H-6),6.53(1H,d,J=2.0 Hz,H-8),12.89(1H,s,5-OH);13C NMR(150 MHz,DMSO-d6)δ:164.7(C-2),103.3(C-3),182.2(C-4),157.8(C-5),99.3(C-6),164.2(C-7),94.4(C-8),161.9(C-9),104.1(C-10),121.6(C-1′),128.9(C-2′,C-6′),116.4(C-3′,C-5′),161.7(C-4′)。以上波谱数据与文献[8]报道的基本一致,故鉴定化合物2为芹菜素。
化合物3黄色无定型粉末(甲醇);mp.>300 ℃,ESI-MS:m/z449 [M+H]+,1H NMR(600 MHz,DMSO-d6)δ:7.62(1H,d,J=2.0 Hz,H-2′),7.40(1H,dd,J=8.2,2.0 Hz,H-6′),6.99(1H,d,J=8.2 Hz,H-5′),6.75(1H,d,J=2.0 Hz,H-8),6.88(1H,s,H-3)6.60(1H,d,J=2.1 Hz,H-6),5.62(1H,d,J=7.3 Hz,H-1′′),4.33~4.68(6H,m,Sugars-H);13C NMR(150 MHz,DMSO-d6)δ:165.0(C-2),103.8(C-3),182.6(C-4),162.3(C-5),100.3(C-6),163.7(C-7),95.0(C-8),157.6(C-9),106.3(C-10),122.4(C-1′),114.4(C-2′),147.6(C-3′),151.7(C-4′),116.6(C-5′),119.4(C-6′),101.5(C-1′′),74.6(C-2′′),79.0(C-3′′),70.9(C-4′′),78.2(C-5′′),62.1(C-6′′)。以上波谱数据与文献[9]报道的基本一致,故鉴定化合物3为木犀草素-7-O-β-D-葡萄糖苷。
化合物4黄色粉末(甲醇);mp.328~330 ℃,ESI-MS:m/z287 [M+H]+,1H NMR(600 MHz,DMSO-d6)δ:12.88(1H,s,5-OH),9.68(1H,s,3′-OH),9.38(1H,s,4′-OH),6.93(1H,d,J=8.0 Hz,H-6′),7.35(1H,s,H-2′),7.28(1H,d,J=8.0 Hz,H-5′),6.88(1H,s,H-3),6.51(1H,d,J=2.0 Hz,H-8),6.52(1H,d,J=2.0 Hz,H-6),3.69(3H,s,7-OCH3);13C NMR(150 MHz,DMSO-d6)δ:164.6(C-2),103.3(C-3),182.1(C-4),161.9(C-5),99.3(C-6),164.3(C-7),94.3(C-8),157.7(C-9),104.1(C-10),121.9(C-1′),113.8(C-2′),146.2(C-3′),150.2(C-4′),116.5(C-5′),119.4(C-6′),49.5(7-OCH3)。以上波谱数据与文献[10]报道的基本一致,故鉴定化合物4为7-甲氧基木犀草素。
化合物5棕黄色粉末(甲醇);mp.178~180 ℃,ESI-MS:m/z449 [M+H]+,1H NMR(600 MHz,DMSO-d6)δ:7.22(1H,d,J=2.0 Hz,H-2′),6.68(1H,d,J=8.4 Hz,H-5′),7.37(1H,dd,J=8.4,2.0 Hz,H-6′),6.72(1H,s,H-3),6.40(1H,d,J=2.0 Hz,H-6),6.24(1H,d,J=2.0 Hz,H-8),5.38(1H,s,H-1′′),3.05~3.77(4H,m,Rha-H),1.35(3H,d,J=6.2Hz,RhaCH3);13C NMR(150 MHz,DMSO-d6)δ:156.9(C-2),134.6(C-3),178.2(C-4),161.7(C-5),99.2(C-6),164.7(C-7),94.1(C-8),157.7(C-9),104.5(C-10),121.6(C-1′),115.9(C-2′),145.7(C-3′),148.9(C-4′),116.1(C-5′),121.2(C-6′),102.3(C-1′′),70.8(C-2′′),71.1(C-3′′),71.6(C-4′′),70.5(C-5′′),18.0(C-6′′)。以上波谱数据与文献[11]报道的基本一致,故鉴定化合物5为槲皮素-3-O-α-L-吡喃鼠李糖苷。
化合物6黄色粉末(甲醇);mp.244 ~246 ℃,ESI-MS:m/z447 [M-H]-,1H NMR(600 MHz,DMSO-d6)δ:7.59(1H,d,J=2.0 Hz,H-2′),6.87(1H,d,J=8.0 Hz,H-5′),7.55(1H,dd,J=8.0,2.0 Hz,H-6′),6.32(1H,d,J=2.0 Hz,H-8),6.88(1H,s,H-3)6.22(1H,d,J=2.0 Hz,H-6),5.27(1H,s,H-1′′),12.93(1H,s,5-OH),4.90(1H,d,J=7.2,H-1′);13C NMR(150 MHz,DMSO-d6)δ:164.6(C-2),103.7(C-3),182.2(C-4),161.8(C-5),99.3(C-6),163.9(C-7),94.6(C-8),157.8(C-9),104.2(C-10),122.2(C-1′),114.8(C-2′),146.1(C-3′),151.0(C-4′),116.9(C-5′),122.2(C-6′),102.3(C-1′′),73.8(C-2′′),76.4(C-3′′),70.5(C-4′′),77.8(C-5′′),61.3(C-6′′)。以上波谱数据与文献[12]报道的基本一致,故鉴定化合物6为木犀草素-3’-O-β-D-葡萄糖苷。
化合物7黄色针晶(甲醇);mp.210~212 ℃,ESI-MS:m/z455 [M+Na]+,1H NMR(600 MHz,DMSO-d6)δ:12.69(1H,s,5-OH),7.83(2H,d,J=8.0 Hz,H-2′,6′),6.99(2H,d,J=8.0Hz,H-3′,5′),6.47(1H,br s,H-8),6.26(1H,br s,H-6),5.44(1H,br s,H-1′′),3.92(1H,br s,H-2′′),3.36(1H,dd,J=8.8,3.2 Hz,H-3′′),3.15~3.23(1H,m,H-4′′,H-5′′),0.86(3H,d,J=5.2 Hz,-CH3);13C NMR(150 MHz,DMSO-d6)δ:157.0(C-2),134.6(C-3),178.1(C-4),161.7(C-5),99.3(C-6),165.1(C-7),94.3(C-8),157.0(C-9),104.4(C-10),120.9(C-1′),131.0(C-2′,6′),115.8(C-3′,5′),160.5(C-4′),102.2(C-1′′),70.8(C-2′′),71.1(C-3′′),71.6(C-4′′),70.5(C-5′′),17.9(C-6′′)。以上波谱数据与文献[13]报道的基本一致,故鉴定化合物7为山柰酚-3-O-α-L-吡喃鼠李糖苷。
化合物8黄色粉末(甲醇);mp.228~230 ℃,ESI-MS:m/z432 [M]+,1H NMR(600 MHz,DMSO-d6)δ:12.88(1H,s,5-OH),10.49(1H,s,4′-OH),7.92(2H,d,J=8.0 Hz,H-2′,6′),6.91(2H,d,J=8.0 Hz,H-3′,5′),6.81(1H,s,H-3),6.43(1H,d,J=2.1 Hz,H-6),6.84(1H,d,J=2.1 Hz,H-8),5.35(1H,d,J=5.0 Hz,H-1′′),3.32~3.81(5H,m,Sugars-H);13C NMR(150 MHz,DMSO-d6)δ:163.4(C-2),103.5(C-3),182.5(C-4),157.4(C-5),99.9(C-6),164.7(C-7),95.3(C-8),161.6(C-9),105.8(C-10),121.4(C-1′),129.1(C-2′),116.5(C-3′),161.9(C-4′),116.5(C-5′),129.1(C-6′),,100.3(C-1′′),73.6(C-2′′),76.9(C-3′′),69.9(C-4′′),77.6(C-5′′),61.0(C-6′′)。以上波谱数据与文献[14]报道的基本一致,故鉴定化合物8为芹菜素-7-O-β-D-吡喃葡萄糖苷。
化合物9淡黄色粉末(甲醇);mp.252~255 ℃,ESI-MS:m/z299 [M-H]-,1H NMR(600 MHz,DMSO-d6)δ:12.92(1H,s,5-OH)7.40(2H,m,H-2′,6′),6.81(1H,d,J=8.0Hz,H-5′),6.60(1H,s,H-3),6.25(1H,d,J=2.0 Hz,H-8),6.11(1H,d,J=2.0 Hz,H-6),3.91(3H,s,3′-OCH3);13C NMR(150 MHz,DMSO-d6)δ:164.3(C-2),104.0(C-3),182.5(C-4),162.9(C-5),99.7(C-6),165.7(C-7),94.7(C-8),158.3(C-9),104.8(C-10),122.3(C-1′),110.1(C-2′),148.7(C-3′),152.2(C-4′),116.7(C-5′),121.1(C-6′),55.8(-OCH3)。以上波谱数据与文献[15]报道的基本一致,故鉴定化合物9为3’-甲氧基木犀草素。
化合物10黄色粉末(甲醇);mp.262~264 ℃,ESI-MS:m/z579 [M+H]+,1H NMR(600 MHz,CD3OD)δ:6.84(1H,s,H-3),6.18(1H,d,J=1.5 Hz,H-6),6.78(1H,d,J=1.5 Hz,H-8),7.33(2H,d,J=8.5 Hz,H-2′,6′),6.82(2H,d,J=8.5 Hz,H-3′,5′),5.25(1H,d,J=8.5 Hz,H-1′′),5.12(1H,br s,H-1′′′),1.30(3H,d,J=6.0Hz,H-6′′′);13C NMR(150 MHz,CD3OD)δ:165.1(C-2),101.2(C-3),197.1(C-4),163.3(C-5),96.4(C-6),163.6(C-7),79.3(C-8),157.7(C-9),103.5(C-10),127.8(C-1′),129.4(C-2′,6′),115.0(C-3′,5′),163.3(C-4′),42.6(-OCH3),97.9(C-1′′),77.8(C-2′′),77.5(C-3′′),70.0(C-4′′),76.7(C-5′′),60.8(C-6′′),95.3(C-1′′′),70.7(C-2′′′),70.8(C-3′′′),72.5(C-4′′′),68.6(C-5′′′),16.8(C-6′′′)。以上波谱数据与文献[16]报道的基本一致,故鉴定化合物10为野漆树苷。
化合物11黄色粉末(甲醇);mp.177~178 ℃,ESI-MS:m/z609 [M-H]-,1H NMR(600 MHz,DMSO-d6)δ:6.18(1H,d,J=2.0 Hz,H-6),6.48(1H,d,J=2.0 Hz,H-8),7.43(1H,d,J=2.2 Hz,H-2′),6.82(1H,d,J=8.2 Hz,H-5′),7.54(1H,dd,J=8.2,2.2 Hz,H-6′),5.35(1H,d,J=7.4 Hz,H-1′′),4.39(1H,br s,H-1′′′),3.05~3.78(10H,sugars-H),12.63(1H,br s,5-OH),9.68(3H,br s,7,3′,4′-OH);13C NMR(150 MHz,DMSO-d6)δ:156.1(C-2),133.2(C-3),177.1(C-4),162.3(C-5),98.4(C-6),163.6(C-7),93.3(C-8),157.7(C-9),103.5(C-10),121.8(C-1′),115.4(C-2′),144.0(C-3′),148.3(C-4′),116.5(C-5′),121.4(C-6′),101.9(C-1′′),74.8(C-2′′),76.5(C-3′′),70.0(C-4′′),76.7(C-5′′),68.8(C-6′′),100.3(C-1′′′),70.7(C-2′′′),70.8(C-3′′′),72.5(C-4′′′),68.6(C-5′′′),17.8(C-6′′′)。以上波谱数据与文献[17]报道的基本一致,故鉴定化合物11为芦丁。
化合物12黄色粉末(甲醇);mp.218~220 ℃,ESI-MS:m/z431 [M-H]-,1H NMR(600 MHz,DMSO-d6)δ:6.48(1H,s,H-6),6.85(1H,s,H-8),8.05(2H,d,J=8.5 Hz,H-2′,6′),6.82(2H,d,J=8.5 Hz,H-3′,5′),4.66(1H,d,J=9.6 Hz,H-1′′),3.35~3.78(6H,m,sugars-H),13.22(1H,br s,5-OH);13C NMR(150 MHz,DMSO-d6)δ:163.1(C-2),102.2(C-3),182.1(C-4),156.3(C-5),104.4(C-6),162.6(C-7),98.3(C-8),161.7(C-9),104.5(C-10),121.8(C-1′),130.4(C-2′,6′),115.0(C-3′,5′),160.3(C-4′),73.9(C-1′′),70.8(C-2′′),78.5(C-3′′),70.0(C-4′′),81.7(C-5′′),61.8(C-6′′)。以上波谱数据与文献[17]报道的基本一致,故鉴定化合物12为异牡荆素。
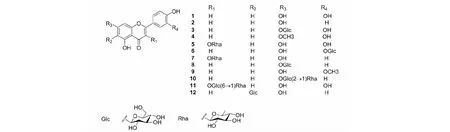
图1 化合物1~12化学结构Fig.1 Structures of compounds 1-12

图2 正常MH-S细胞与LPS诱导的MH-S细胞的形态Fig.2 The MH-S morphology of normal cell and LPS induction cell注:A1.正常MH-S细胞(100×);A2.正常MH-S细胞(200×);B1.LPS诱导MH-S细胞(100×);B2.LPS诱导MH-S细胞(200×)。 Note:A1.Normal MH-S (100×);A2.Normal MH-S(200×);B1.MH-S LPS induction (100×);B2.MH-S LPS induction (200×).
2.2 细胞毒性及抗炎活性
显微镜下观察发现(正常MH-S细胞与LPS诱导MH-S细胞的形态见图2),正常MH-S细胞和LPS诱导MH-S细胞均半悬浮生长,细胞呈圆形或不规则形;LPS造模后细胞悬液较为浑浊,细胞生长状态未见明显差别,说明本次实验所用的LPS造模浓度不会对细胞生长造成影响。
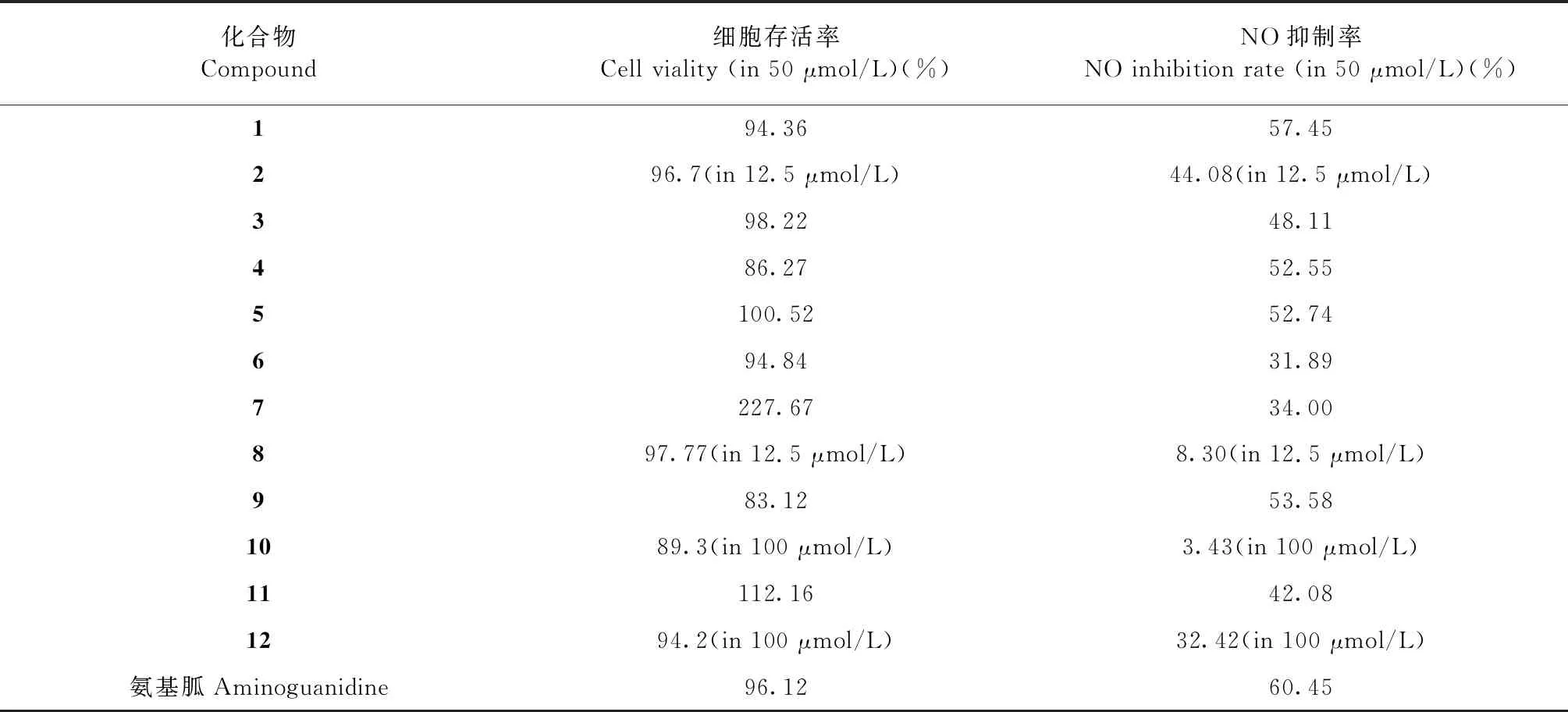
表1 化合物 1~12对 LPS 诱导的小鼠肺泡巨噬细胞 MH-S的细胞毒性和一氧化氮产生的抑制效果Table 1 Cytotoxicity and inhibitory effects of compounds 1-12 against LPS-induced NO production in mouse alveolar macrophage MH-S cells
由表1可知,化合物1、3、4、6、9、11在50 μmol/L浓度下对MH-S细胞24 h的细胞毒性较小,细胞存活率高,化合物2、8毒性较大,浓度为12.5 μmol/L时细胞存活率较高,化合物10、12毒性较小,在100 μmol/L浓度下细胞存活率较高,化合物5、7基本无毒性,且具有明显的促进细胞增殖的生物活性。
对化合物1~12在最佳给药浓度下进行抗炎活性筛选,发现被测试化合物对LPS诱导的MH-S细胞均有一定的抗炎活性,化合物1、3、4、5、9、11在浓度为50 μmol/L时均表现出了较好的抑制NO生成的活性,化合物2在浓度为12.5 μmol/L时表现出了较好的抗炎活性,对于这些化合物的潜在抗炎活性还有待进一步研究,化合物8、10基本无抗炎活性。构效关系分析结果表明不论在A环还是B环,酚羟基有助于抗炎活性的增强,无羟基化合物几乎无抗炎活性;酚羟基糖基化后,活性有所降低,甚至消失;B环邻位羟基取代时,活性显著增强;羟基甲氧基化后其抗炎活性显著增强。
2.3 抗补体活性结果
抗补体活性实验结果显示,12个黄酮类化合物除化合物4、9外均具有一定的抗补体活性,其中化合物1、6和10活性最好,化合物7、8活性较差(见表2),分析其构效关系可知,黄酮类化合物抗补体活性主要是由于其含有多个酚羟基,一般情况下酚羟基越多活性越好,这与文献报道一致[4];当黄酮C-3、C-7位双糖苷取代后,黄酮抗补体活性略有增强;当黄酮C-3、C-7位单糖苷取代同时C环邻羟基取代时,化合物抗补体活性明显增强;甲氧基取代后,活性显著下降,基本无活性;B环糖取代后,活性显著增强。
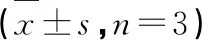
表2 鸦胆子中黄酮抗补体活性结果
3 结论
巨噬细胞是吞噬细胞的一种,是机体抵抗外来病原体入侵的重要组成部分,其主要功能是对病原体进行吞噬并激活免疫细胞进而引起炎症反应。肺泡巨噬细胞(MH-S)长期存在于肺泡中,是肺抵御外部侵袭的重要防线,在肺部免疫系统中发挥至关重要的作用[19]。肺部在受到外界致病因素的刺激时,会释放大量炎症因子,引起多种肺部疾病,如急性肺损伤、急性支气管哮喘、肺纤维化等。炎症反应是抵御病原微生物入侵机体的一种重要防御反应,LPS是革兰氏阴性菌细胞壁中的一种成分,能够诱导巨噬细胞释放大量炎症介质。本文基于LPS诱导的MH-S细胞模型,对鸦胆子果实中黄酮类化学成分进行抗炎及抗补体活性筛选研究。结果表明,化合物1、3、4、6、9、11在50 μmol/L浓度下对MH-S细胞24 h的细胞毒性较小,细胞存活率高,化合物2、8毒性较大,浓度为12.5 μmol/L时细胞存活率较高,化合物10、12毒性较小,在100 μmol/L浓度下细胞存活率较高,化合物5、7基本无毒性,且具有明显的促进细胞增殖的生物活性。被测化合物均表现出一定的一氧化氮(NO)抑制活性,构效关系明显,酚羟基越多活性越好,甲氧基化后,抗炎活性显著增强,糖基化后,活性略有降低;B环羟基取代对化合物抗炎活性影响最大, 2个羟基时活性最好,1个羟基次之,无羟基几乎无抑制作用,邻位羟基取代时,活性显著增强。此外,本实验还对化合物1~12进行了抗补体活性筛选,分析其构效关系可知,其抗补体活性主要与化合物所连接酚羟基的数目有关,一般情况下酚羟基越多活性越好;当黄酮C-3、C-7位双糖苷取代后,黄酮抗补体活性略有增强,当黄酮C-3、C-7位单糖苷取代同时C环邻羟基取代时,化合物抗补体活性明显增强;甲氧基取代后,活性下降,基本无活性;B环被糖取代后,活性增强。本文进一步丰富了苦木科鸦胆子属植物的研究内容,发现鸦胆子中成分通过抑制MH-S细胞的炎症效应,可能对急性肺损伤有一定的治疗作用,为鸦胆子的后期研究提供了一定的参考。
