木香烃内酯和去氢木香内酯对小鼠B16黑色素瘤细胞增殖和凋亡的影响
2020-02-02张景照王丹丹刘海霞唐旭东
刘 蕊,张景照,王丹丹,刘海霞,唐旭东*
1深圳清华大学研究院创新中药及天然药物研究重点实验室;2广东省创新中药及天然药物研究工程中心,深圳 518057
黑色素瘤,又称恶性黑色素瘤(malignant melanoma,MM),被称为“皮肤癌王”,是皮肤癌当中最危险的一种,增殖能力极强,是导致死亡人数最多的皮肤癌[1.2]。中国黑色素瘤检出率增加,每年新发病持续增长[3]。目前,常规治疗黑色素瘤的主要方法是手术、放疗和化疗,但存在创伤大、不良反应明显。木香烃内酯和去氢木香烃内酯是木香的主要活性物质。木香是我国知名传统中药。《中国药典》(2015版)收录木香为菊科植物木香AucklandialappaDecne.的干燥根[4]。《中国植物志》将木香置于菊科风毛菊属Saussurea,所以木香的拉丁名又为Saussureacostus(Falc.) Lipech.。药典记载具有行气止痛,健脾消食。用于胸胁、脘腹胀痛,泻痢后重,食积不消,不思饮食。煨木香实肠止泻。用于泄泻腹痛[4]。《本草通玄》记载木香外用研末调敷或密汁涂,可“理疝气”。木香外用还具有抑菌,治疗乳腺增生等功效。现代研究表明木香提取物、木香烃内酯和去氢木香内酯等具有多种药理活性,如抗炎[5]、促胃动力作用[6,7]、利胆[5,8]、抗支气管痉挛[9]和抗肿瘤[10]等。但是,目前对木香提取物、木香烃内酯(图1)和去氢木香烃内酯抗黑色素瘤的研究甚少。仅有报道称木香烃内酯能抑制IBMX-诱导的B16细胞黑色素的生成[11],文中侧重点是木香中单体化合物的分离和鉴定,并从美白化妆品的角度分析化合物对黑色素产生的影响。本文将研究木香烃内酯和去氢木香内酯单体化合物抗黑色素瘤增殖和凋亡的影响,并进一步深入研究其作用机制,旨在为抗黑色素瘤创新药物的研发提供理论依据。
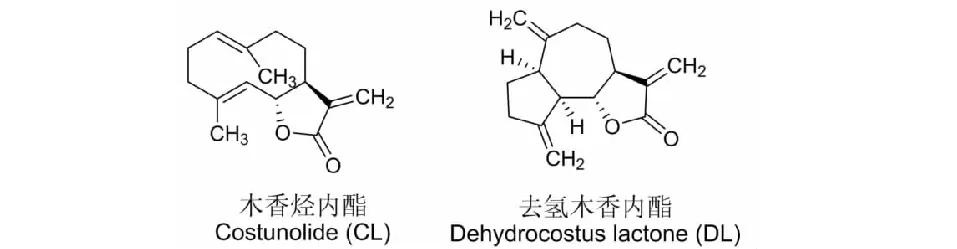
图1 化合物结构式Fig.1 The structure of compounds
1 材料与仪器
1.1 材料
小鼠B16黑色素瘤细胞(中国科学院典型培养物保藏委员会细胞库);木香烃内酯和去氢木香烃内酯(纯度﹥98%)(成都曼思特生物科技有限公司);RPMI 1640培养基、胰酶、双抗、PBS、胎牛血清(Gibco公司);噻唑蓝(MTT)和二甲基亚砜(DMSO)(美国Sigma公司);Annexin V-FITC凋亡检测试剂盒和DAPI染色液(碧云天生物技术研究所);抗体Ki-67、PI3K、Bax、Bcl-2、β-Actin(美国Cell Signaling Technology公司)。
1.2 仪器
二氧化碳培养箱(日本SANYA公司);荧光倒置显微镜(日本Olympus公司);高压湿热灭菌器(日本SANYA公司);酶标仪(美国Thermo公司);Airstream II级A2型生物安全柜(新加坡艺思高公司);流式细胞仪(美国BD公司);Tanon化学发光图像分析系统(上海天能公司)。
2 方法
2.1 细胞培养
小鼠B16黑色素瘤细胞培养于含10%胎牛血清和1%双抗(100 U/mL链霉素及100 U/ mL青霉素)的RPMI 1640培养基中,37 ℃,5% CO2的细胞培养箱中培养,1~2天更换培养基,细胞长至70%~80%融合度时,细胞传代培养。
2.2 细胞增殖测定
取对数生长期的小鼠B16黑色素瘤细胞,显微镜下细胞计数后,细胞浓度调整为1×105个/mL,接种到96孔板,每孔100 μL细胞液,即1×104个/孔,细胞贴壁生长过夜后,分别加入100 μL含药的新鲜培养基,药物浓度设置为3.125、6.25、12.5、25、50 μM,同时设有未加药的空白对照组,每组设置6个复孔,分别培养24、48和72 h,每孔加入20 μL MTT溶液,细胞培养箱中继续培养4 h,弃去旧培养基,每孔加入200 μL DMSO,酶标仪A570nm测定吸光度值。
细胞增殖抑制率=(A空白组-A给药组)/A空白组
×100%
2.3 DAPI染色
取3 mL 1×105个/mLB16细胞液,接种到置有玻片的60 mm培养皿中,贴壁生长过夜后,弃去旧培养基,加入含不同浓度药物的新鲜培养基,设置空白对照组,置于细胞培养箱中继续培养48 h后,用PBS洗两次,加入预冷的75%的乙醇,4 ℃冰箱内固定过夜,弃去固定液,加入PBS洗3次,加入DAPI染色液,37 ℃避光30 min,PBS洗后,荧光倒置显微镜下观察细胞形态,并拍照分析。
2.4 流式细胞仪FCM检测分析细胞凋亡
取3 mL 1×105个/mL B16细胞液,接种到的60 mm培养皿中,贴壁生长过夜后,弃去旧培养基,加入含不同浓度药物的新鲜培养基,设不加药物组为对照组。置于细胞培养箱中继续培养48 h后,用不含EDTA的胰酶消化细胞,1 000 rpm离心5 min,弃上清,用PBS洗两遍,用PBS重悬细胞,取1×104个重悬细胞,离心后,加入195 μL Annexin V-FITC结合液,轻轻重悬细胞。加入5 μL Annexin V-FITC染色液,轻轻混匀,加入10 μL PI,轻轻混匀。室温避光孵育20 min,随后置于冰上,流式细胞仪检测,进行凋亡率分析。
2.5 Western blot检测凋亡蛋白
分别收集对照组细胞,及不同浓度药物处理48 h的B16细胞,加入配置好的含蛋白酶和磷酸酶抑制剂的RIPA细胞裂解液冰上充分裂解,提取蛋白。BCA蛋白定量试剂盒测定蛋白浓度。按照蛋白样品与5×loading buffer体积比4∶1制备,95度8 min变性。取40 μg蛋白进行聚丙烯酰胺凝胶电泳,电转移至PVDF膜上,5%脱脂奶粉封闭1 h,加入稀释好的一抗(表2)4 ℃孵育过夜,TBST洗膜3次,每次5 min,二抗室温孵育1 h,TBST洗膜3次,每次5 min,加入显影液,Tanon化学发光图像分析系统,采集图像,进行条带分析。
2.6 统计学分析
数据以平均值±标准差来表示。用SPSS软件进行统计分析,用One-way ANOVA进行分析,方差齐性采用F检验,组间两两比较采用Fisher’s Protected LSD test分析,P<0.05判定为统计学上差异显著,P<0.01判定为统计学上差异极显著。
3 结果与讨论
3.1 对B16细胞增殖的影响
木香烃内酯(CL)和去氢木香内酯(DL)处理小鼠B16黑色素瘤细胞24、48 h后,和未给药空白对照组相比,能明显抑制小鼠B16黑色素瘤细胞增殖(图2和图3)。CL和DL在0~100 μmol/L处理B16细胞时,抑制率随着浓度的增加而增大;且随着时间的增加,抑制率也在增大。如浓度为25 μmol/L的CL对B16细胞24 h时的抑制率为42.01%,48 h时抑制率为62.23%(图2)。CL处理B16细胞24 h,48 h的IC50值分别为28.34 μmol/L和19.21 μmol/L。如浓度为25 μmol/L 的DL对B16细胞24 h时的抑制率为40.21%,48 h时抑制率为60.06%(图3)。DL处理B16细胞24 h,48 h的IC50值分别为29.54 μmol/L和21.22 μmol/L。可见,CL和DL均具有抗B16黑色素瘤细胞的潜在能力,值得进一步深入研究。
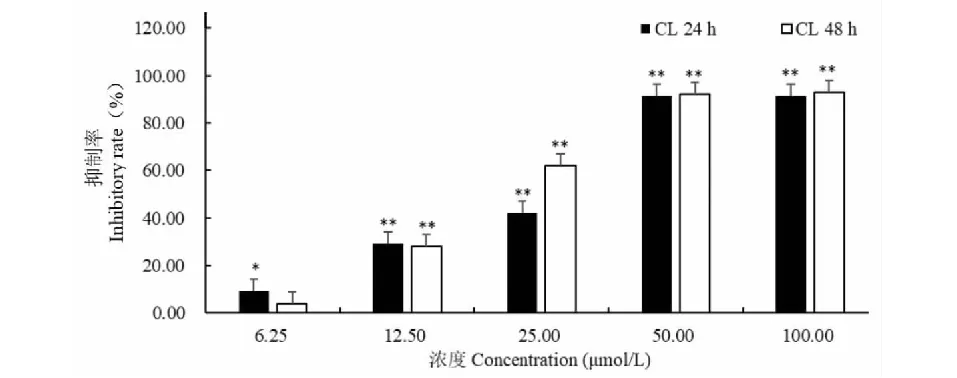
图2 木香烃内酯(CL)对B16细胞增殖的影响Fig.2 The effect of costunolide on proliferation of B16 cells注:与空白对照组比较,*P<0.05,具有显著性差异; **P<0.01,具有极显著性差异,下同。Note:Compared with blank control,*P<0.05,significant difference;**P<0.01,extremely significant difference,the same below.
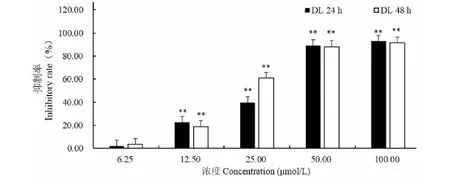
图3 去氢木香内酯(DL)对B16细胞增殖的影响Fig.3 The effect of dehydrocostus lactone on proliferation of B16 cells
3.2 细胞形态变化
CL和DL处理B16细胞后,显微镜下观察细胞的数目明显减少,出现收缩,消解现象。DAPI染色后在倒置显微镜下观察CL对B16细胞形态的影响(图4),CL处理B16细胞48 h后,细胞形态发生明显变化,主要是凋亡相关形态学的改变,包括细胞收缩、高染色质凝聚、凋亡体的可见形成和核降解。说明CL引起了B16细胞凋亡。
3.3 流式细胞仪分析B16细胞凋亡率
流式细胞仪检测CL诱导B16细胞凋亡,不同浓度的CL处理B16细胞48 h后,流式检测结果发现CL能显著诱导B16细胞凋亡,增加细胞凋亡数目,而且随着浓度的增加,细胞凋亡率也在增加。CL处理细胞48 h后,浓度为25 μmol/L的CL诱导35.1%的B16细胞凋亡;浓度为50 μmol/L的CL诱导50.2%的B16细胞凋亡;浓度为100 μmol/L的CL诱导57.6%的B16细胞凋亡(图5)。流式结果,结合显微镜观察结果,明确了CL能够诱导B16黑色素瘤细胞凋亡。
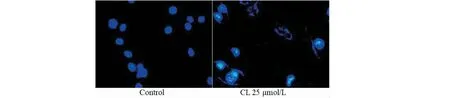
图4 CL对B16细胞形态变化的影响(DAPI染色)Fig.4 Effect of CL on morphology of B16 cells (DAPI staining)

图5 流式细胞仪分析木香烃内酯对B16细胞的凋亡率Fig.5 The apoptosis rate analysis of FCM in B16 cells
3.4 凋亡蛋白
Western blot实验结果表明,CL处理组B16细胞48 h后,不同浓度(25、50、100 μmol/L)CL组细胞内Cyt-C、Cleaved caspase-3和Cleaved caspase-9表达明显升高,并成浓度依赖性促进B16细胞凋亡,与空白对照组相比,差异具有统计学意义(P<0.05)(图6)。
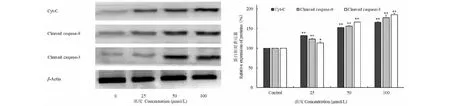
图6 Western blot分析木香烃内酯对B16凋亡相关蛋白表达Fig.6 The apoptosis protein changes of CL in B16 cells analyzed by Western blot
3.5 PI3K/AKT通路
Western blot实验结果表明,不同浓度木香烃内酯(25、50、100 μmol/L)处理B16细胞48 h后,能够抑制B16恶性黑色素瘤细胞中PI3K和AKT蛋白的表达(图7)。这种抑制作用呈现出浓度趋势,浓度越高抑制作用越明显。PI3K/AKT信号通路调控细胞增殖和凋亡,对该通路的调控,能够影响Bcl-2家族蛋白的活性。
实验证实,木香烃内酯确实能抑制B16黑色素瘤细胞中Bcl-2的表达,并促进Bax蛋白表达(图7)。细胞内与线粒体膜通透性蛋白Bax发生作用的Bcl-2蛋白受到了木香烃内酯的抑制,从而线粒体膜通透性得到了提高,线粒体释放Cyt-C,促进caspase-9和caspase-3的表达,最终促进B16细胞发生凋亡。
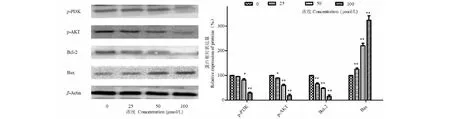
图7 Western blot分析CL对B16细胞PI3K/AKT通路的作用Fig.7 Effect of CL on PI3K/AKT pathway in B16 cells
恶性黑色素瘤被称为“皮肤癌王”,是皮肤癌致死的主要元凶。目前手术、放疗和化疗对于恶性黑色素瘤的治疗不明朗,存在一系列的问题,如手术造成的创伤和术后后遗症;化疗药物的副作用脱发、恶心、肝肾损伤;放疗不敏感等。中药是天然药物的宝库,在中医理论的指导下,借鉴现代医学手段,越来越受到科学家和医学工作者的重视。木香烃内酯和去氢木香内酯能够抑制B16细胞增殖,并成浓度和时间依赖。据报道,木香烃内酯能够抑制黑色素瘤细胞SK-MEL-2的增殖,并成浓度依赖趋势,木香烃内酯处理细胞48 h后,IC50为0.5 μg/mL,文中未对抑制增殖机理、细胞凋亡和作用机制进行研究[12]。诱导肿瘤细胞凋亡是抗癌的主要思路之一。木香烃内酯和去氢木香内酯是木香的主要成分,木香是一些中成药的常见成分,可内服,可外用。CL诱导B16细胞凋亡可能是通过线粒体释放Cyt-C从而激活caspase凋亡通路,最终引起B16细胞凋亡,起到抗黑色素瘤的作用。Ding等[13]研究表明细胞色素C参与新狼毒素A诱导人黑色素瘤A375细胞凋亡过程,下调Bcl-2蛋白的表达。这与文献报道木香烃内酯诱导肺癌A549细胞凋亡的途径一致[14],木香烃内酯还能促进激活促凋亡因子Bax的表达和抑制抗凋亡因子Bcl-2的表达来抑制人非小细胞肺癌A549细胞增殖,并促进其凋亡[15]。去氢木香内酯引起线粒体跨膜电位降低而破坏了线粒体的结构,进一步阻碍了线粒体的功能,导致了细胞内代谢物的紊乱,最终诱导了人类乳腺癌细胞 MCF-7细胞的凋亡[11]。木香中部分有效成分的抗肿瘤机制通过引起线粒体通透性转换(MPT)、细胞色素C释放或破坏线粒体膜电位而诱导人白血病细胞HL-60凋亡[16]。
本文发现CL和DL能抑制小鼠黑色素瘤细胞B16的增殖,并能诱导B16细胞凋亡。研究表明,木香烃内酯通过抑制恶性黑色素瘤细胞中PI3K/AKT通路激活,抑制Bcl-2蛋白的表达,促进线粒体膜通透性蛋白Bax的表达,使线粒体膜通透性增加,释放了细胞色素C,从而促进caspase-9和caspase-3的表达,最终促进B16细胞发生凋亡。本文为开发出以木香烃内酯和去氢木香内酯为原料的抗黑色素瘤创新中药提供理论依据,为抗黑色素瘤提供新的解决思路。
