探析参附注射液治疗新型冠状病毒肺炎合并急性肾损伤的网络药理分子机制
2020-02-02姜茗宸陶嘉磊
张 厦,姜茗宸,陶嘉磊,袁 斌
南京中医药大学附属医院,南京 210029
由新型冠状病毒(SARS-CoV-2)引起的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是一种具有强传染性的急性呼吸道疾病,主要是以呼吸道飞沫和密切接触的途径传播,人群普遍易感,潜伏期约为1~14天,常合并其他器官功能损害[1]。COVID-19早期病程的症状与一般病毒性感冒十分相似,主要表现为发热、干咳、乏力、肌肉酸痛。随着病情的发展,严重者可出现呼吸困难、低氧血症等,危重者可发生多器官功能障碍,如:急性肾损伤(acute kidney injury,AKI)、急性呼吸窘迫综合征、脓毒症休克等[2]。AKI作为新型冠状病毒肺炎的主要并发症之一,与患者住院死亡率增长呈正相关[3]。COVID-19 病原体基因序列与严重急性呼吸综合症(sever acute respiratory syndrome,SARS)的病原体相似性高达79%,据报道,有6.7%的SARS患者发展为AKI,而AKI患者的死亡率为91.7%[4]。COVID-19与SARS均可通过血管紧张素转换酶II(angiotensin-converting enzyme II,ACE2)感染细胞,由于ACE2在肾脏中的高浓度表达,使其成为病毒侵犯的重要靶器官之一[5]。目前多项临床研究报告显示,在所有COVID-19住院患者中AKI合并发生率为3%,当患者被送入ICU时,AKI的发生率增加到了19%,大多数患者在入院后第7天出现AKI[6]。所以在COVID-19的常规治疗中,无论过去是否有肾脏病史,临床医生都应采取措施保护患者肾脏功能。
目前临床对于COVID-19合并AKI的治疗方案包括一般治疗、支持治疗以及肾脏替代治疗,尚无有效的抗病毒治疗,中医药在临床治疗中发挥着“未病先防、既病防变”的防治特色,这对于减少COVID-19所致AKI患者的死亡率具有重要意义。由国家卫生健康委员会出台的《新型冠状病毒感染的肺炎诊疗方案》从试行第五版开始,明确提出不同阶段可根据中医辨证疗法进行中医药干预,在危重症患者治疗中,推荐使用参附注射液。参附注射液在国家、各省市出台的23种中医药防治COVID-19的治疗方案中都有重要地位[7]。参附注射液由红参和附子两味中药组成,是由古方“参附汤”衍变制成的中药注射剂。参附注射液具有回阳救逆,益气固脱的功效,主治厥脱及阳虚诸证,可应用于各种休克、心力衰竭、心律不齐、急性肾损伤等临床病症中[8]。对于COVID-19合并AKI患者,参附注射液具有维持促炎/抗炎平衡,双向调节严重脓毒症免疫紊乱的作用,可改善临床疗效[9],但是其药理分子机制尚不明确。
网络药理学是基于“疾病—基因—靶点—药物”相互作用网络的基础上,中药研究通过网络分析,可以系统综合地观察药物对疾病网络的干预与影响,揭示多分子药物协同作用于人体的奥秘,与中药及其复方的多成分、多途径、多靶点协同作用的原理殊途同归[10]。再通过分子对接验证网络药理学主要活性成分与关键蛋白结合,为今后实验方向提供新思路。
1 材料与方法
1.1 材料
TCMSP数据库(http://tcmspw.com/tcmsp.php);Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/);Gene Cards数据库(https://www.genecards.org/);STRING数据库(https://string-db.org/);PDB数据库(https://www.rcsb.org/);Venny 2.1在线软件作图平台(https://bioinfogp.cnb.csic.es/tools/venny/);Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/);Cytoscape 3.8.0软件;DAVID数据库(https://david.ncifcrf.gov/);Open Babel 2.3.2软件;PYMOL 2.3.4软件;Autodock 4.2.6软件;AutoDock Vina 1.1.2软件等。
1.2 方法
1.2.1 参附注射液中化合物筛选与潜在靶点预测
在TCMSP数据库[11]中检索红参、附子的化学成分,再结合相关文献补充。每个化合物通过Pubchem数据库获得2D化学结构文件,保存为SDF格式用于靶点预测。因参附注射液给药方式为静脉注射,故将收集到的化合物全部纳入分析[12]。将化合物的SDF文件导入Swiss Target Prediction数据库[13],以“homo sapiens”为研究物种,筛选得到预测靶点。通过UniProt数据库对获得的靶点信息进行规范统一。整合、去重后得到参附注射液的潜在作用靶点。
1.2.2 COVID-19与AKI疾病靶点的获取
利用Genecards数据库,以“novel corona virus ”、“acute kidney injury”为关键词检索,得到COVID-19和AKI的相关作用靶点。
1.2.3 参附注射液治疗COVID-19及AKI共同靶点的筛选
将化合物、COVID-19和AKI的相关基因通过Venny2.1在线作图工具平台绘制韦恩图,得到三者交集,获得参附注射液治疗COVID-19及AKI的共同靶点。
1.2.4 (蛋白相互作用)PPI网络构建与分析
将“1.2.3”项下筛选得到的共有靶标蛋白上传至STRING平台,选择“multiple proteins”模式,蛋白种属设为“homo sapiens”,筛选条件为“medium confidence(0.400)”,得到PPI网络数据,将其导入Cytoscape软件,绘制PPI网络图,根据 Degree值筛选出核心靶点,图中节点的大小与Degree值呈正相关。
1.2.5 基因富集分析
利用DAVID 6.8数据库,将“1.2.3”项下获得的潜在共同靶点上传进行GO和KEGG的富集分析。选取“gene ontology”,进行生物过程、细胞组分和分子功能的富集分析;选取“pathways”进行KEGG通路分析,以FDR≤0.05作为条件筛选,P值从小到大排列,选取与疾病相关的前20条进行可视化分析。
1.2.6 构建中药-成分-靶点-通路网络
将“1.2.5”项下得到的前20条通路、其包含的靶点、靶点对应的药物活性分子及成分对应的中药,利用Cytoscape 3.8.0软件构建为中药—成分—靶点—通路网络,用Network Analyzer功能对方中的主要活性成分、靶点、通路进行分析。筛选出大于中位度值的核心活性分子。
1.2.7 分子对接验证
通过Pubchem数据库下载主要活性成分的结构,保存为SDF文件并利用Open Babel 2.3.2将SDF文件转化为PDB文件,从PDB数据库中检索获得受体蛋白ACE2(PDB ID:1R42)、Mpro(PDB ID:6LU7),利用PYMOL 2.3.4对受体蛋白进行去水、去配体等操作,采用Autodock 4.2.6对两个受体蛋白进行加氢以及计算电荷处理,将受体蛋白和配体小分子分别转化为pdbqt格式,利用AutoDock Vina 1.1.2进行核心相关活性成分的分子对接。
2 结果
2.1 参附注射液潜在活性成分与潜在靶点预测
根据TCMSP数据库搜索结合文献补充,红参中化合物74种、附子65种,共139种。删除重复项后共有137种。通过Swiss Target Prediction数据库预测潜在作用靶点,去重后共有714个。
2.2 疾病靶点预测及共同靶点筛选
检索GeneCards数据库得到COVID-19的相关靶点 351个,AKI的相关靶点6 354个。将参附注射液、COVID-19及AKI的相关靶点输入Venny 2.1在线作图工具平台获得韦恩图,得到三者交集靶点共64个,韦恩图见图1。
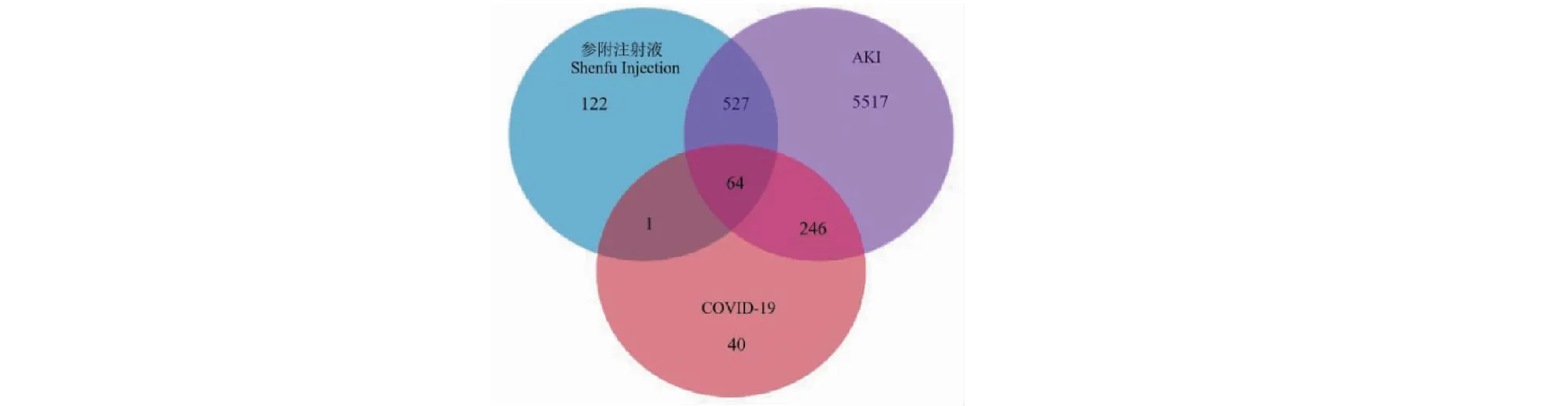
图1 参附注射液、COVID-19、AKI靶点的韦恩图Fig.1 Venn diagram analysis of Shenfu Injection and COVID-19 with AKI
2.3 PPI网络分析及核心靶点筛选
在STRING中录入参附注射液治疗COVID-19合并AKI的64个共同靶点。除PCSK7、F10、ENPP1、PTGDR与其他蛋白之间无相互作用被排除。由图2可知,该网络包括60个节点、495条边、平均度值(degree)为15.5,节点的度值越大说明其在网络中发挥的作用越重要。排名前十的靶点见图3,为甘油醛-3-磷酸脱氢酶(GAPDH)、肿瘤坏死因子(TNF)、白细胞介素 6(IL6)、丝裂原活化蛋白激酶3(MAPK3)、丝裂原活化蛋白激酶1(MAPK1)、胱天蛋白酶3(CASP3)、表皮生长因子受体(EGFR)、白细胞介素2(IL2)、丝裂原活化蛋白激酶8(MAPK8)、丝裂原活化蛋白激酶14(MAPK14),提示可能是通过这些关键靶点使参附注射液发挥治疗COVID-19合并AKI的临床疗效。

图2 参附注射液治疗COVID-19合并AKI的PPI网络图Fig.2 Target PPI network of Shenfu Injection in treatment of COVID-19 with AKI
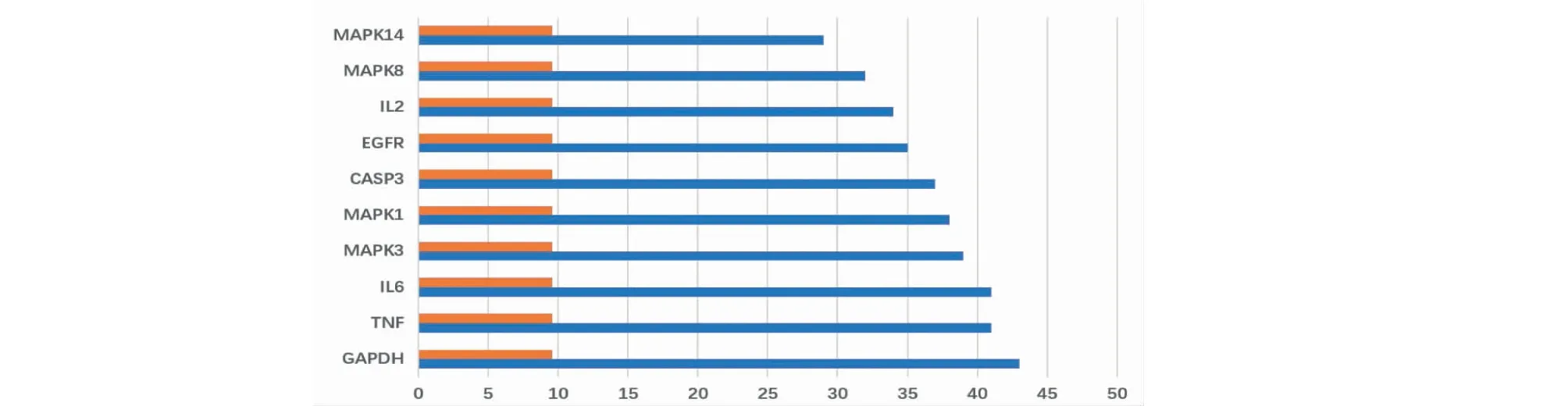
图3 关键靶点信息Fig.3 Information of key targets注::PPI网络所有靶点度值平均值;:靶点度值。 Note::The average value of all target degree values of PPI network;:Target degree value.
2.4 GO生物过程和KEGG的基因富集分析
将“2.2”得到的参附注射液治疗COVID-19合并AKI的共同靶点导入DAVID数据库,得到(FDR≤0.05)GO生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cellular component,CC)条目分别为24、15、6条。按P值从小到大排列,各选取前5条进行可视化,见图4。KEGG富集分析以FDR≤0.05作为条件筛选得到条目67条,按P值从小到大排列,选取与COVID-19合并AKI疾病相关的前20条进行可视化分析,见图5。在之前得到的64个共同靶点中,有46个靶点基因参与了这前20条相关通路富集,主要涉及磷脂酰肌醇3激酶(PI3K)/AKT(蛋白激酶B)信号通路(PI3K-Akt signaling pathway)、Janus激酶/信号转导与转录激活子(JAK-STAT signaling pathway)信号通路、血管内皮生长因子信号通路(VEGF signaling pathway)、低氧诱导因子-1 信号通路(HIF-1 signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)、鞘脂信号通路(sphingolipid signaling pathway)、T细胞受体信号通路(T cell receptor signaling pathway)、mTOR信号通路(mTOR signaling pathway)、细胞凋亡(apoptosis)等。
2.5 构建中药—成分—靶点—通路网络
经1.2.5筛选后,利用Cytoscape 3.8.0软件构建为中药—成分—靶点—通路的多维网络,见图6。筛选出大于中位度值的活性成分和靶点作为核心活性分子和核心靶点,活性分子有21种,其中红参14种、附子6种、红参和附子的共有成分1种,见表1。推测这21种成分是参附注射液治疗COVID-19合并AKI的主要活性成分,用于后续的分子对接验证。
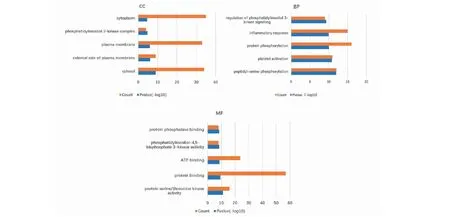
图4 参附注射液治疗COVID-19合并AKI靶点GO富集分析Fig.4 GO enrichment analysis of Shenfu Injection in treatment of COVID-19 with AKI
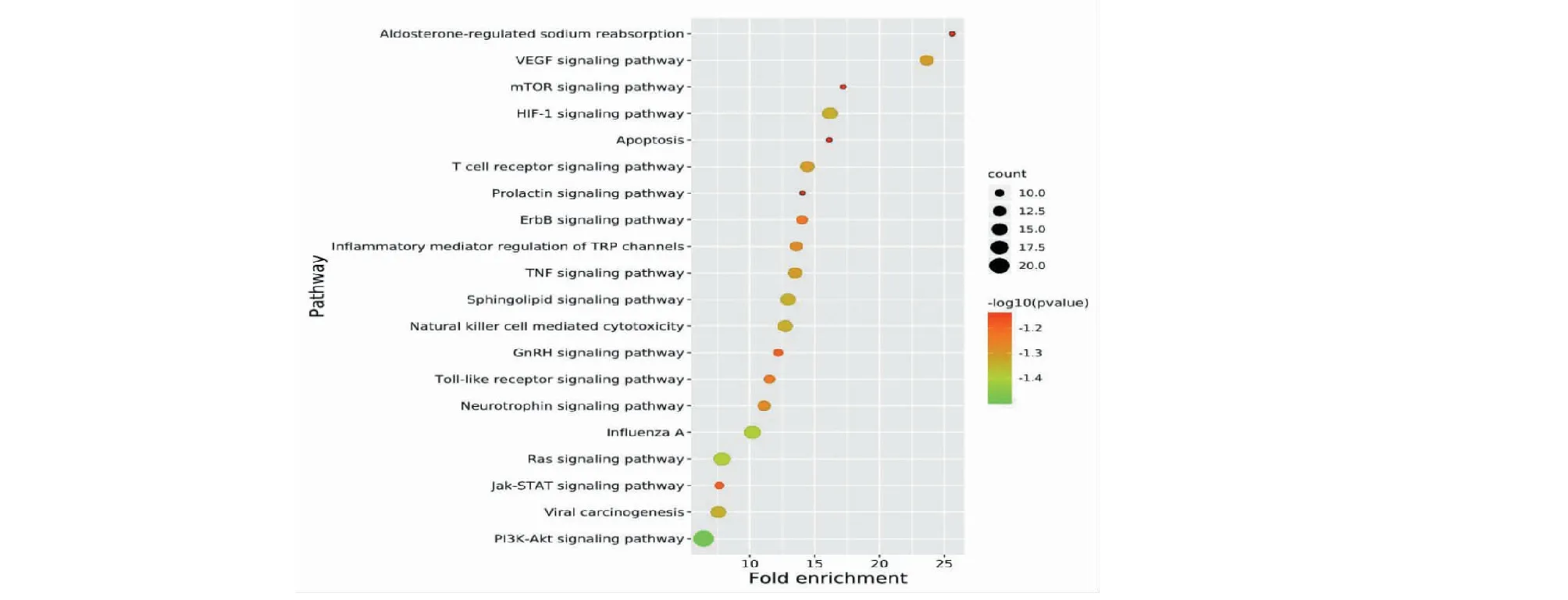
图5 参附注射液治疗COVID-19合并AKI靶点KEGG信号通路分析Fig.5 KEGG pathway enrichment analysis of Shenfu Injection in treatment of COVID-19 with AKI
2.6 参附注射液主要活性成分与COVID-19关键靶点的分子对接验证
ACE2是SARS-CoV-2感染细胞的必需蛋白,SARS-CoV-2与SARS-CoV均可与ACE2结合进入细胞[5]。SARS-CoV-2 3CL水解酶(Mpro)是单正链RNA病毒前体多聚蛋白水解的核心蛋白酶,在单正链RNA病毒复制过程是十分依赖于Mpro活性的,并且人体内缺乏同源的蛋白酶,使其成为一个有吸引力的蛋白酶抑制剂作用靶标[14]。故在“2.5”获得的21种核心相关活性成分后,与目前临床COVID-19治疗推荐用药利巴韦林(ribavirin)、洛匹那韦(lopinavir)分别与COVID-19关键靶点Mpro、ACE2进行分子对接,配体和受体结合的构象越稳定,结合能越低,结合力越强,各活性成分的结合能显示于图7。分子对接的结果显示,参附注射液的主要活性成分都能与ACE2和Mpro结合,其中人参皂苷Rc(ginsenoside Rc)、人参皂苷Rh2(ginsenoside Rh2)、人参皂苷Rg3_qt(ginsenoside Rg3_qt)、人参皂苷Rg3(ginsenoside Rg3)、乌头生物碱-苯甲酰萘胺(benzoylnapelline)与ACE2和Mpro的结合能较低,且在中药—成分—靶点—通路网络中度值较高,可能是参附注射液治疗COVID-19合并AKI的主要成分。其中ACE2受体蛋白与人参皂苷Rc配体小分子结合能最低(-9.4 kcal/mol)、Mpro受体蛋白与人参皂苷Rh2配体小分子结合能最低(-9 kcal/mol),利用PyMOL进行三维展示,见图8、9。
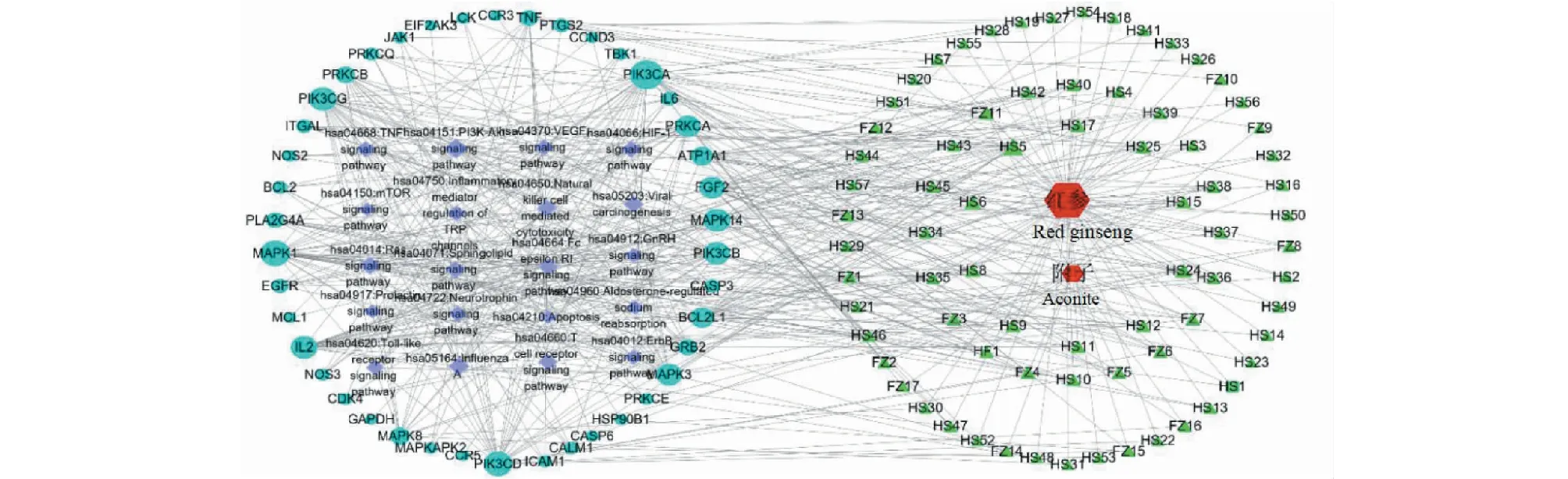
图6 参附注射液治疗COVID-19合并AKI的中药—成分—靶点—通路网络Fig.6 Drug-composition-target-pathway diagram of Shenfu Injection in treatment of COVID-19 with AKI
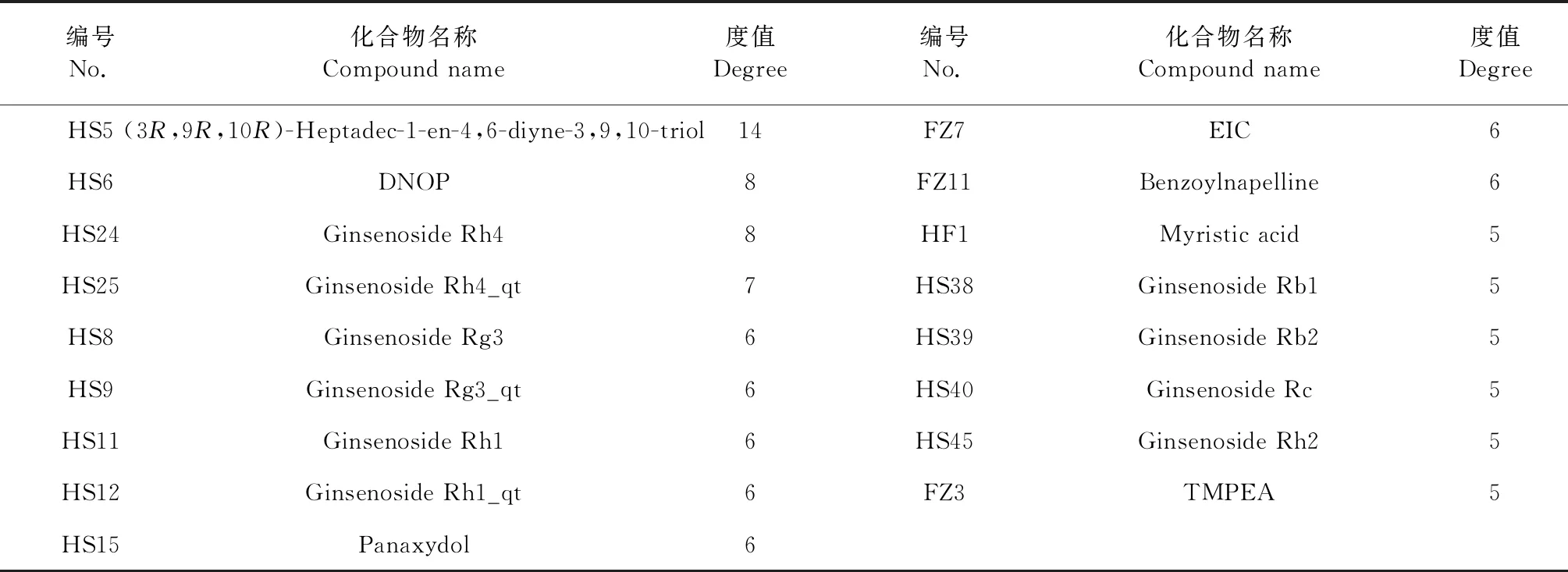
表1 参附注射液中大于中位度值的活性成分Table 1 Compounds in Shenfu Injection greater than the median degree
3 讨论
参附注射液具有回阳救逆、益气固脱的功效,因注射针剂起效迅速、使用方便、避免了因煎煮不当而附子中毒可能性,已成为多地中成药防治COVID-19推荐用药。为了探究参附注射液治疗COVID-19合并AKI的作用机制,通过研究参附注射液(红参、附子)的有效成分,构建中药—成分—靶点—通路网络,分析活性成分、靶点、通路相互作用的关系,结合分子对接的验证、为参附注射液多成分、多靶点、多通路治疗COVID-19合并AKI提供了理论基础。
细胞因子是由基质细胞和免疫系统细胞分泌的一组小蛋白,主要用于细胞间信号传递和交流,并具有多种生物学功能,例如调节先天免疫、适应性免疫、细胞生长和分化以及修复损伤组织。细胞因子主要包括白介素(IL)、肿瘤坏死因子(TNF)、趋化因子和生长因子等。当人体被细菌和病毒入侵时,免疫系统会释放出大量的细胞因子,促炎性细胞因子的过度释放和失控导致细胞因子风暴。这次COVID-19感染的患者在后期会突然恶化,细胞因子(如IL-1β、IL-2、IL-6、IL-8、IL-10、TNF-α和IFN-γ)明显升高,尤其是IL-6,最终死于多器官功能衰竭,加重的主要原因是细胞因子风暴[15]。本研究再次强调了COVID-19炎症反应异常,PPI网络显示TNF、IL-6、IL-2、FGF2、ICAM1等靶点,同时与参附注射液作用靶点产生交集。其中TNF是触发全身炎症反应的关键因子,能诱导如IL-6等其他细胞因子的释放,而CCR1、CCR3等趋化因子受体则可介导更严重的炎症反应,MAPK1、MAPK3等丝裂原活化蛋白激酶家族成员也影响着机体免疫反应。从GO生物富集结果和KEGG通路显示,参附注射液治疗COVID-19合并AKI的作用机制涉及了炎症反应、蛋白质磷酸化、肽基丝氨酸磷酸化、血小板活化生物功能,以及JAK-STAT、VEGF、TNF信号通路,从生物功能及通路诠释了炎症的在病理过程中的重要性。事实上,蛋白质磷酸化主要发生在两种氨基酸上,一种是丝氨酸,另一种是酪氨酸。丝氨酸磷酸化的主要作用是变构蛋白质以激活蛋白质的活力,主要是指酶活力。酪氨酸则结合蛋白提供一个结构基因,以促进其和其他蛋白质相互作用而形成多蛋白复合体,蛋白复合体的形成再进一步促进蛋白质的磷酸化。通路富集分析结果中的JAK-STAT信号通路似乎解释了本研究的生物富集结果,当STAT蛋白被JAK磷酸化、二聚化后通过核膜转运到细胞核中以调节相关基因的表达,这样就以简单有效的方式促进由过量细胞因子介导的细胞因子风暴[16],而且各种细胞因子和生长因子都可通过JAK-STAT信号传导途径传递信号,包括表皮生长因子(EGF)、血小板衍生生长因子(PDGF)等,IL-6(依赖JAK-STAT的细胞因子)也可以通过JAK1、JAK2和/或TYK2发出信号,并激活T细胞中的STAT3[17]。因此,参附注射液可能通过减轻促炎性细胞因子的过度释放,有助于防止进一步的伤害,众所周知,有多种抗炎药,包括JAK抑制剂。此类药物在重症COVID-19的治疗中特别重要。
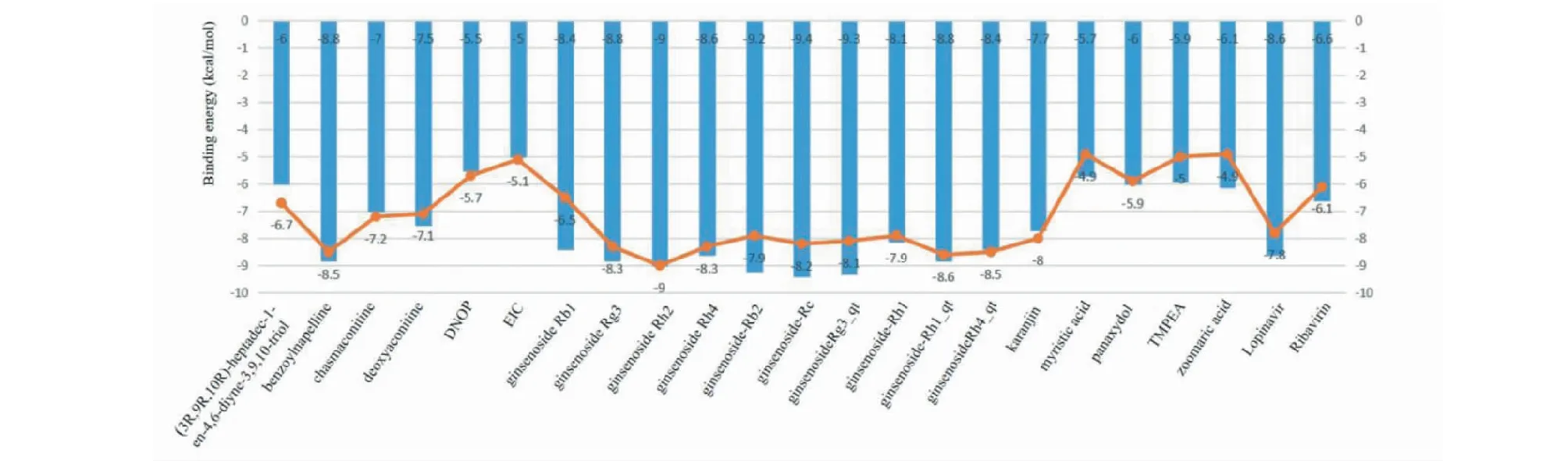
图7 参附注射液主要成分分子对接结果Fig.7 Docking results of main components of Shenfu Injection注:: 各活性成分与ACE2的结合能;:各活性成分与Mpro的结合能。Note::The binding energy of each active ingredient and ACE2; : The binding energy of each active ingredient and Mpro.
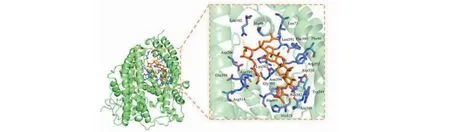
图8 人参皂苷Rc与ACE2受体蛋白的分子对接模式Fig.8 Molecular docking pattern of ginsenoside Rc with ACE2
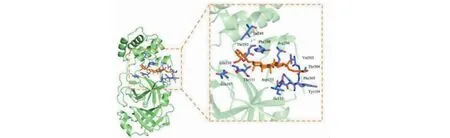
图9 人参皂苷Rh2与Mpro受体蛋白的分子对接模式Fig.9 Molecular docking pattern of ginsenoside Rh2 with Mpro
值得注意的是,GO生物富集结果涉及了PI3K信号转导的调控,同时在KEGG通路研究中发现了PI3K/Akt/mTOR信号通路作为药物—疾病交集靶点,PI3K/AKT/mTOR信号通路是细胞生长、存活、增殖、凋亡、逆转录和自噬的重要细胞内信号转导途径[18]。当病毒进入体内后,普遍对PI3K/AKT/mTOR信号通路产生影响,如:人类乳头瘤病毒、粘液瘤病毒,包括与COVID-19同源性极高的中东呼吸综合征冠状病毒,在病毒感染期间都能够维持激活AKT通路,从而激活mTORC1,这种持续激活是启动病毒复制、存活必备条件之一,目前抑制PI3K/AKT/mTOR和ERK/MAPK的信号通路的持续激活,已被广泛的作为病毒病原体的靶向治疗和预防[19]。此外,众所周知,在临床上COVID-19及AKI患者最终威胁生命来自于肺纤维化、肾纤维化,PI3K/AKT/mTOR通路的异常激活在纤维化疾病中十分重要,因为mTOR信号不仅调节细胞自噬,还调节肺纤维化,研究表明抑制PI3K/AKT/mTOR信号通路可以起到抗肺纤维化作用,药物通过阻断PI3K/AKT/mTOR通路上游TGF-β1信号传导后,可以减少肾组织中系膜基质的积聚,防止肾组织的纤维化[20],说明参附注射液可能通过对PI3K/AKT/mTOR信号通路进行干预,起到了减少病毒启动/存活,减轻脏器(肺肾)的炎症损伤,预防受损脏器纤维化作用,这从理论上似乎解释了参附注射液临床上对COVID-19合并AKI患者的部分疗效机制。
为了寻求参附注射液治疗COVID-19合并AKI的物质基础,进一步进行分子对接。ACE2充当SARS-CoV-2的Spike受体结合域(RBD)的特异性受体,靶向ACE2可以被认为是阻止SARS-CoV-2进入宿主细胞的宿主特异性疗法,并且可能有助于设计用于治疗COVID-19的新型附着抑制剂。Mpro蛋白,对于SARS-CoV-2的蛋白水解成熟至关重要。Mpro裂解病毒多蛋白,生成12种非结构蛋白(Nsp4-Nsp16)。抑制Mpro将阻止病毒复制,因此构成了潜在的抗冠状病毒策略之一。经与ACE2、Mpro靶点对接后发现,与利巴韦林、洛匹那韦相比,选定的人参皂苷-Rc和人参皂苷Rh2都对ACE2、Mpro表现出更好的结合亲和力,人参皂苷-Rc在SARS-CoV-2细胞受体ACE2的活性位点与Ala99、Phe399、Asn397、Asp382、Arg393和Gln102等相互作用,并产生结合能(-9.4 kcal/mol),人参皂苷Rh2在Mpro的活性位点与Phe304、Thr304、Phe294、Arg298、Thr111和Gln110产生了结合能(-9 kcal/mol)。从对接模式来看,人参皂苷Rc与ACE2结合较好,人参皂苷Rh2则与Mpro结合较好,这些位点活性未见相关报道。可以推测人参皂苷Rc可能用作限制病毒附着于宿主细胞的治疗和/或预防剂,人参皂苷Rh2则可以用于ACE2介导的SARS-CoV-2抑制进行深层次的研究。
以往研究表明,人参皂苷Rh1不但可以恢复辅助性T细胞的数量和功能,改善机体免疫防御能力[21],也具有消除氧自由基、抗氧化损伤、增加NO含量、抑制中性粒细胞黏附、抑制 Na+内流的作用,起到了保护脏器正常生理功能,对急性肺损伤和急性肾损伤有防治作用[22]。SARS-CoV-2感染后,炎症细胞吞噬活动频繁,耗氧量增加,产生大量的氧自由基,活性氧(ROS)过多造成氧化应激及组织损伤,再灌注后的复氧过程对缺氧阶段损伤具有加重效应,累及多脏器[22]。本研究结果显示,人参皂苷Rb1通过醛固酮调节的钠重吸收通路,作用于靶点ATP1A1,若可以抑制Na+内流,从而不激活Na+/Ca2 +互换系统,则可以减少细胞质中Ca2 +的堆积,减少细胞损伤[23]。通过分析中药—成分—靶点—通路网络图,参附注射液中人参皂苷Rg1等红参活性成分可作用于CASP3、BCL2、BCL2L1等凋亡相关靶点基因,若能下调促凋亡蛋白CASP3表达、上调抗凋亡蛋白BCL2表达,则能减少细胞的凋亡。即使再缺氧复氧后,肾小管上皮细胞的单核细胞趋化蛋白-1(MCP-1)也呈高表达状态,单核巨噬细胞会聚集、黏附和浸润,人参皂苷Rb1、Rg1可抑制MCP-1的表达,进而减轻炎症反应[24]。
综上所述,本研究通过网络药理学探究参附注射液治疗COVID-19合并AKI的作用机制,并借助分子对接技术进行验证,揭示了参附注射液减轻炎症反应,对抗细胞因子风暴,预防脏器纤维化,改善氧化应激,减少细胞凋亡的治疗机制。人参皂苷Rc、人参皂苷Rh2、人参皂苷Rg3_qt、人参皂苷Rg3可能是参附注射液发挥治疗COVID-19合并AKI的物质基础。但网络药理学尚有局限性,目前COVID-19并发AKI的致病机制尚不完全明确,仍需后续动物实验和临床治疗加以验证。
