EGCG联合顺铂抑制骨肉瘤MG-63细胞增殖、侵袭及迁移作用的实验研究
2020-02-02邹日昌宋嘉琪殷嫦嫦
黄 磊,邹日昌,宋嘉琪,罗 超,殷嫦嫦
1南昌大学 研究生院医学部;2南昌大学第二附属医院骨科,南昌 330006;3抚州市立医院骨科,抚州 344000;4九江学院基础医学院,九江 332000
骨肉瘤(osteosarcoma,OS)是骨最常见的恶性肿瘤,好发于长骨的干骺端,常见于儿童和青少年,恶性程度高,预后差,容易发生肺转移,手术切除联合新辅助化疗、辅助化疗相结合为OS的主要治疗方式[1],在临床治疗中,多柔比星、顺铂、异环磷酰胺等是常用于治疗骨肉瘤的化疗药物。随着医疗水平的进步,新辅助化疗能够有效提高患者5年生存率,但仍有30%~40%患者出现肿瘤复发、转移,尤其是对于已出现肺转移者,往往导致呼吸衰竭,预后极差[1-2]。因此,寻找新的治疗OS的方法已经成为近几年医学领域的一大热点。
茶文化在我国有几千年的文化历史,茶中的主要活性成分为儿茶素,包括没食子酸儿茶素(gallocatechin,GC)、表没食子酸儿茶素(epigallocatechin,ECG)、表没食子酸儿茶素没食子酸磷脂(epigallocatechin gallate,EGCG)及表儿茶素(EC)等[3]。EGCG是一类既亲水又亲脂的两性分子,能够在体液中充分溶解,轻松穿过细胞膜与细胞内靶点相结合[3]。大量研究表明EGCG含有多种活性基因,具有抗肿瘤、抗氧化、抗炎等作用,这些基团可以与转录生长因子、蛋白激酶、细胞因子和酶等多种分子靶点结合而相互作用,导致癌细胞的凋亡。因此EGCG是一类理想的潜在抗癌药物。已有研究报道EGCG能够抑制宫颈癌细胞、肝癌细胞及胰腺癌细胞的增殖,在预防肝胆肿瘤发生发展过程中发挥重要作用[4-6]。顺铂(cisplatin,CDDP)为骨肉瘤临床治疗中常用的化疗药物,在近年来的临床治疗中,多应用以CDDP为核心的联合化疗方案治疗骨肉瘤患者,且联合用药能够很好的提高疗效、降低耐药性。但是CDDP的副作用较大,最主要的就是肾毒性[7],往往造成急性肾损伤,并呈剂量、时间相关性,这也在一定程度上限制了其在临床上的应用。大量抗氧化复合物如番茄红素[8]、银杏果提取物[9]、迷迭香[10]等均能减轻CDDP的肾毒性,EGCG是一类抗氧化酶,具有较强的抗氧化、抗肿瘤、抗炎等作用,在医药及保健食品领域具有广阔的应用前景,已有研究报导EGCG能够通过提高细胞的抗氧化能力达到减少CDDP对细胞的损伤[11]。本研究将ECGC联合CDDP作用于人骨肉瘤MG-63细胞,探讨其抑制骨肉瘤生长的作用机制,为临床寻找高效、低毒的新型抗癌化疗方案提供新的策略。
1 材料与方法
1.1 材料与试剂
人骨肉瘤MG-63细胞株为本实验室冻存,EGCG(美国Sigma公司,纯度≥98%),顺铂(美国Sigma公司),胰蛋白酶-EDTA消化液(北京Solarbio公司)、DMEM高糖培养基(美国Hyclone公司)、胎牛血清(美国Gibco公司);兔抗人Bax、Bcl-2、Bcl-xL、MMP-2、MMP-9、Caspase-3、cleaved Caspase-3抗体(美国Proteintech 公司);CCK-8试剂盒(上海经科化学科技有限公司);Transwell(美国Millipore公司);25 cm2塑料培养瓶、6孔板、96孔培养板(美国Corning公司);AnnexinⅤ-PE/7AAD细胞凋亡检测试剂盒 (BD公司);BCA蛋白定量分析试剂盒(北京Solarbio公司);PVDF膜(美国Millipore公司);封闭奶粉(蒙牛公司);倒置相差显微镜(日本Nikon公司);酶标仪、电泳槽(美国BIO-RAD公司);凝胶成像分析系统(美国BIO-RAD公司);CO2恒温培养箱(Eppendorf公司)。
2 方法
2.1 器材准备
本实验所需要使用的器械及其他材料均经过高压蒸汽锅高温(126 °C)灭菌30 min以上,再放入烘箱中干燥,备用。
2.2 细胞培养、分组及细胞形态观察
将骨肉瘤MG-63细胞培养于含10%胎牛血清的DMEM高糖培养基的7 mL培养瓶中。置于37 ℃、5%CO2的恒温培养箱培养,细胞均匀贴壁生长,隔天换液,换液时使用PBS清洗,当细胞达75%~85%汇合率时,用0.25%胰蛋白酶消化并传代。分别用倒置显微镜观察各组细胞贴壁生长状况及形态变化。EGCG联合CDDP实验分为空白对照组、EGCG组(60 μmol/L)、CDDP组(60 μmol/L)、联合用药组(EGCG 60 μmol/L+CDDP 60 μmol/L)。
2.3 CCK-8法检测不同药物对MG-63细胞活力的影响
调整MG-63细胞至1×104个/孔接种于96孔培养板,DMEM培养基至每孔100 μL,设置浓度梯度,EGCG组:0(对照组)、20、40、60、80、100 μmol/L;CDDP组:0(对照组)、20、40、60、80、100 μmol/L,每组细胞接种5个复孔,待细胞生长贴壁后加入不同浓度EGCG及CDDP,常规培养72 h后每孔加入CCK-8试剂100 μL,孵育2 h后酶标仪测定其450 nm处吸光度值(A),取对照组抑制率为0%。后收集各组培养基,加入乳酸脱氢酶(LDH)试剂盒中的NAD+/INT/diaphorase配置成的混合液,室温下孵育30 min,最后用酶标仪检测96孔板中490 nm波长处的吸光度,吸光度值表示LDH水平,以培养基中LDH水平反映细胞坏死情况。
2.4 Transwell侵袭试验
将Transwell小室放入24孔板中,在小室的上室中加入50 μL Martrigel基质胶(Martrigel胶与无血清无双抗培养基1∶8稀释),置于37 ℃培养箱中,风干5 h,待Martrigel基质胶凝固后弃去上层培养液,收集MG-63细胞,调整细胞密度至1×105个/mL,接种于Transwell小室的上室中,加入EGCG组、CDDP组、联合用药组(EGCG+CDDP)培养液(分组同“2.1”),以DMSO为对照,下室加入500 μL含20% FBS培养基,置于37 ℃、5%CO2培养箱中孵育24 h后取出小室,用棉签试去小室膜内层细胞,置于4%多聚甲醛固定15 min,风干后置于结晶紫中染色20 min,超纯水洗涤,干燥后将小室倒置于显微镜下,随机选取5个视野观察并计数侵袭至小室下层的细胞,计算平均值。
2.5 细胞划痕试验
胰蛋白酶消化MG-63细胞后接种于6孔板中,待细胞生长密度达80%左右时用100 μL枪头在孔中划一条直线,PBS漂洗后,加入不含血清的DMEM培养基与EGCG组、CDDP组、联合用药组(EGCG+CDDP)培养液(分组同“2.1”),每组重复3次,分别培养24、48 h后拍照。
2.6 流式细胞术检测EGCG联合CDDP对MG-63细胞凋亡的影响
分别收集对照组、EGCG组、CDPP组和联合用药组MG-63细胞后转入5 mL离心管中,1 000 ×g 4 ℃离心10 min,收集细胞,弃上清。用预冷PBS液洗细胞2次,弃上清,收集细胞沉淀,将细胞重悬于500 μL结合缓冲液中。加入5 μL Annexin V-PE混匀后加入5 μL 7-ADD,混匀后于室温避光孵育15 min。1 h内在流式细胞仪(FACS)检测各组细胞凋亡情况。
2.7 Western blot检测相关蛋白表达水平
同“2.1”方法分组培养48 h后,PBS漂洗后分别提取各组细胞总蛋白,使用BCA法测定各组蛋白浓度,进行SDS-PAGE凝胶电泳分离蛋白,之后将胶内蛋白质电转至PVDF膜上,将PVDF膜用5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,洗膜后再用相应二抗孵育2 h,适当漂洗,化学发光后放入化学发光成像系统观察条带,分析结果。目的蛋白包括Bax、Bcl-2、Bcl-xL、MMP-2、MMP-9、Caspase-3、及cleaved Caspase-3。
2.8 统计学处理
实验数据均采用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,并通过Scheffe检验进行两两比较,P<0.05为差异有统计学意义。
3 结果
3.1 形态学观察
显微镜下见空白对照组MG-63细胞贴壁良好,细胞形态大小不一,分布均匀,多呈梭形,胞核清晰,胞质均匀透亮;EGCG组可见部分细胞脱落降解,贴壁细胞数减少,部分脱落细胞形态由梭形变圆,变小,细胞间距增大,且随着药物浓度梯度增加细胞死亡数量越多;CDDP组可见较多细胞脱落,贴壁细胞密度减低,也随药物浓度梯度的增加细胞死亡数也增加;联合用药组可见大量细胞坏死脱落,细胞数量急剧减少,培养液中可见较多悬浮死细胞,随着时间的延长也愈加明显(图1)。
3.2 不同浓度EGCG及CDDP均能抑制MG-63细胞增殖
如图2所示,CCK-8结果显示与对照组相比,不同浓度的EGCG及CDDP均能不同程度抑制骨肉瘤MG-63细胞增殖(P<0.05),造成细胞活力下降,且随着药物浓度的增加,对细胞的抑制作用愈加明显(P<0.05)。各组分别取100 μL细胞上清于酶标板中检测LDH释放率,各组LDH释放量如下:对照组LDH释放量约为0.86±0.17 μU/mL,EGCG组、CDDP组释放量分别为1.63±0.21 μU/mL与2.18±0.37 μU/mL,而联合用药组中约为5.61±0.53 μU/mL,表明单药组中LDH释放量水平均高于空白对照组,而联合用药组中LDH释放量最高(P均<0.05),EGCG组及CDDP组两组之间差异无统计学意义。在EGCG、CDDP浓度超过60 μmol/L后抑制率曲线进入平台期,表明这也是药物效果最佳浓度。
3.3 EGCG联合CDDP对 MG-63细胞增殖抑制作用更为显著
分别使用EGCG、CDDP单药及EGCG+CDDP联合用药作用于MG-63细胞(分组同“2.1”),结果如图3示,与对照组、ECGC组及CDDP组相比,联合用药组在不同时间(24、48、72 h)对MG-63细胞抑制作用更为显著,表明加入EGCG联合用药后能够增强CDDP对骨肉瘤MG-63细胞增殖抑制作用,且随着作用时间的延长抑制作用也更强(P<0.05)。
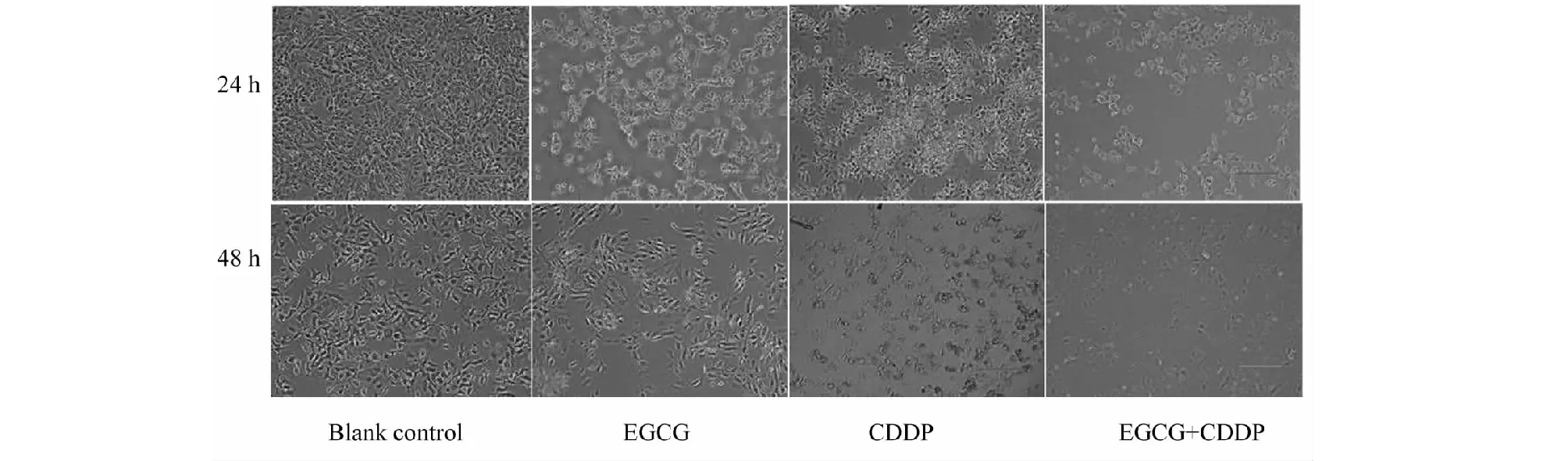
图1 不同时间EGCG组、CDDP组、联合用药组细胞生长情况(×100)Fig.1 Cell growth in EGCG group,CDDP group and combination group at different time (×100)
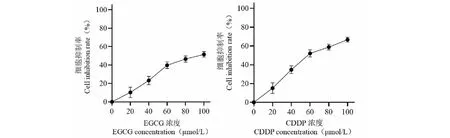
图2 EGCG与CDDP对MG-63细胞抑制率(n=3)Fig.2 Inhibition rate of EGCG and CDDP on MG-63 cells (n=3)
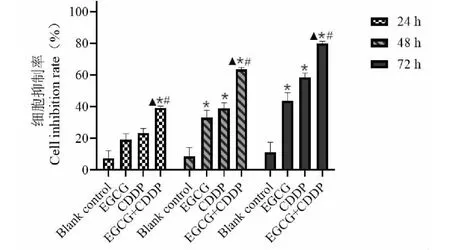
图3 不同时间EGCG组、CDDP组及EGCG 联合CDDP组对MG-63细胞抑制率(n=3)Fig.3 Inhibition rate of MG-63 cells in EGCG group, CDDP group and combination group at different time(n=3)注:与对照组相比,*P<0.05;与EGCG组相比,#P<0.05;与CDDP组相比,▲P<0.05;下同。Note:Compared with the control group,*P<0.05;Compared with the EGCG group,#P<0.05;Compared with the CDDP group,▲P<0.05;the following is the same.
3.4 EGCG联合CDDP抑制骨肉瘤MG-63细胞的侵袭能力
用不同浓度EGCG、CDDP及联合用药组处理MG-63细胞,采用Transwell小室法检测对MG-63细胞的侵袭能力,结果如图4所示,对照组及DMSO组穿透小室膜的细胞数分别为296.74±56.61个和275.26±31.12个,EGCG组穿过小室膜的细胞数为176.23±16.76个,CDDP组穿过小室膜的细胞数为121.26±10.15个,联合组穿个小室膜的细胞数为42.69±9.96个,与对照组相比,EGCG组及CDDP组穿过小室膜细胞数均减少,MG-63细胞侵袭能力减弱;联合用药组穿过小室膜细胞数减少更为显著,作用更明显,表明联合用药对MG-63细胞的侵袭能力抑制作用最强,加入EGCG后能够增强CDDP对骨肉瘤MG-63的抑制作用,差异具有统计学意义(P<0.05)。
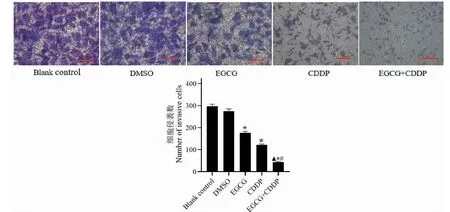
图4 Transwell小室法检测EGCG、CDDP及联合用药对MG-63细胞侵袭能力的影响Fig.4 Using Transwell chamber assay to detect the effects of EGCG,CDDP and their combination on the invasive ability of MG-63 cells
3.5 EGCG联合CDDP对骨肉瘤MG-63细胞迁移能力影响
细胞划痕实验检测各组药物对MG-63细胞迁移能力影响,结果如图5所示,相比于对照组,EGCG组及CDDP组MG-63细胞迁移能力均下降,EGCG单药组细胞划痕划痕面积愈合率为53.25%±6.21%,CDDP单药组细胞划痕面积愈合率为43.27%±5.76%,并伴随少量细胞的脱落坏死,细胞向中线增殖减慢;而EGCG+CDDP联合用药组细胞迁移能力明显减弱,细胞划痕愈合率为22.69%±3.88%,几乎未见细胞向中线增长,表明EGCG联合CDDP能更有效的抑制骨肉瘤MG-63细胞增殖,联合用药能够增强骨肉瘤MG-63细胞对CDDP的敏感性(P<0.05)。
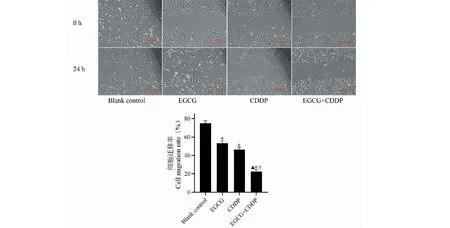
图5 EGCG、CDDP及联合用药对骨肉瘤MG-63细胞迁徙的抑制作用Fig.5 Inhibitory effect of EGCG,CDDP and their combination on the migration of osteosarcoma MG-63 cells
3.6 EGCG联合CDDP对骨肉瘤MG-63细胞凋亡的影响
流式细胞仪检测发现如图6所示,与对照组相比,EGCG组、CDDP组凋亡率增加,分别为 10.336%±0.028%、19.681%±3.755%,差异具有统计学意义(P<0.05);而EGCG+CDDP联合用药组凋亡率更高,凋亡率为48.279%±7.608%,与EGCG组及CDDP组比较差异具有统计学意义(P<0.05),提示两药联合应用能够显著诱导骨肉瘤MG-63细胞凋亡。
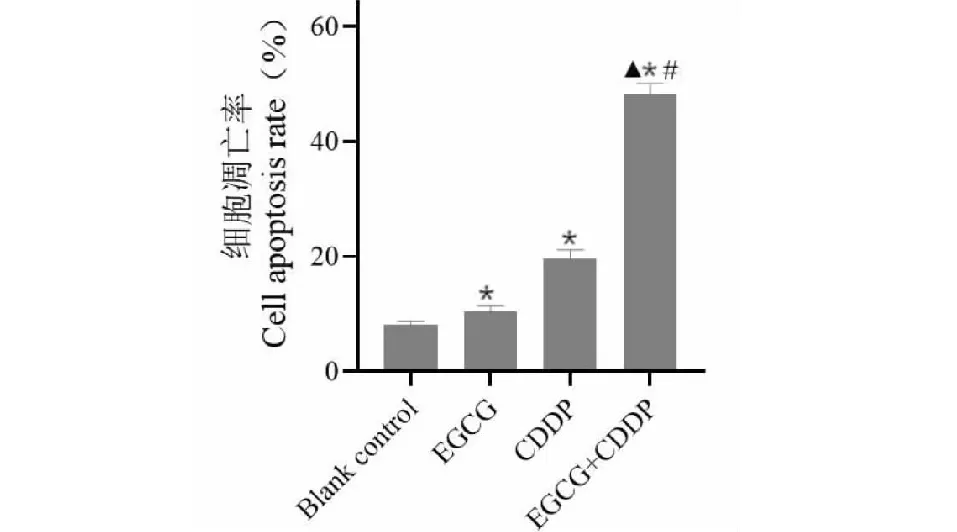
图6 EGCG联合CDDP对骨肉瘤MG-63细胞凋亡的影响Fig.6 Effects of EGCG combined with CDDP on apoptosis of osteosarcoma MG-63 cells
3.7 Western blot检测MG-63细胞相关蛋白表达情况
Western blot结果及灰度分析结果如图7所示:显影后的条带越黑越粗说明蛋白表达量越高,与对照组相比,分别单药应用EGCG、CDDP及将二者联合用药后,细胞中MMP-2、MMP-9、Bcl-2与Bcl-xL表达水平下调,同时Bax、Caspase-3以及cleaved Caspase-3蛋白水平上调,其中以联合用药组作用效果更明显,表明EGCG+CDDP对骨肉瘤MG-63细胞抑制作用效果最强,差异均具有统计学意义(P<0.05)。
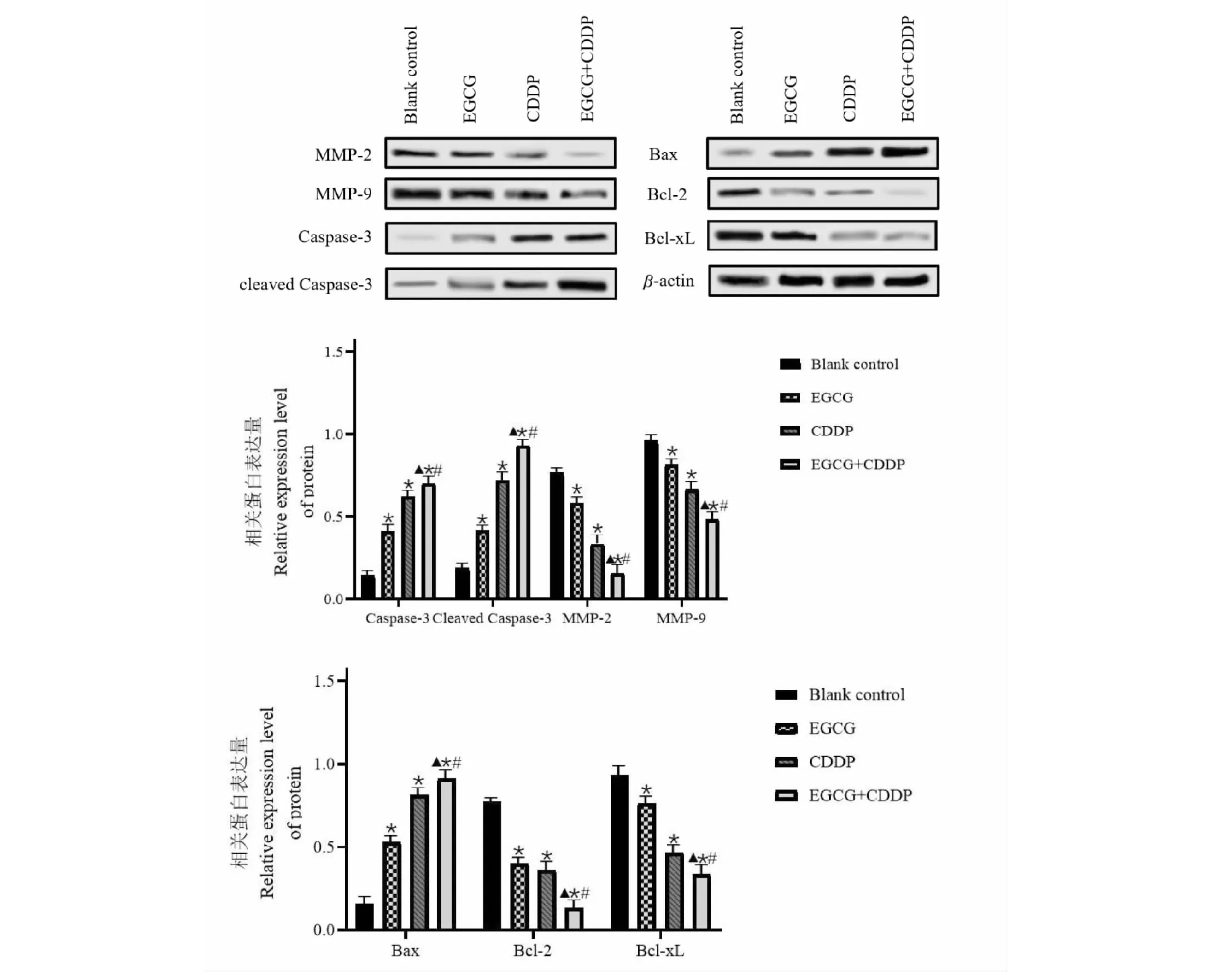
图7 EGCG组、CDDP组及联合用药组对MG-63细胞相关蛋白表达的影响Fig.7 Effects of EGCG group,CDDP group and combination group on the expression of related proteins in MG-63 cells
4 讨论与结论
骨肉瘤是最常见的原发性骨恶性肿瘤,好发于儿童与青少年[12],尽管有手术、新辅助化疗及手术联合辅助化疗的治疗方法,骨肉瘤患者的致死率仍较高,尤其对于肺转移者治疗效果极差,顺铂为临床中治疗骨肉瘤较为常用的化疗药物,但是近年来越来越多的患者对顺铂产生耐药性,寻找新的对抗骨肉瘤药物及联合顺铂增强其化疗敏感性的方案有极为重要的意义,因此以顺铂为核心的联合用药也成为了骨肉瘤治疗领域中的一大研究热点。
顺铂(CDDP)属铂类化疗药物中的一种,具有较强的广谱抗癌作用,其主要机制是通过抑制恶性肿瘤细胞中的DNA复制而发挥细胞毒性及抗肿瘤的作用[8],临床上CDDP可用于治疗多种恶性肿瘤如甲状腺癌、肺癌、食道癌、骨肉瘤等,具有较好的化疗效果,但是也存在不可避免的弊端如CDDP产生的肾毒性、耳毒性及耐药性,这也限制了CDDP的临床应用,而肾毒性也是其最主要的副作用[7,13],因此为顺铂寻找合适的辅药联合作用以减少CDDP药物毒性及提高整体化疗敏感性成为一大热点,目前临床中也多应用以CDDP为核心的联合化疗方案,尽可能的在增强CDDP抗肿瘤作用的基础性减少药物对组织的损伤。儿茶素是茶中主要的活性物质,其中表没食子酸儿茶素没食子酸酯(EGCG)在绿茶中活性最高,具有多种生物特性如抗氧化、抗肿瘤及抗炎性反应[14]。已有研究报道EGCG能够延缓CDDP造成的肾脏肾小球滤过率下降,缓解所致HEK293细胞的氧化损伤,在CDDP诱导的细胞损伤模型中,随着EGCG浓度的增加,HEK293细胞的存活率也逐渐增加,表明EGCG能够在一定程度上对抗CDDP的药物毒性[11]。CDDP对肾脏的损伤与氧化应激密切相关,而EGCG具有较强的抗氧化性,能够对抗氧化应激反应。有研究证实EGCG能够改善抗肾小球基底膜性肾小球肾炎,延缓CDDP造成的肾脏肾小球滤过率下降,对肾脏具有保护作用[15,6]。在肿瘤领域中,EGCG表现出广泛的抗癌作用,已有研究发现EGCG能够通过激活JNK信号通路诱导胃癌细胞凋亡[17],通过下调p65的转录水平抑制膀胱癌的转移[18]、上调miRNA-1抑制骨肉瘤细胞生长[19],抑制宫颈癌[4]、肝癌[5]、胰腺癌[6]细胞增殖的作用,这些都为EGCG发挥保护肾功能与抗癌作用提供了充足的理论依据。在本研究中,CCK-8实验结果及显微镜下观察也表明EGCG具有抑制骨肉瘤MG-63细胞增殖的作用,且EGCG联合CDDP能够发挥更强的抑制效果,表明二者联合作用能够更有效抑制OS的进展。
通过进一步实验我们发现,EGCG联合CDDP对骨肉瘤细胞的抑制作用明显优于单药,在显微镜下观察各组药物处理的细胞可见,联合用药组的骨肉瘤MG-63细胞大量坏死,漂浮细胞明显增多,对细胞增殖的抑制作用明显强于单药组,表明EGCG联合CDDP对MG-63细胞具显著抑制作用。CCK-8实验也证实,单独应用EGCG能够抑制骨肉瘤MG-63细胞生长,且随着药物浓度增加及作用时间的延长,细胞增殖抑制更明显,说明EGCG及CDDP对骨肉瘤MG-63细胞均有抑制作用,且具有剂量、时间依赖性,而在将EGCG与CDDP联合应用后结果发现其对MG-63细胞的抑制作用显著强于单药组;Transwell侵袭实验结果表明,与对照组及DMSO处理组对比,EGCG、CDDP单药应用组细胞侵袭能力均降低,穿过小室膜的细胞数也减少,而联合用药组的MG-63细胞侵袭能力最低,穿过小室膜的细胞数也最少;细胞划痕实验结果表明,EGCG及CDDP单药组细胞的迁移能力减弱,划痕区域细胞数目增长减慢,而将EGCG与CDDP联合用药组细胞迁移能力大幅减弱,划痕区几乎没有明显细胞增长,同时细胞坏死数目也增多;Bcl家族是重要的凋亡相关基因,其中Bcl-2、Bcl-xL是其阻止细胞凋亡的相关基因,而Bax是促进细胞凋亡的相关基因,Bcl家族在胃肠道肿瘤、泌尿系肿瘤、骨肉瘤等恶性肿瘤中发生发展具有密切关联[20]。通过western blot分析结果发现,EGCG、CDDP单药组作用后,抗凋亡蛋白Bcl-xL与Bcl-2水平均下调,而促凋亡蛋白Bax水平明显上调,这一结果在EGCG+CDDP联合用药组更为显著,提示EGCG能够促进骨肉瘤MG-63细胞凋亡,与CDDP联合作用后效果更为明显。Caspase家族是一组半胱氨酸蛋白酶,在介导细胞凋亡过程中起到重要作用,其中以Caspase-3最为关键,其激活是细胞凋亡的特异性标志[21]。细胞凋亡有多种途径,但绝大多数途径末端都是通过Caspase的级联激活,最终激活为Caspase-3,形成具有活性的cleaved Caspase-3片段,进而产生一系列级联反应[22]。本研究结果表明在分别单药应用骨肉瘤MG-63细胞后,Caspase-3及cleaved Caspase-3表达水平均增高,而联合用药组升高最为明显,提示EGCG也许能够通过上调Caspase家族基因表达促进MG-63细胞发生凋亡,从而发挥抗骨肉瘤细胞的作用,流式细胞仪检测结果也提示EGCG能够诱导骨肉瘤MG-63细胞发生凋亡,且EGCG+CDDP联合用药效果更为显著。基质金属蛋白酶(MMPs)是一类蛋白水解酶,可通过破坏基质降解平衡而促进癌细胞突破基底膜和细胞外基质构成的组织学屏障,侵犯周围及远处组织,其中最具有代表性的便是MMP-2及MMP-9两个家族基因,基质金属蛋白酶的表达水平越高,肿瘤的侵袭能力也越强[23]。本实验结果表明,药物作用骨肉瘤细胞后MMP-2及MMP-9表达水平均下调,且EGCG+CDDP联合组下降最为明显,表明EGCG联合CDDP作用能够发挥更为有效的抗骨肉瘤增殖的作用。以上结果均证实EGCG联合CDDP能够发挥更为显著的抑制骨肉瘤的增殖作用。
综上,本研究表明EGCG能够在体外抑制骨肉瘤MG-63细胞的增殖,联合CDDP用药后较EGCG及CDDP单药应用效果更强,由于EGCG对细胞具有一定的抗氧化性,能够保护肾功能,减少CDDP的肾毒性,联合用药还能够在发挥疗效的基础上减少CDDP对组织造成的损伤,是一类理想的化疗药物辅药,这也为骨肉瘤的临床治疗提供了新的理论依据与有价值的实验基础。然而本实验仅探讨了在体外对骨肉瘤MG-63细胞的影响,这也需继续完善相关实验以及进一步在体内实验中深入探究。
