靶向沉默甲基转移酶3对前列腺癌细胞增殖、侵袭和克隆能力的影响
2020-01-17李显永赵晖顾鹏崔庆鹏李同海陈印官润云
李显永 赵晖 顾鹏 崔庆鹏 李同海 陈印 官润云
昆明医科大学第一附属医院泌尿外科(昆明650032)
前列腺癌(prostate cancer,PCa)已成为美国男性发病率第一的恶性肿瘤,美国癌症协会指出2019年美国PCa 发病率将占到男性新发肿瘤的20%,其病死率达10%[1]。近年来,我国PCa 的发病率和病死率均呈持续上升的趋势,严重威胁男性健康[2]。因此,继续深入研究PCa 的病因、进展因素以及寻找新型的治疗靶点显得尤为重要。N6-甲基腺苷(m6A)是真核细胞mRNA 最常见的一种化学修饰,约为真核细胞RNA 甲基化修饰的80%[3]。研究发现m6A 是一种动态可逆的修饰方式,其相关蛋白包括甲基转移酶复合体(METTL3、METTL14、WTAP),去甲基酶(ALKBH5、FTO),相应的阅读蛋白(YTHDC、YTHDF)等[4]。在白血病、肝癌、肺癌等肿瘤的研究中发现,METTL3 作为经典的甲基转移酶可以催化mRNA m6A 修饰形成,影响靶标mRNA 的m6A 修饰水平,参与了肿瘤的发生及进展[5-7]。肺癌中的研究还发现METTL3 也可以不依赖m6A 途径,独立催化相关肿瘤蛋白的翻译,而影响肿瘤细胞的生物学行为[7]。笔者的前期研究发现METTL3 基因在前列腺癌组织中呈高表达,且与前列腺癌的发生、发展及分化相关[8]。本实验拟通过RNA 干扰技术,靶向沉默前列腺癌细胞中的METTL3 基因,继续探讨其对前列腺癌细胞生物学行为的影响,旨在为PCa 的诊治提供新的理论证据。
1 材料与方法
1.1 材料 前列腺癌DU145、PC-3 细胞均从中国科学院昆明动物研究所细胞库购买。F12 培养基、FBS、Trypsin-EDTA Solution(美国Gibco 公司),实时荧光定量试剂、RIPA 裂解液(上海Sangon 公司),兔抗人METTL3 单克隆抗体(英国Abcam 公司),鼠抗GAPDH 单克隆抗体(美国Sigma 公司),脂质体LipofectamineTM2000 试剂(美国Invitrogen 公司),PVDF 转移膜(美国Millipore 公司),CCK8-试剂盒(日本同仁化学),Transwell 小室(美国Corning公司),Matrigel(美国BD 公司)。
1.2 方法
1.2.1 细胞培养 DU145、PC-3 细胞使用F12 培养基(包含10%胎牛血清、链霉素100 μg/mL、青霉素100 μg/mL),置于37 ℃,5%CO2饱和湿度培养箱中常规培养,每3~4 天传代1 次。
1.2.2 METTL3 siRNA 基因序列及其引物的设计和合成 由生工生物工程公司针对METTL3 基因设计并合成3 对siRNA(METTL3-1126、METTL3-1400、METTL3-1604)和1 对阴性对照序列(NC),基因序列见表1。METTL3 siRNA 引物序列,上游5′-CCCTATGGGACCCTGACA-3′;下 游:5′-TCCGAATGATGCGTTGC-3′。以GAPDH作为内参物,上游:5′-AAAATCAAGTGGGGCGATGC-3′;下游:5′-GATGACCCTTTTGGCTCCCC-3′。

表1 METTL3 siRNA 序列Tab.1 Sequence of METTL3 siRNA
1.2.3 细胞分组和转染 将DU145、PC-3 细胞随机分组设置为无任何特殊处理的空白对照组(B组)、仅加转染试剂的Mock 组(M 组),转染阴性siRNA 干扰片段的阴性对照组(NC 组)、转染METTL3 siRNA 干扰片段的干扰组(METTL3-1604 组、METTL3-1400 组、METTL3-1604 组)。待DU145、PC-3 细胞融合至80%~90%时,去培养液,用PBS洗涤细胞2 次;加1 mL 胰酶混匀,后放置37 ℃、5%CO2饱和湿度培养箱中1 min;后加2 mL F12 培养液,吹打细胞使形成单细胞悬液;采用血球计数板计数后,细胞按2 × 105/孔的浓度接种至6孔板并混匀,后置于37 ℃,5%CO2培养24 h。据LipofectamineTM2000 转染试剂盒说明书行Mock组、阴性对照组、干扰组的DU145、PC-3 细胞转染,同时设立空白对照组。48 h 后收取细胞,提取各样本的mRNA 和蛋白进行检测。
1.2.4 实时荧光定量聚合酶链反应 各组细胞样本分别按照Trizol 试剂盒说明书提取总RNA。逆转录程序为42 ℃30 min;85 ℃10 min;定量PCR 反应程序为95 ℃3 min;95 ℃12 s;62 ℃40 s;共40 个循环。结果以GAPDH 的Ct 值作内参,使用2-ΔΔCt法进行样本分析。
1.2.5 Western 印迹 向各组细胞样本中加入裂解液提取细胞总蛋白,进行SDS-PAGE 电泳,后行PVDF 转膜,转膜后用5%脱脂牛奶室温封闭1 h。加入稀释后的一抗(METTL3,1∶1 000;GAPDH,1∶10 000),4 ℃温育条件下过夜;使用1×TBST 洗涤5次,10 min/次;加入稀释后的二抗,室温温育2 h,使用1×TBST 洗涤5 次,10 min/次。最后用Super-Signal West Pico Chemiluminent Substrates 发光液、FR-1800 全功能发光及荧光生物图像分析系统进行检测,结果使用Gel-Pro Analyzer 软件分析。
1.2.6 CCK-8增殖实验 DU145、PC-3细胞融合至80%~90%时,使用血球计数板计数,以3 × 103/孔的浓度接种至96 孔板。同时设置调零组,每组设5个重复,培养箱中培养24 h。每孔避光加入CCK-8 5 μL,培养2 h,后酶标仪450 nm 波长测光密度值(OD值),标记为0 h。转染后各组细胞样本分别于24、48、72 h 后避光加入CCK-8,避光培养2 h,后酶标仪450 nm 波长测OD值,并绘制不同分组细胞生长曲线。
1.2.7 Transwell 侵袭实验 以含0.5% FBS 的F12培养液按1∶6 稀释50 mg/L Matrigel,包被Transwell小室底部膜的上室面,置37 ℃、5%CO2培养箱孵育4 h,弃上清。将转染48 h后各组细胞样本以1×103/孔的浓度转移至transwell 小室,下室为20%血清浓度的F12 培养基,培养48 h。取出小室,加入预冷甲醇,于-20 ℃固定10 min。后用棉签刮去小室上表面Matrigel 胶,倒置风干。将小室置入新的24-well 中,以0.1%结晶紫染色30 min,清洗晾干后,于倒置显微镜下随机取视野拍照并计数。
1.2.8 平板克隆形成实验 各组细胞转染48 h后,按300 细胞/孔的浓度接种至6 孔板,轻轻晃动,使细胞均匀散开,37 ℃,5%CO2培养箱中培养至完全贴壁。每2 ~3 天观察细胞生长状况,第15 天出现肉眼可见的克隆,培养终止。弃上清,PBS洗涤2次,后加入4%多聚甲醛2 mL,4 ℃,固定20 min。弃固定液,PBS 洗1 次,加0.1%结晶紫1 mL,37 ℃,染色30 min。后洗去染液,风干,后肉眼计数克隆,显微镜拍照。
1.3 统计学方法 数据使用SPSS 20.0 统计软件分析。计量资料结果以均数±标准差表示。多组间均数比较采用单因素方差分析,其中两两比较采用LSD-t法。以P<0.05 为差异有统计学意义。
2 结果
2.1 实时荧光定量聚合酶链反应 细胞转染48 h后,DU145、PC-3 细胞各组METTL3 mRNA 表达量见图1、2。3 条siRNA 均能有效的降低METTL3 mRNA的表达。Mock组与空白对照组、阴性对照组比较METTL3 mRNA 表达差异无统计学意义(P<0.05),说明转染试剂对前列腺癌细胞METTL3 mRNA 表达无明显影响。DU145 中siRNA-1400 组表达量分别为两对照组的10%、9%,干扰效率分别为90%和91%,差异有统计学意义(F=618.246,P<0.01)。PC-3 细胞中siRNA-1400 组表达量分别为两对照组的28%、27%,干扰效率分别为72%和73%,差异有统计学意义(F=114.878,P<0.01)。

图1 DU145 细胞以B 为校准GAPDH 为内参METTL3 mRNA 表达水平Fig.1 B-calibrated GAPDH for internal reference METTL3 mRNA expression level in DU145 cells
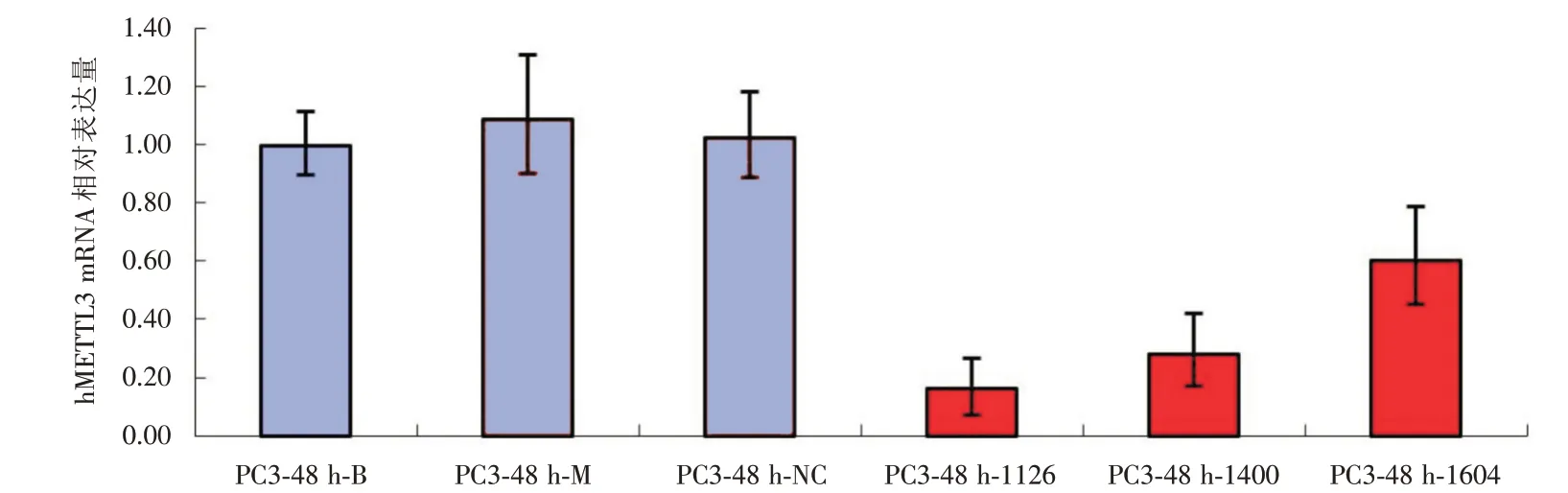
图2 PC-3 细胞以B 为校准GAPDH 为内参METTL3 mRNA 表达水平Fig.2 B-calibrated GAPDH for internal reference METTL3 mRNA expression level in PC-3 cells
2.2 Western印迹 DU145、PC-3细胞干扰组中3条siRNA 对METTL3 蛋白的表达干扰情况见图3、4。与空白对照组、阴性对照组比较,Mock 组METTL3蛋白表达差异无统计学意义(P>0.05),结合以上Mock 组METTL3 mRNA 表达情况说明转染试剂未对METTL3 基因表达产生显著影响,后续实验采用空白对照组、阴性对照组、干扰组3 组间相互比较。其中DU145、PC-3 细胞的siRNA-1400 组METTL3蛋白的表达较两对照组显著降低,FDU145= 53.607,PDU145<0.01;FPC-3=7 878.320,PPC-3<0.01。DU145中siRNA-1400 组表达量分别为两对照组的12.8%、14.3%,干扰效率分别为87.2%和85.7%。PC-3 细胞中siRNA-1400 组表达量分别为两对照组的2.2%、2.3%,干扰效率分别为97.8%和97.7%。siRNA-1400片段转染DU145、PC-3 细胞后METTL3蛋白的表达与前面mRNA 表达情况相符,具有较高的干扰效率,后续选用该片段干扰进行实验。

图3 DU145 细胞各组METTL3 蛋白表达水平Fig.3 METTL3 protein expression in DU145 cells

图4 PC-3 细胞各组METTL3 蛋白表达水平Fig.4 METTL3 protein expression in PC-3 cells
2.3 CCK-8 实验 CCK-8 增殖曲线反映了多个时间点DU145、PC-3 细胞不同组间的增殖情况,见图5。24、48、72 h DU145 细胞干扰组的OD值均显著低于两对照组(F24h= 25.099,P<0.01;F48h=8.464,P<0.01;F72h=18.705,P<0.01)。24、48、72 h PC-3 细胞干扰组的OD值同样显著低于两对照组(F24h= 15.719,P24h<0.01;F48h= 11.082,P48h<0.01;F72h= 8.937,P72h<0.01)。提示下调METTL3 基因表达后明显抑制了前列腺癌细胞的增殖能力。

图5 下调METTL3 对前列腺癌细胞增殖能力的影响Fig.5 Effect of down-regulation of METTL3 on proliferation of prostate cancer cells
2.4 Transwell 实验 DU145、PC-3 细胞转染48 h后,各组穿过Matrigel 基膜情况见图6。DU145细胞干扰组穿过基膜细胞数(7.667 ± 2.082),显著低于空白对照组(46.333±5.132)和阴性对照组(46.667± 4.726),差异具有统计学意义(F= 85.365,P<0.01)。PC-3 细胞干扰组穿过基膜细胞数(58.667± 1.528),显著低于空白对照组(80.333± 4.726)和阴性对照组(90.333 ± 4.041),差异具有统计学意义(F=57.520,P<0.01)。由此可见,下调METTL3基因显著地抑制了DU145、PC-3细胞的侵袭能力。
2.5 平板克隆形成实验 DU145、PC-3 细胞转染后继续培养15 d,克隆成形情况见图7。DU145细胞空白对照组、阴性对照组,干扰组克隆数分别为:(166.333±5.508)、(172.667±2.082)、(77.667±6.807),结果显示干扰组克隆数明显低于两对照组(F=331.461,P<0.01)。PC-3 细胞空白对照组、阴性对照组,干扰组克隆数分别为:(458.000 ±22.338)、(455.333 ± 18.610)、(403.667 ± 8.083),结果表明干扰组克隆数明显低于两对照组(F=9.271,P<0.05)。
3 讨论
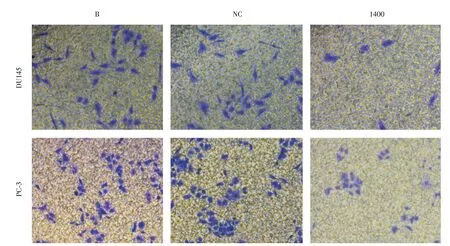
图6 下调METTL3 对前列腺癌细胞侵袭能力的影响(×400)Fig.6 Effect of down-regulation of METTL3 on invasion of prostate cancer cells(×400)

图7 下调METTL3 对前列腺癌细胞克隆形成的影响Fig.7 Effect of down-regulation of METTL3 on colony formation of prostate cancer cells
m6A 是一种发生于腺嘌呤第六位氮原子上的甲基化修饰方式。在哺乳动物中,平均每条RNA大约存在3 ~5 个m6A 的修饰位点[9]。研究表明m6A 的修饰可能参与了mRNA 的剪切、加工、出核、翻译效率、稳定性,从而与多种生物学功能有着深入的关联,涉及昼夜节律、DNA损伤修复、性别的决定、组织发育和肿瘤的发生、发展等[4,10]。最新研究[11]发现甲基转移酶复合体中只有METTL3具有催化核心,可以接受S-腺苷甲硫氨酸(SAM)为m6A 修饰提供甲基,与METTL14、WTAP 相互协作催化m6A 修饰形成,因此认为METTL3 是m6A 修饰形成的限速酶,对RNA 的m6A 修饰水平具有重要影响。学者[5-6]通过TCGA 数据集资料分析以及笔者前期的研究[8]结果均证实PCa 中METTL3 基因呈高表达,且表达水平与前列腺癌的发生、发展及分化紧密相关。
本实验通拟过RNA 干扰技术下调DU145、PC-3 细胞中的METTL3 基因表达,结果表明,转染METTL3 siRNA-1400 干扰片段48 h 后,前列腺癌DU145、PC-3细胞中的METTL3 mRNA及其蛋白表达均呈现显著地下调,说明特异性的METTL3 siRNA能够有效抑制前列腺癌细胞中内源性METTL3 的表达。进一步对转染后前列腺癌细胞生物学行为研究发现,METTL3-siRNA 干扰组前列腺癌细胞的增殖、侵袭、克隆形成能力均明显低于两对照组,说明下调METTL3 基因将抑制前列腺癌细胞的增殖、侵袭、克隆能力,METTL3 是影响前列腺癌细胞生物学行为的重要基因。
肺癌细胞中发现METTL3 在细胞核和细胞质中均有分布,研究表明METTL3 与其他甲基转移酶共同催化了肿瘤基因EGFR、TAZ、MAPKAPK2(MK2)和DNMT3A mRNA 的m6A 修饰,从而促进相关肿瘤基因的翻译,增加其蛋白表达;同时细胞质中的METTL3 不依赖其他甲基化相关酶,独立与核糖体结合而促进目的基因的翻译;进一步下调METTL3 基因表达后,明显抑制了肺癌细胞增殖、侵袭力,并增加细胞的凋亡[7]。在白血病的研究中也发现,高表达的METTL3 促进了c-MYC,BCL-2和PTEN 癌基因的表达,是维持白血病细胞增殖生长所必须的因素,敲低后癌细胞增殖能力则明显下降[12]。肺癌和白血病的研究中,METTL3 调控的肿瘤基因EGFR、c-MYC、BCL-2 也是与前列腺癌关系密切的癌基因,由此推测METTL3 可能也通过调控前列腺癌的肿瘤基因,进而影响了前列腺癌细胞的生物学行为。此外METTL3 在胶质母细胞瘤[13]、乳腺癌[14]的研究中均表现出促癌作用。METTL3 在肿瘤中通过m6A 修饰途径或者独立促进某些癌基因的表达,在肿瘤中发挥促癌基因的作用,下调METTL3 后肿瘤细胞的增殖、侵袭、克隆能力受到明显的抑制,并增加肿瘤细胞凋亡。这与本实验中下调前列腺癌细胞METTL3 基因表达,将抑制前列腺细胞生物学行为的结果一致。当然,在少数肿瘤,例如肾癌[15]和宫颈癌[16]的研究发现METTL3 基因发挥抑癌作用。
GU 等[17]发现METTL3 可能参与了由亚砷酸盐诱导的肿瘤发生,下调其表达并可逆转细胞恶性表型,可能是肿瘤治疗的一个新靶点。胶质母细胞瘤的研究还表明m6A 修饰介导了DNA 损伤的修复,敲低METTL3 后肿瘤细胞对放疗的敏感性增加[13]。另有研究[18]也发现下调METTL3 基因后,胰腺癌细胞对顺铂、5-氟尿嘧啶、吉西他滨等化疗药物以及放疗具有更高的敏感性。综上,METTL3也可能是前列腺癌治疗的一个新型靶点。
本研究证明了METTL3基因在雄激素非依赖性前列腺癌细胞系(DU145、PC-3)中的功能性以及重要性,为PCa 的治疗提供了一个新型分子靶点。本实验后续将增加前列腺癌细胞系种类,继续探讨METTL3 对前列腺癌细胞生物学行为的影响,同时检测相关肿瘤蛋白的表达情况,并探讨其机制。
