Sirt5调控STAT3/Nanog信号通路抑制肝癌细胞的增殖和迁移
2020-01-17肖金成康鑫鑫朱文良白淇文李靖
肖金成 康鑫鑫 朱文良 白淇文 李靖
1郑州大学附属肿瘤医院微创介入科(郑州450003);2郑州大学第一附属医院麻醉科(郑州450052);3广西中医药大学附属瑞康医院肿瘤内科二病区(南宁530011)
肝癌是我国发病率较高的恶性肿瘤之一,肝细胞肝癌(hepatocellular carcinoma,HCC)为其主要类型[1]。尽管手术切除、肝脏移植、栓塞、消融、放射治疗和化疗已被应用肝癌治疗,手术复发率高和5年生存率低等问题仍旧困扰着临床医生[2-3]。因此,寻找新的生物标志物或治疗靶点以改善肝癌的诊断和结局至关重要。
组蛋白的乙酰化/去乙酰化修饰在基因表达调控中起重要作用。沉默信息调节因子2(silence information regulator2,Sir2)蛋白及Sir2 相关酶类(Sir2-related enzymes,Sirtuin)是一类依赖于NAD+、核心区域高度保守的组蛋白去乙酰化酶(参与蛋白乙酰化修饰)。哺乳动物的Sirtuin 家族有7 个成员:Sirt1~Sirt7。其中,Sirt5 定位于线粒体基质。研究[4]表明,Sirt5 缺乏会减少线粒体ATP 产生,并激活小鼠心脏中AMP 激活的蛋白激酶。在人肺癌细胞中,Sirt5 能够将糖酵解过程的限速酶丙酮酸激酶2(pyruvate kinase M2,PKM2)去琥珀酰化,抑制Sirt5 表达可抑制肺癌细胞增殖[5]。Sirt5 失活还会导致线粒体丝氨酸羟甲基转移酶2 去琥珀酰化,抑制丝氨酸分解代谢,进而抑制肿瘤生长[6]。这些发现提示Sirt5 在肿瘤发生和发展中发挥着重要作用。另一方面,研究表明肝部特异敲除Sirt6 会导致糖酵解和甘油三酯合成,从而导致脂肪肝形成[7]。Sirt3 低表达与肝癌预后差有关[8]。而Sirt5是否参与肝癌的进程及其可能的机制还有待进一步研究。本研究通过研究Sirt5 处理肝癌细胞后STAT3/Nanog 通路变化情况,揭示了Sirt5 对肝癌细胞增殖和迁移的影响及其机制。
1 材料与方法
1.1 细胞培养 人肝癌细胞系HepG2、Huh7 及HepG3 培养于DMEM 培养基(含有10%胎牛血清、青霉素50 IU/mL、链霉素100 μg/mL),培养条件为37 ℃,5%CO2。1~2 d换液1次,细胞汇合度达90%后0.25%胰酶消化传代。
1.2 细胞转染及分组 将细胞分为4 组:Blank 组(正常培养的细胞),AAV 组(空载体病毒组),AAV-Sirt5 组(AAV-Sirt5 病毒组),Sirt5+Colivelin 组(AAV-Sirt5 病毒+0.5 μmol/L STAT3 激活剂Colivelin,美国Santa cruz 公司)。取对数生长期的肝癌细胞,以2 × 105个细胞/孔接种于6 孔培养板。待细胞融合至80%,换液并继续培养6 h,将病毒原液按照感染复数(MOI)=20 加入培养液中,摇匀。24 h 后,去除病毒工作液并换液。继续培养48 h,提取细胞蛋白,检测Sirt5 的表达情况。
1.3 CCK-8 法检测细胞增殖 待细胞汇合度约为80%,胰酶消化后进行计数。将细胞铺于96 孔板中(2 × 105个/mL),每孔200 μL,培养箱中培养24后取出,每孔加入100 μL 含有10%CCK-8 试剂,继续培养1.5 h 后用全自动酶标仪(波长为450 nm)检测各孔吸光度(A)值。
1.4 Western Blot 检测 用RIPA 裂解液裂解细胞,BCA 试剂盒检测蛋白浓度。10%十二烷基硫酸钠一聚丙烯酰胺凝胶电泳,电转法(120 V,2 h)将分离胶上的蛋白转移到聚偏氟乙烯膜上,加入含5%脱脂奶粉的TBST 室温1 h,加抗人Sirt5,抗人p-STAT3,抗人STAT3,抗人Nanog 及抗人β-actin一抗4 ℃孵育过夜。随后加入兔抗人二抗室温孵育1 h。ImageJ 软件对目的条带进行灰度值分析。
1.5 RT-PCR 待细胞汇合度约为80%,胰酶消化后进行计数。Trizol 试剂提取总RNA。使用PrimeScript RT reagent kit(Takara,中国)逆转录合成cDNA,然后使用SYBR Premix Ex Taq(Takara,中国)进行RT-PCR 反应。
1.6 统计学方法 采用SPSS 19.0软件对数据进行统计分析。所有实验结果采用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 Sirt5 在肺癌细胞中的表达 与正常人肝细胞L02 相比,Sirt5 在肝癌细胞HepG2、Huh7 及HepG3的mRNA水平显著降低(图1A)。此外,Western Blot结果表明Sirt5 在肝癌细胞HepG2、Huh7 及HepG3的mRNA 水平显著降低,其中以HepG2细胞水平最低,差异具有统计学意义(P<0.05,图1B)。
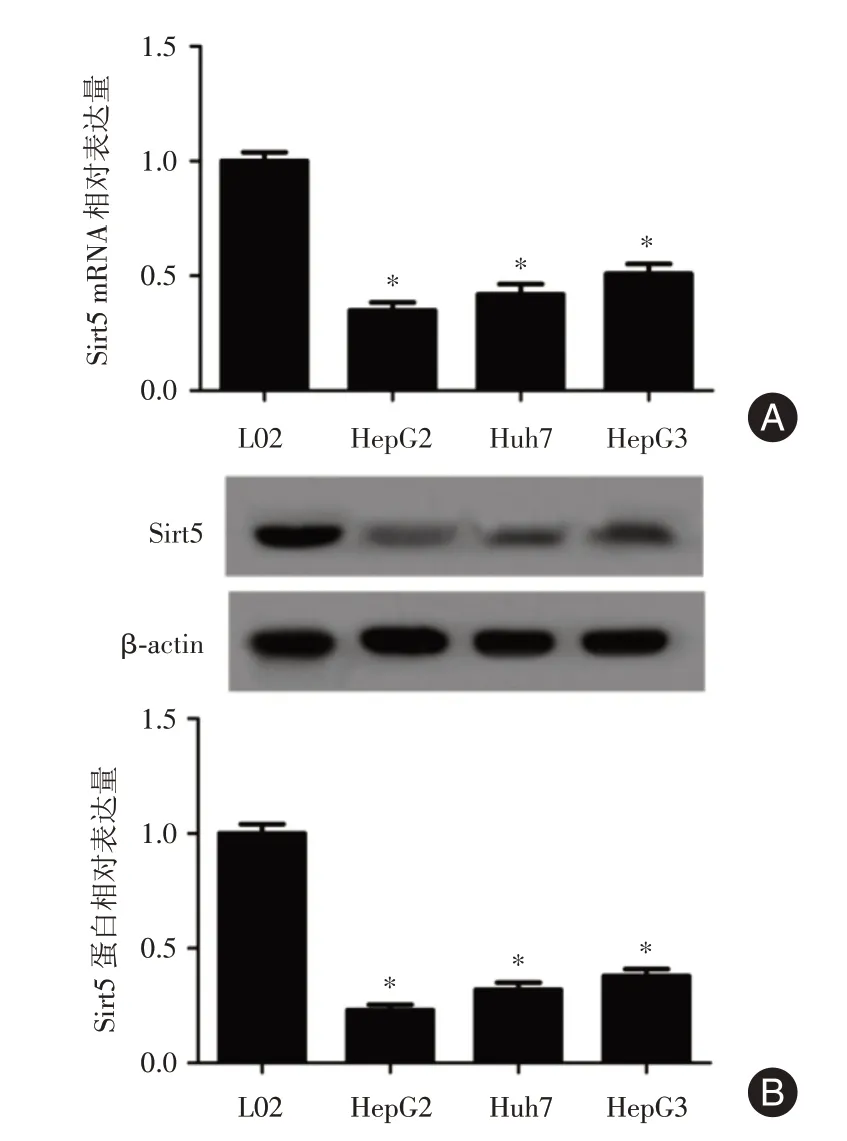
图1 各组Sirt5 表达水平Fig.1 Expression levels of Sirt5
2.2 过表达Sirt5 抑制HepG2 细胞增殖及迁移AAV-Sirt5 转 染HepG2 细 胞,RT-qPCR 及Western Blot 结果均表明Sirt5 表达水平升高,说明Sirt5 腺相关病毒载体转染成功(图2)。CCK-8 实验表明(图3A),与Blank 组(1.00 ± 0.05)或AAV 组(1.03±0.04)相比,AAV-Sirt5组(0.42±0.04)细胞增殖能力显著降低(P<0.05),说明过表达Sirt5 能够显著抑制HepG2 细胞增殖。细胞迁移实验表明,过表达Sirt5 能够显著抑制HepG2 细胞迁移能力(图3B)。

图2 Sirt5 表达水平Fig.2 Expression levels of Sirt5
2.3 Sirt5 过表达抑制STAT3/Nanog 信号通路为了进一步研究Sirt5 抑制HepG2 细胞增殖及迁移的机制,本研究对细胞中STAT3 的水平进行了检测。研究也表明,与Blank 组或AAV 组相比,过表达Sirt5 会显著降低p-STAT3 和Nanog 的相对表达水平,差异具有统计学意义(P<0.05,图4);而STAT3 激活剂colivelin 的加入显著逆转了Sirt5 对STAT3 的抑制作用(P<0.05)。CCK-8 及细胞迁移实验也表明与AAV-Sirt5 组相比,Sirt5+Colivelin 组细胞增殖和迁移能力显著升高(图3)。
3 讨论
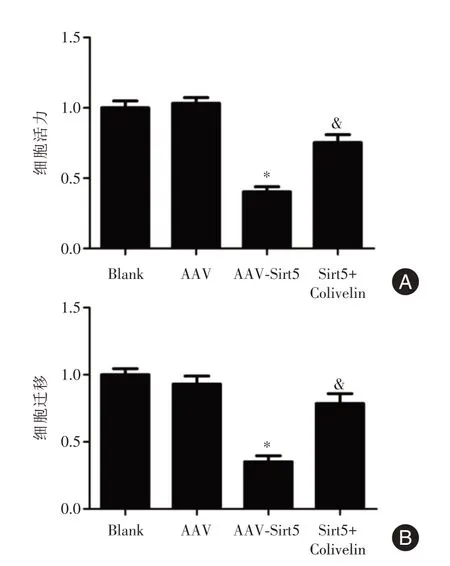
图3 过表达Sirt5 对细胞增殖和迁移的影响Fig.3 Effects of Sirt5 on cell proliferation and migration

图4 STAT3 和Nanog 表达水平Fig.4 Expression levels of STAT3 and Nanog
Sirtuin 是一个高度保守的去乙酰化酶家族蛋白家族。Sirtuin 具有广泛的生理功能,并在调控衰老和寿命方面发挥重要的作用。但目前科学家对于Sirtuin 家族成员在肿瘤发生中的作用存在争议。研究表明Sirt7 在HCC 癌症组织中上升,并促进HCC 细胞生长,其缺失使细胞周期停留在G1[9]。而Sirt4 在结直肠癌中具有抑制癌症的功能[10]。Sirt5 是Sirtuin 家族的一员,定位于线粒体中。Sirt5缺乏赖氨酸去乙酰化酶活性(微弱),但拥有NAD依赖的去丙二酰化酶活性。研究[11]表明Sirt5 可催化赖氨酸去琥珀酰化。当蛋白质超琥珀酰基化时,一些代谢信号通路遭到破坏,包括肝脏中脂肪酸累积以及酮体生成减少。Sirt5 参与多种癌症的发展进程。在人肺癌细胞中,Sirt5 能够将糖酵解过程的限速酶PKM2 去琥珀酰化;在Sirt5 缺失的细胞中,PKM2 琥珀酰水平增加,其丙酮酸激酶活性下降,抑制Sirt5 表达可抑制肺癌细胞增殖[5]。在非小细胞肺癌患者中,Sirt5 高表达,并与预后差有关[12]。Sirt5 可靶向作用于核因子E2 相关因子2(细胞抗氧化程序中的主要转录调控因子),其敲除会抑制非小细胞肺癌细胞生长[12]。过表达Sirt5可减小异柠檬酸脱氢酶(IDH1)超琥珀酰化,抑制神经胶质瘤的恶性生长[13]。但Sirt5 在HCC 患者中的作用和机制还有待进一步确认。本研究表明,Sirt5 在肝癌细胞系HepG2、Huh7 及HepG3 均降低,而在HepG2 中水平最低。这可能与肝癌细胞的侵袭能力(HepG2 的侵袭能力小于Huh7 和MHCC97H)有关。本研究的成果与WANG 等[8]的研究结果相似,即在HCC 患者癌症组织中,Sirt5 低表达。CHEN[14]等近期也揭示Sirt5 能通过抑制过氧化物酶体诱导的氧化应激,抑制HCC 发展。
白介素6/STAT3 是HCC 干细胞更新和增殖的主要信号通路[15]。研究[16]发现,在肺癌细胞系中Sirt5 去乙酰化STAT3,从而抑制STAT3 在线粒体丙酮酸代谢中的作用。本研究也表明过表达Sirt5可以抑制STAT3 的磷酸化及Nanog 蛋白表达。用STAT3 特异性激活剂colivelin 激活STAT3 消除了Sirt5 对细胞增殖和迁移的抑制作用,表明STAT3/Nanog 信号通路在调节Sirt5 介导的HCC 细胞增殖和迁移中起着重要的作用。Nanog 是一种自我更新基因,可维持胚胎干细胞的多能性[17]。研究[18]表明,STAT3/Nanog 通路在肝脏肿瘤干细胞中被激活,导致致瘤性和干性。JSI-124(一种STAT3 信号转导通路抑制剂)可有效地抑制恶性脑胶质母细胞瘤干细胞的增殖及形成神经球的能力[19]。提示Sirt5 可能通过调节HCC 干细胞更新和增殖调节HCC 发展。
综上所述,本研究表明Sirt5 在肝癌细胞系中低表达,过表达Sirt5 可以抑制HepG2 细胞增殖及迁移能力,而此过程可能与抑制STAT3/Nanog 信号通路有关。以上研究结果揭示Sirt5 能够通过调节STAT3/Nanog 通路抑制肝癌发展,且Sirt5 有望成为治疗肝癌的靶标分子。未来将着重于Sirt5 对HCC细胞干性的影响及在动物模型中探讨Sirt5 下调是否会推动HCC 的起始和进展。
