鞍结节脑膜瘤的临床特征
2020-01-17陈立华张洪钿孙恺陈文锦徐如祥
陈立华 张洪钿 孙恺 陈文锦 徐如祥
鞍结节脑膜瘤(tuberculum sellae meningioma,TSM)通常是指起源于鞍结节、蝶骨缘和视交叉沟中线或中线旁等位置蛛网膜颗粒的脑膜瘤,尤其是视神经管和视交叉沟外部的交界处。临床上把起源于鞍膈、鞍结节、蝶骨平台的脑膜瘤统称为TSM。肿瘤主要累及视交叉和视神经,导致早期症状多以视力进行性障碍为主,缓慢进展的视力、视野障碍是TSM最常见、首发症状,常引起不对称的视觉障碍[1]。由于肿瘤不对称生长,视力下降、视野缺损常表现不均衡或只在单侧。本研究回顾性分析笔者自2000年以来经显微手术切除的156例TSM患者的临床资料,总结TSM的临床流行病学特点和病理解剖学特征。
资料与方法
一、一般资料
选取自2000年1月至2018年12月由笔者进行显微手术的TSM患者156例,占同期颅内脑膜瘤的7.8%(156/1994);男性47例,女性109例,男∶女=1∶2.32;年龄范围34~78岁,年龄(48.7±11.7)岁;病程2周~7.8年,平均(18.6±10.3)个月,其中<6个月者24例,6~12个月者76例,>12个月者56例,病程<12个月占64.1%。首发症状:视力减退131例,单侧103例、双侧28例;头痛、头晕16例;记忆力减退、精神异常4例;体检发现肿瘤3例,癲痫2例。
二、视觉功能评价
所有病例术前和术后均由眼科医生进行正规的、详细的、全面的神经眼科评估,接受正规的视力、视野、眼压和扩瞳眼底检查,作为评估肿瘤累及视路的程度和监测肿瘤复发,特别是视神经管内肿瘤复发的参考。通过这个评估,可以预测肿瘤在视神经管内的位置,并有目的地切除肿瘤。分别于术前和术后2周、1、6个月、1年对比测量每只眼的视力和视野。按视力水平分为3级:<0.1、0.1~1.0、>1.0。视野检查结果可确定肿瘤的位置和视神经管受累的方向,CT和MRI扫描可以证实这一结果。
三、内分泌检查
评估下丘脑-垂体轴功能,包括尿比重和渗透压,以及血皮质醇、TSH、FT3和FT4水平。向后、上方生长的肿瘤可能会引起下丘脑-垂体轴的功能紊乱,对术前有临床表现或影像学上提示肿瘤累及下视丘-垂体轴者,术前均应接受内分泌检查,评估手术前后(3 d和3个月)下丘脑-垂体轴功能。
四、术前影像学评估
所有患者术前和术后均行头颅CT和/或MRI扫描,其中131例术前采用颅底薄层CT,153例接受增强MRI扫描检查,另26例术前行MRA或CTA检查,21例同时行脑血管造影检查(digital subtraction angiography,DSA)。仔细评估肿瘤是否侵袭一侧或双侧视神经管、侧方生长的范围、视路移位等情况,这有助于决定术中是否需进行视神经管减压。术前影像学评估包括:肿瘤大小、是否伴有脑水肿、肿瘤是否伴有钙化、肿瘤基底是否伴有颅骨骨质增生或破坏、肿瘤向蝶鞍浸润情况、肿瘤与前循环的位置关系等,以便指导手术进程。
1.术前CT评估:薄层CT扫描评估周围骨质解剖和窦的气化情况,在CT骨窗位扫描上,采用3 mm厚的轴位扫描进行骨质侵犯的分析。术前CT可以了解肿瘤浸润导致的骨质破坏或增生,并确认额窦的位置。TSM在CT上表现为基底位于鞍结节和鞍膈的硬膜的鞍上等高密度圆形或类圆形肿块,边界清楚。
2.术前MRI评估:(1)MR检查可清楚显示病变的大小、形态、扩展方向以及与视交叉、下丘脑、主干血管的关系。增强MRI有助于判断肿瘤的边界、与视器的关系,MRI三维成像可显示肿瘤与视神经、颈内动脉、大脑前动脉、下丘脑、垂体柄和双侧海绵窦等周围结构的解剖关系。TSM表现为均匀、明显强化的球形、半球形或匍匐状占位,蝶鞍大小均正常,边界清楚,沿颅底向前上方发展,行似“鸟嘴”。肿瘤以鞍结节为中心向前、后、两侧及上方生长,向前生长明显者可接近嗅沟的后缘,向后生长者可达鞍膈的上表面及垂体柄的前面。肿瘤均匀强化137例,非均匀强化者19例,其中83例见到特征性的“脑膜尾征”。视神经管薄层增强扫描可见视神经管内强化明显的肿瘤征,73例可见肿瘤侵入神经管。据肿瘤的最大直径进行分类:肿瘤最大径范围为1.6~7.0 cm,平均(3.8±1.4)cm。其中<2 cm为小型,21例;2~4 cm为中型,93例;4~6 cm为大型,37例;>6 cm为巨大型,5例。不同类型TSM的特征见表1。(2)T2WI根据肿瘤周围组织的等强度或高强度信号来判定是否存在脑水肿,以及评价颈内动脉远端和大脑前动脉近端的包绕情况。瘤周伴有不同程度水肿者41例,脑积水者14例。肿瘤位于鞍结节,向鞍隔、蝶骨平台扩展者64例,肿瘤向侧方累及海绵窦者13例,向鞍旁扩展至颈动脉池者72例;包绕一侧颈内动脉床突上段或和大脑前动脉复合体者56例,视交叉受压上抬者32例,向下生长累及鞍隔、垂体者36例,向后挤压或侵入第三脑室底前部者26例。压迫第三脑室27例,脑干受压移位22例。MRA显示大脑前动脉A1、A2段上抬后移,其中部分变细、僵直,提示已被肿瘤包裹。行DSA检查28例,均显示大脑前动脉A1段和前交通动脉上抬并向后外侧移位,呈抱球状,其中显示动脉变细、僵直21例。

表1 鞍结节脑膜瘤类型与特征
五、手术方法和步骤
156例TSM患者均采用显微外科手术治疗,1998~2005年采用单侧额下入路、翼点入路、眶颧入路,分别有23、33、4例;2005~2018年采用额外侧入路、眶-额入路、经眉锁孔入路,分别有62、27、7例。眶-额入路是在经典额外侧入路的基础上去除眉弓外侧1/2,以改善对第三脑室底的显露。如果肿瘤直径≤4 cm,则采用额外侧入路;如果肿瘤直径>4 cm,则需要眶-额入路获得更大的空间,以获得更好的肿瘤暴露。根据手术入路的不同选择不同的切口线,切口接近发际弧线。骨窗大小约(2.5~4.0 cm)×(3.5~5.0 cm),无论采用何种手术入路,骨窗前缘平前颅底、外邻蝶骨嵴外缘,磨除蝶骨嵴及额骨眶板骨突起,以扩大显露鞍区视野。自前外向后内侧抬起额底,利用“水分离”及棉片保护技术,分离肿瘤与周围毗邻的神经和血管。术中严格遵循先断肿瘤基底或离断基底大部后再在肿瘤与周同神经、血管之间的潜在蛛网膜间隙、蛛网膜束带分离、分块切除肿瘤。
六、术后随访与评估
对全部病例进行随访,随访内容包括临床随访和影像学随访。视力视野、内分泌和神经影像,采用Simpson分级评估肿瘤的切除程度。随访期间未见有视力恶化。
结 果
一、视觉功能检查
术前151例有明显的视力障碍(<1.0),其中127例为非对称(84.1%,127/151);嗅觉减退7例,无其他的神经功能障碍,伴内分泌功能障碍3例。视野检查多数有不同程度的视野缺损,有214只眼(其中121只眼为单颞侧偏盲,93只眼为象限盲),另有8只眼全盲,这些视野障碍占71.2%(222/312),多以一侧为重,另90只眼视野正常。眼底检查:检查视神经盘,视乳头水肿73只眼,视乳头萎缩31只眼。无视野改变的视力下降有80只眼,占视力下降眼的26.5%(80/302),有视野缺损者均有视力下降。
二、内分泌检查
本组对影像学上肿瘤≥6 cm、或肿瘤≥4 cm向后方生长使视丘下部-垂体轴产生移位的87例进行了术前内分泌功能全项检查,发现血皮质醇水平低下8例,性激素水平低下5例。
三、肿瘤放射学特征
156例患者中CT表现等密度者96例,略高密度者45例,混杂密度者15例;骨质增生32例(20.5%),肿瘤钙化15例(9.6%);视神经管CT扫描可发现视神经管骨质增生者11例。73例(46.8%)术前影像提示视神经管受累。术前影像未提示有神经管侵袭的24例术中视神经管探查时,发现视神经管内有明确的肿瘤侵袭。根据术前和术中所见,本组共发现97例(62.2%)肿瘤侵入视神经管内,共87例(55.8%)需打开视神经管;13例(8.3%)肿瘤向外侧生长,累及海绵窦;56例向外侧或向后方生长,包绕颈内动脉或和大脑前动脉复合体,占35.9%。
四、术后视力改善率及随访
以单眼视觉为研究对象,虽然一些患者术后出现暂时性的视力减退,但大多数患者随着时间的推移有不同程度的恢复。因此,术后视力评估选择在术后1个月进行。术后视力改善共218只眼(69.87%),64只眼(20.51%)维持术前水平,30只眼(9.62%)恶化。随着肿瘤的增大,术后视力的保护和改善率差异明显。本组患者随访时间3个月~7.4年,平均(18.5±15)个月,肿瘤的切除程度SimpsonⅠ~Ⅱ145例,其中视力改善101例(69.66%),SimpsonⅢ~Ⅳ11例,其中视力改善8例(72.73%)。详细信息见表2。
五、典型病例
患者,女性,54岁,因视力下降、头痛13个月入院。体检:左眼,0.05;右眼,0.2。影像学检查:CT平扫见鞍结节区不规则形等密度影,边缘欠清,周围见低密度水肿影;CT三维骨质重建显示鞍结节区骨质生,左侧前床区骨质受侵蚀;T1WI见鞍区稍长T1异常信号灶;T2WI见鞍区大片状稍长T2,其内见多发蚓状低信号血管影,周围见环片状长T2长T1及稍长T2稍长T1水肿影;GD-DTPA后肿瘤明显异常强化,约6.1 cm×5.5 cm×6.3 cm大小;DSA显示眼动脉异常增粗,大脑前动脉受压向后上方拉长移位。术前准备后在全身麻醉下经左侧额外侧入路行TSM切除术,术中见肿瘤质地中等,血供丰富,于显微镜下全部切除肿瘤及其侵犯的硬脑膜组织,视神经及视交叉予以保留完整。术后患者视力较术前明显改善,术后复查颅脑MRI检查提示肿瘤切除完整。术后3个月随访复查颅脑MRI未见肿瘤复发。详细信息见图1。

表2 156例鞍结节脑膜瘤患者术后的视觉分析[例(%)]
讨 论
TSM于1899年由Steward在尸检中偶然发现。1916年,Cushing首次成功手术全切TSM,但直到1929才由Cushing和Eisenhardt报告。关于TSM的定义一直以来比较模糊,1930年Cushing阐述TSM起源于鞍结节和视交叉切迹。Jallo和Benjamin[2]认为这两类脑膜瘤从解剖学上不能鉴别,而应统称为TSM。目前,临床上认为起源于鞍结节、鞍隔、视交叉沟,在视交叉下部生长的脑膜瘤统称TSM[3-6]。
一、临床特点
(一)临床分期
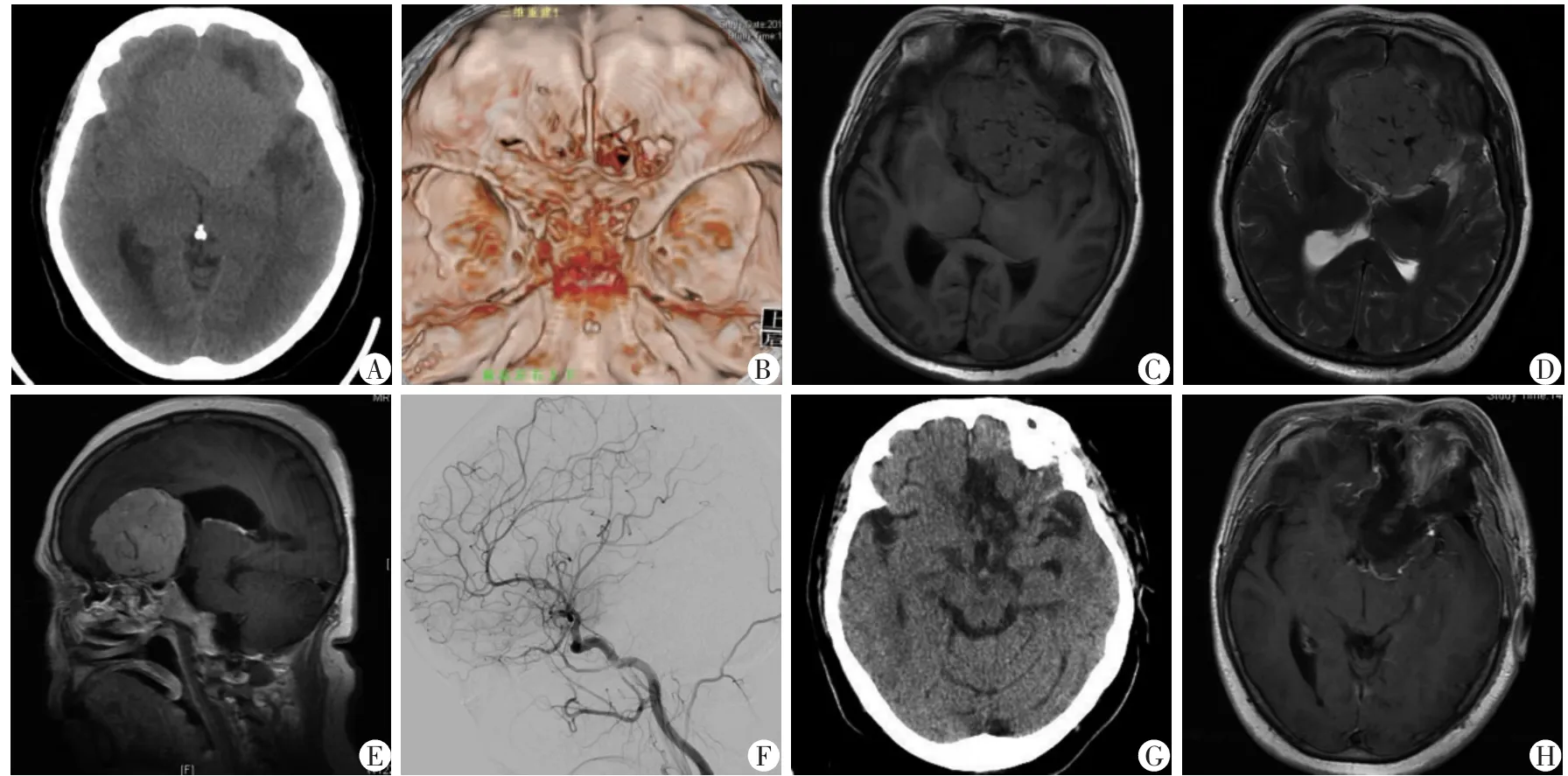
A:术前CT平扫;B:术前CT三维骨质重建;C:术前T1WI见鞍区稍长T1异常信号灶;D:术前T2WI见鞍区大片状稍长T2;E:术前GD-DTPA后肿瘤明显异常强化;F:术前DSA;G:术后平描CT;H:术后增强MRI轴位见鞍结节脑膜瘤完整切除
1938年,Cushing和Eisenhardt[7]报告了28例TSM患者,并根据其大小、视交叉受压变形情况将TSM分为4期:Ⅰ期,初期;Ⅱ期,症状前期;Ⅲ期,症状早期,最大径约2.0~4.5 cm,适合于手术,手术效果较好;Ⅳ期,肿瘤最大径>4.5 cm,手术难度大,手术效果较差,术后容易出现下丘脑损伤的症状。本研究根据肿瘤大小将其分为4型,其中21例小型TSM处于初期和症状前期,临床表现为视力障碍和头痛,单纯从症状上很难鉴别TSM和其他鞍区脑膜瘤,且视交叉综合征的出现多不典型;93例中型TSM为症状早期,出现了视野缺损的症状;42例大型和巨大型脑膜瘤,临床表现上相当于Cushing分期的Ⅳ期,此期肿瘤不易获得全切除,而且术后容易出现并发症。
(二)症状特点
1.症状不对性:多数起源于鞍结节外侧端的硬脑膜。随着肿瘤增大,视神经在视神经管处成角或进一步受压,可被肿瘤非对称包裹、向外移位,出现不对称视觉症状,以不对称的双眼视力损害为特征,这与垂体腺瘤不同,双颞侧偏盲少见。在制定手术方案时,应考虑到这一特点。Lee等[8]报道100例TSM患者,95例(95%)神经眼科检查后有明显的视觉障碍,其中89例(89%)有明显的不对称视野缺损,只有6例(6%)有相对对称的视野缺损。肿瘤不同的生长方式,需选择不同的手术入路。本组156例患者中体检发现151例有明显的视力障碍(<1.0),其中127例为非对称性视力障碍(84.1%,127/151)。
2.症状隐匿、偶发性:TSM属于鞍上、视交叉下的中线部位肿瘤,如果肿瘤较软,生长过程非常隐袭,毗邻的神经和血管亦可无症状地被肿瘤包裹,而在体检时被发现。或在出现显著的视交叉压迫症状之后才得以诊断,而这时肿瘤已经具有相当大的体积了,大型肿瘤者还会因为占位效应和水肿导致额叶和下丘脑功能障碍。本组患者中有3例是在体检时发现,占本组病例的1.9%。
(三)常见症状
1.首发症状:视觉障碍是最常见的首发症状,表现为进行性视力下降,常自一侧开始,逐渐累及对侧。Nakamura等[3]报道72例TSM,所有的患者都有视觉障碍。Nozaki等[9]报道的20例TSM和2例蝶骨平台脑膜瘤患者,其中19例术前出现视觉症状,3例无症状。Bassiouni等[1]报道62例TSM患者,87.1%的患者出现视觉损害,79%的患者视力下降,64.5%的患者视野受损。此外,14.5%的患者术前有激素异常。本研究156例TSM患者,首发症状表现为视力减退131例(84%),单侧103例、双侧28例。体检发现151例有明显的视力障碍(<1.0),其中127例为非对称(84.1%,127/151)。
2.早期症状:TSM往前爬行至蝶骨平台,往外侧包绕视神经和视管,并往上推挤、越过视交叉。当肿瘤体积增大压迫视神经和视交叉时,可有视力减退,视野缺损等。鞍结节区的平均长度为8 mm(5~13 mm),宽度为11 mm(6~15 mm)。因而,只要肿瘤直径>15 mm,即可视觉通路受压,引起视力障碍等临床症状;如肿瘤起源于视神经孔,则可在更小的直径即可引起视力下降[10]。因此,TSM早期即可引起视力障碍而较早发现,大多数肿瘤发现时<4 cm,这有别于嗅沟脑膜瘤。
3.常见症状:TSM包绕毗邻结构,若视力视野损害不明显或未受重视,肿瘤则继续向第三脑室底、视丘下部方向生长,压迫第三脑室导致脑积水,颅内压会不断提升,最终诱发头痛、呕吐等临床症状。本研究156例TSM患者中,131例首发症状表现为视力减退,16例为头痛、头晕,另有4例以记忆力减退、精神异常就诊。入院体检时发现151例患者有明显的视力障碍(<1.0),其中127例为非对称(84.1%,127/151)。Chokyu等[11]报道34例TSM患者,其中32例术前有视力障碍。Mortazavi等[12]报道25例TSM患者,其中21例有术前有视力障碍。可见,不对称性视觉功能障碍是TSM最早期,也是最常见的症状。
二、影像学特点
(一)TSM的基本影像特点
TSM的基本影像特点是术前评估的重点。术前核磁共振三维平扫+增强和MRA或CTA用来评估血管是推挤或包绕,TSM的血供主要来源于眼动脉的筛后分支和软脑膜血管。肿瘤一般向后上方的视器生长,将视交叉推向后上方,并且常常侵犯单侧或双侧视神经管的内侧部,但肿瘤巨大时,视交叉受压变薄而难以在核磁片上定位。视神经与肿瘤的关系(如黏连、包埋)影响手术结果,只有在显微手术中才能充分认识[1,13]。大型肿瘤需T2序列评估肿瘤与血管的关系,如大脑前动脉,MRA提供的重要血管结构移位信息更具可靠性。TSM的钙化率和骨质增生率,文献报道相差较大。Liu等[10]报道21例TSM患者,均出现视力缺损和视神经管受累,14例视神经管内有骨增生。本组156例TSM患者CT表现为骨质增生32例,肿瘤钙化15例;13例肿瘤向外侧生长,累及海绵窦;56向外侧或向后方生长,包绕颈内动脉或和大脑前动脉复合体,占35.9%。
(二)视神经管受累的发生率
肿瘤的MRI上的视神经管受累程度、术中视神经的黏连以及术前视力水平是影响最终临床预后的重要因素[10,12]。因此,术前了解视神经管是否受肿瘤侵袭有助于制定手术策略。虽然术前视力受损可能意味着肿瘤会延伸到视神经管,但术前彻底的放射检查,包括磁共振成像,对于制定手术方案是必须的。有文献报道术前有视力障碍的患者均有视神经管受累[14]。Sade和Lee[15]回顾性分析31例TSM患者,术前累及视神经管占77.4%,视野缺损83.8%;术前有视力损害的患者,视神经管累及率高达84.6%,术前无视力损害者,仍有40%的患者累及视神经管,可见视神经管受肿瘤侵袭与术前的视觉状态有很好的相关性[16]。本组术前73例患者在影像提示视神经管受累,术前影像未提示有神经管侵袭的24例患者术中视神经管探查时,发现视神经管内有明确的肿瘤侵袭。根据术前和术中所见,本组共发现97例患者的肿瘤侵入视神经管内,共87例患者需打开视神经管。
综上所述,不对称性视觉功能障碍是TSM最早期,也是最常见的症状。肿瘤往往累及视神经管,术前明确肿瘤是否有累及视神经管、钙化和骨质增生是TSM术前评估的重点。
