免疫磁性糊精微球的制备及快速分离检测单增李斯特菌
2020-01-16张素敏王晓闻贾治勇
石 薇 张素敏 王晓闻 贾治勇
(山西农业大学 山西太谷 030801)
单增李斯特菌(Listeria monocytogenes)在自然界广泛存在,是一种兼性厌氧细菌,同时也是一种常见的食源性致病菌,具有致命性[1-2]。单增李斯特菌能在2~42℃的环境下生存,最合适的生长环境温度为30~37℃。由该种菌引起的疾病被称为李斯特菌病,致死率高达30%左右[3-7]。李斯特菌被WHO列为20世纪90年代四大食用致病菌之一,同时也是对中国人的卫生健康具有严重威胁的12种病原微生物之一[8]。我国对于食源性单增李斯特菌的检测十分重视。目前,致病菌检验多采用传统的检测方法、PCR方法及实时荧光PCR法等。传统的检测方法一般需要5~7 d,周期长,过程繁琐;PCR方法及实时荧光PCR方法虽然操作简单,但需要待检样品中菌体达到较高浓度[9-13]。免疫磁性微球选择性好、特异性强,能快速富集浓缩细菌,可以有效避免或减少漏检,缩短检测时间,且可去除食品样品中抑制PCR扩增的成分。本研究先制备免疫磁性糊精微球,通过与其菌体抗原进行特异性的结合而快速且大量的捕获单増李斯特菌,建立一种快速、灵敏的食源性致病菌检测方法。
1 试验材料
1.1 材料与试剂
单增李斯特菌(CMCC54001),山西省生物研究所。
抗体Rb a listeria tropina,博奥森生物试剂有限公司;细菌基因组DNA快速提取试剂盒50次,天根生化科技有限公司;50×TAE Buffer、核酸染料、BM 2000 DNA Marker,北京博迈德基因技术有限公司;环氧氯丙烷、氢氧化钠、硫代硫酸钠、琼脂、氯化钠、牛肉膏等均为分析纯级。
1.2 仪器与设备
KS50R台式高性能冷冻离心机,凯达科学仪器有限公司;GS-1860凝胶成像系统,北京麦思高科技有限公司;DYCZ-20A电泳槽、WD-9408E电泳仪,北京市六一仪器厂;UV-2100紫外可见分光光度计,上海尤尼柯仪器有限责任公司;HZQF160全温振荡培养箱,哈尔滨市东联电子技术开发有限公司;PYX-Ⅱ隔水式电热恒温培养箱,上海跃进医疗器械厂;立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂。
2 试验方法
2.1 磁性糊精微球的制备
称取一定量的糊精、NaOH,加入一定量的蒸馏水,置于85℃水浴锅中糊化30min,直至深红色为止即为水相。以正己烷为油相,加入一定量的表面活性剂司班60和吐温60,再加入一定量的助表面活性剂正戊醇。将一定量的水相滴加到油相中并不停地搅拌,加入三偏磷酸钠、磁粉,超声波振荡直至磁粉溶解。在60℃温度下的水浴锅中反应3 h,随后在85℃的温度下破乳0.5 h后倒去油相。水相用无水乙醇、乙酸乙酯反复洗涤直至残留油相消失,烘箱内烘干后待用[14]。
2.2 免疫磁性微球的制备
2.2.1 磁性糊精微球的活化 将烘干后的糊精微球用蒸馏水浸泡溶胀,将水滤净后加入适宜浓度的NaOH溶液,将一定量的环氧氯丙烷边搅拌边滴加到液体中,30℃振荡一定时间,将溶液去掉。用丙酮和蒸馏水洗涤数次,直至淋洗液中加入硫代硫酸钠和酚酞指示剂无明显颜色变化即可,得到的球就是活化后的磁性糊精微球[15]。
2.2.2 活化后的磁性糊精微球环氧密度的测定 环氧基可与硫代硫酸钠反应,活化好的磁性糊精微球先与硫代硫酸钠发生反应,然后用盐酸滴定反应生成的OH-。定义环氧密度(Epoxy density,EPD)为每克活化磁性糊精微球中含有环氧基的μmol数。活化后的磁性糊精微球加入5mL 1.3 mol/L的Na2S2O3,室温下反应2 h后加入5 mL H2O,用0.1mol/L的HCl滴定。环氧密度(μmol/mg)=C×V×1 000/M(1)式中,C——HCl浓度,mol/L;V——滴定消耗HCl体积,L;M——磁性糊精微球质量,g。
2.2.3 各因素对磁性糊精微球环氧密度的影响 在环氧氯丙烷活化磁性糊精微球的过程中,反应时间、反应体系中氢氧化钠的浓度与环氧氯丙烷的用量是影响反应的几个重要因素,为得到最佳活化条件,对这几个因素做了考察。
1)环氧氯丙烷的用量对磁性糊精微球环氧密度的影响 按照2.2.1的方法活化磁性糊精微球。其它条件不变,改变环氧氯丙烷的用量来活化微球,考察环氧氯丙烷的用量对磁性糊精微球环氧密度的影响。固定NaOH溶液浓度为2mol/L,30℃下振荡5 h,环氧氯丙烷用量分别为0.1,0.2,0.3,0.4,0.5mL/g的条件下活化磁性糊精微球,然后将活化好的磁性糊精微球按照2.2.2的方法,测定环氧氯丙烷的用量对磁性糊精微球环氧密度的影响。
2)NaOH溶液浓度对磁性糊精微球环氧密度的影响 按照2.2.1的方法活化磁性糊精微球。其它条件不变,改变NaOH溶液浓度来活化微球,考察NaOH溶液浓度对磁性糊精微球环氧密度的影响。固定环氧氯丙烷的用量为0.4mL/g,30℃下振荡 5 h,NaOH 溶液浓度分别为1.0,1.5,2.0,2.5,3.0mol/L的条件下活化磁性糊精微球。然后将活化好的磁性糊精微球按照2.2.2的方法,测定NaOH溶液浓度对磁性糊精微球环氧密度的影响。
3)反应时间对磁性糊精微球环氧密度的影响 按照2.2.1的方法活化磁性糊精微球。其它条件不变,改变反应时间来活化微球,考察反应时间对磁性糊精微球环氧密度的影响。固定环氧氯丙烷的用量为0.4mL/g,NaOH溶液浓度为2mol/L,30℃下,反应时间分别为1,3,5,7,9 h的条件下活化磁性糊精微球。然后将活化好的磁性糊精微球按照2.2.2的方法,测定反应时间对磁性糊精微球环氧密度的影响。
2.2.4 免疫磁性糊精微球的制备 由PBST溶液(含0.05%吐温20,pH 7.4)作为反应的偶联缓冲液,取0.5mg已活化的磁性糊精微球,用活化缓冲液洗涤后,用偶联缓冲液洗涤数遍,再加入450 μL偶联缓冲液和50μL抗体溶液,在适当的温度下反应一段时间,使得磁性糊精微球表面上的羟基基团同抗体上的氨基基团相互结合,将抗体偶联到磁性糊精微球表面上[2]。得到的微球就是所需要的免疫磁性糊精微球。
2.2.5 各因素对免疫磁性糊精微球制备的影响
1)偶联抗体时最佳抗体质量浓度的选择取5个EP管,将0.5mg已经活化过的磁性糊精微球加入管中。洗涤后加入450μL偶联缓冲液进行重悬。在5个EP管中分别加入50μL质量浓度分别为0.5,1.0,1.5,2.0,2.5mg/mL的抗体溶液,使磁性糊精微球表面的羧基同抗体上的氨基在28℃下反应2.5 h。反应后的免疫磁性糊精微球用PBS缓冲液多次淋洗,直至在波长280 nm处的吸光值为零时,停止淋洗,收集淋洗液并定容。在波长280 nm和260 nm处测其淋洗液的吸光值,利用蛋白质浓度公式(蛋白质浓度=1.45A260-0.74A280)计算剩余抗体量,利用交联率公式确定最佳质量抗体浓度。
2)偶联抗体时最佳偶联时间的选择 取6个EP管,将0.5mg已经活化过的磁性糊精微球加入管中。将其洗涤后,加入450μL偶联缓冲液进行重悬。分别在6个EP管中加入50μL质量浓度为1mg/mL的抗体溶液,使磁性糊精微球表面的羟基同抗体上的氨基在28℃下反应0.5,1,1.5,2,2.5,3 h。反应后的免疫磁性糊精微球用PBS缓冲液多次淋洗,直至在波长280 nm处的吸光值为零时,停止淋洗,收集淋洗液并定容。在波长280 nm和260 nm处测其淋洗液的吸光值,利用蛋白质浓度公式(蛋白质浓度=1.45A260-0.74A280)计算剩余抗体量,利用交联率公式确定最佳偶联时间。
3)偶联抗体时最佳偶联温度的选择 取6个EP管,将0.5mg已经活化过的磁性糊精微球加入管中。洗涤后加入450μL偶联缓冲液进行重悬。分别在6个EP管中加入50μL质量浓度为1 mg/mL抗体溶液,使磁性糊精微球表面的羧基同抗体上的氨基在 5,15,20,25,30,35℃下反应 2.5 h。反应后的免疫磁性糊精微球用PBS缓冲液多次淋洗,直至在波长280 nm处的吸光值为零时,停止淋洗,收集淋洗液并定容。在波长280 nm和260 nm处测其淋洗液的吸光值。利用蛋白质浓度公式(蛋白质浓度=1.45A260-0.74A280)计算剩余抗体量,利用交联率公式确定最佳偶联温度。
2.3 免疫磁性糊精微球捕获单增李斯特菌
2.3.1 免疫磁性糊精微球捕获单增李斯特菌时各个因素的影响 免疫磁性糊精微球的用量和捕获时间是捕获单增李斯特菌时的关键性因素。在前期准备试验中得知捕获时菌液的浓度为102,103,104CFU/mL时,涂布前、后计数效果最好。以下试验中菌液浓度均为这3种菌液浓度。制备好的免疫磁性糊精微球包被在PBST缓冲液中。
1)捕获单增李斯特菌时免疫糊精微球最佳用量选择 取5个EP管,加入100μL一定浓度的单增李斯特菌菌液,每个管分别加入50,100,150,200,250μL的免疫磁性糊精微球,在 25℃的恒温振荡培养箱中反应1 h。外加磁场作用于免疫磁性糊精微球,将悬浮液及用适量的缓冲液重复洗涤3次的悬浮液置于另一个EP管中。将每个EP管中的剩余菌液在LB平板上涂布,37℃下培养24 h后计数,利用捕获率公式得到免疫磁性糊精微球的最佳用量。
2)捕获单增李斯特菌时的最佳时间选择 取5个EP管,分别加入100μL一定浓度的单增李斯特菌菌液,每个管加入100μL包被后的免疫磁性糊精微球,在25℃的恒温振荡培养箱中反应0.5,1,1.5,2,2.5 h。外加磁场作用于免疫磁性糊精微球,将悬浮液及用适量的缓冲液重复洗涤3次的悬浮液置于另一个EP管中。将每个EP管中的剩余菌液在LB平板上涂布,37℃温度下培养24 h后计数,利用捕获率公式得到免疫磁性糊精微球捕获菌的最佳时间。
2.3.2 捕获后DNA的提取 取6个EP管,分别依次加入 100 μL 浓度为101,102,103,104,105,106CFU/mL的单增李斯特菌菌液,每个管分别加入100μL免疫磁性糊精微球,在25℃恒温振荡培养箱中反应1 h。采用同浓度的沙门氏菌作为对照组。外加磁场作用于免疫磁性糊精微球,待沉淀与悬浮液完全分离,按照细菌基因组DNA提取试剂盒说明书上的方法,分别提取沉淀与悬浮液中的DNA。
2.3.3 琼脂糖凝胶电泳 用胶带封住塑料托盘开放的两端,形成模具,置一水平面上;准确称量0.5 g琼脂糖干粉加到盛有50mL TAE电泳缓冲液的三角瓶中,在电炉上加热至琼脂糖熔化,放置常温冷却,再加热,如此反复溶解3~5次,排出气泡;将熔化的凝胶稍冷却后加入溴化乙锭(10mg/mL)5 μL使终质量浓度为0.5μg/mL,轻轻地旋转以充分混匀凝胶溶液;将梳子放在托盘上形成符合要求的加样孔,把温热的琼脂糖凝胶溶液倒入模具,凝胶厚度为3~5 mm;让凝胶完全凝结,小心拔出梳子,轻轻撕去封边胶带,将凝胶安放到电泳槽内。向电泳槽加入电泳缓冲液,刚好没过凝胶约1 mm;混合 5μL DNA模板和1μL 6×Loading-Buffer后,加入凝胶的加样孔内,对照为BM 2000 DNA Marker;盖上电泳槽盖,接好电极插头,110 V电泳15 min。电泳完成后,将凝胶板放在成像系统中观察,并拍照。
2.3.4 PCR扩增 根据单增李斯特菌的基因序列,选取溶血素hlyA基因序列作为引物的基础,用Beacon Designer软件设计引物,并由北京全式金生物有限公司进行合成,引物具体序列如表1所示。
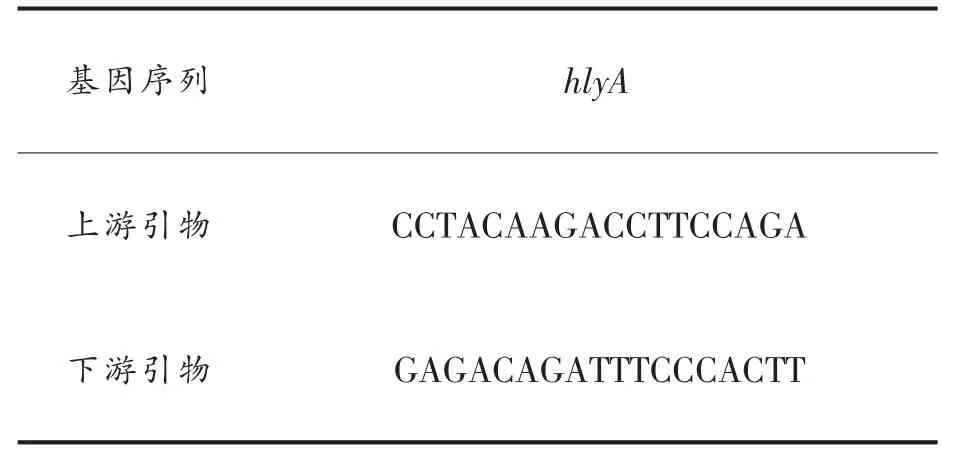
表1 PCR引物序列Table1 Primer sequences for PCR
以提取的DNA为模板,采用上述引物进行PCR扩增[11]。扩增条件:94℃变性5min,之后进行30个循环(94℃ 40 s,50℃ 30 s,72℃ 1min 30 s),最后72℃延伸10min。再用TAE配制1%琼脂糖凝胶,取5μL PCR扩增产物进行琼脂糖凝胶电泳,并用凝胶成像系统记录电泳图。
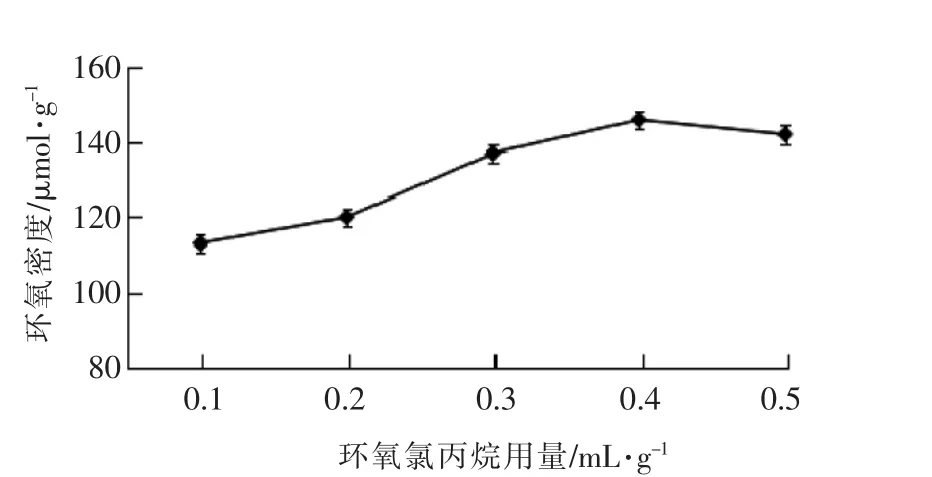
图1 环氧氯丙烷用量对磁性糊精微球环氧密度的影响Fig.1 Effect of epichlorohydrin amount on epoxy density of magnetic starch microspheres
3.1.3 反应时间对磁性糊精微球环氧密度的影响 由图3可知,反应时间对磁性糊精微球上环氧密度有重要影响,在30℃反应5 h,可获得最高环氧密度。在反应初期,糊精微球上环氧密度随时间的延长而增加;反应5 h以后,糊精微球上环氧密度开始降低。这可能是由于活化反应是在水相中
3 结果与分析
3.1 磁性糊精微球的活化
3.1.1 环氧氯丙烷的用量对磁性糊精微球环氧密度的影响 从图1可以看出,在一定范围内,反应体系中环氧氯丙烷的添加量越多,环氧密度(EPD)越高,且其曲线关系接近线性,当环氧氯丙烷用量为0.40mL/g时,环氧密度达到最大,继续增加环氧氯丙烷用量,环氧密度反而略微下降,这可能是由于溶液中游离过多的环氧基导致已活化微球表面的环氧基相互交联,或是发生开环等一系列副反应,造成环氧密度下降。因此合适的环氧氯丙烷用量为0.40mL/g。
3.1.2 NaOH溶液浓度对磁性糊精微球环氧密度的影响 图2中数据显示,反应体系中氢氧化钠的浓度为2mol/L时,环氧密度(EPD)最大。NaOH在此反应中起催化作用,浓度过低,不利于反应的进行,活化反应不完全;浓度过高,有更多的环氧氯丙烷参与反应,而环氧氯丙烷自身的水解反应速度增加,使磁性糊精微球的活化程度降低,另外,NaOH浓度过高可能会使已活化的磁性糊精微球上的环氧基发生开环反应,导致环氧密度降低。因此活化磁性糊精微球选择2.0 mol/L的NaOH浓度最为适宜。进行,而环氧氯丙烷难溶于水,这使它在水相中的浓度很低,而且环氧氯丙烷要靠扩散到达磁性糊精微球表面与羟基反应,所以反应需要一定的时间才能使环氧密度达到最大值,然而时间过长,已活化的磁性糊精微球上的环氧基会发生交联或水解开环等副反应,造成环氧密度降低。
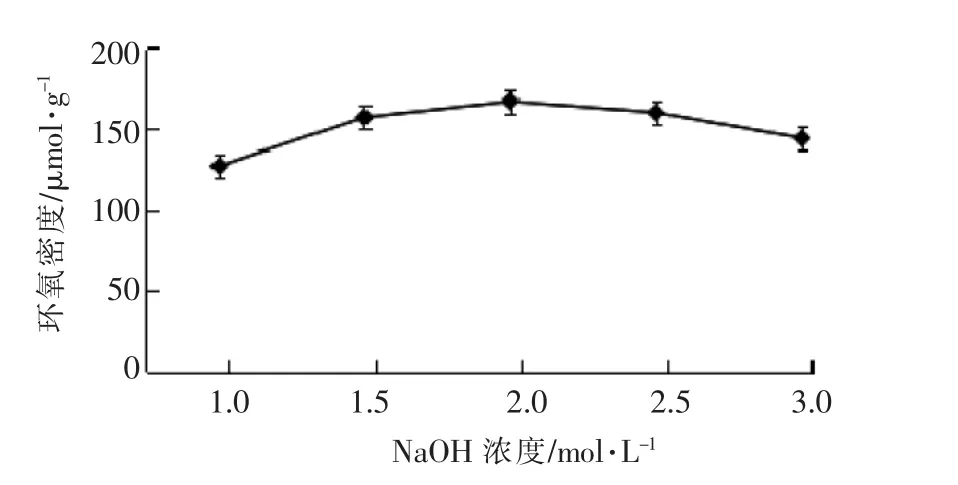
图2 NaOH浓度对磁性糊精微球环氧密度的影响Fig.2 Effect of NaOH concentration on epoxy density of magnetic starch microspheres
3.2 免疫磁性糊精微球的制备与优化
3.2.1 不同因素对免疫磁性糊精微球制备的影响 根据各个样品所测定的吸光值,利用蛋白质浓度公式(蛋白质浓度=1.45A260-0.74A280)确定淋洗液中的抗体含量,从而得到磁性糊精微球所偶联的抗体量,根据交联公式得到交联率:交联率=(原始反应抗体量-淋洗液中抗体量)/原始反应抗体量
1)制备免疫磁性糊精微球时抗体质量浓度的影响 由图4的5个不同抗体质量浓度环境下的磁性糊精微球交联率来看,抗体质量浓度为1.0 mg/mL时,磁性糊精微球偶联效果明显要优于抗体质量浓度为0.5mg/mL的偶联效果,基本上与1.5,2.0,2.5mg/mL这3种抗体质量浓度的偶联效果相当。再者因为抗体本身是一种比较昂贵的生物试剂,结合应用的成本考虑,将最佳偶联抗体的质量浓度选择为1.0mg/mL。
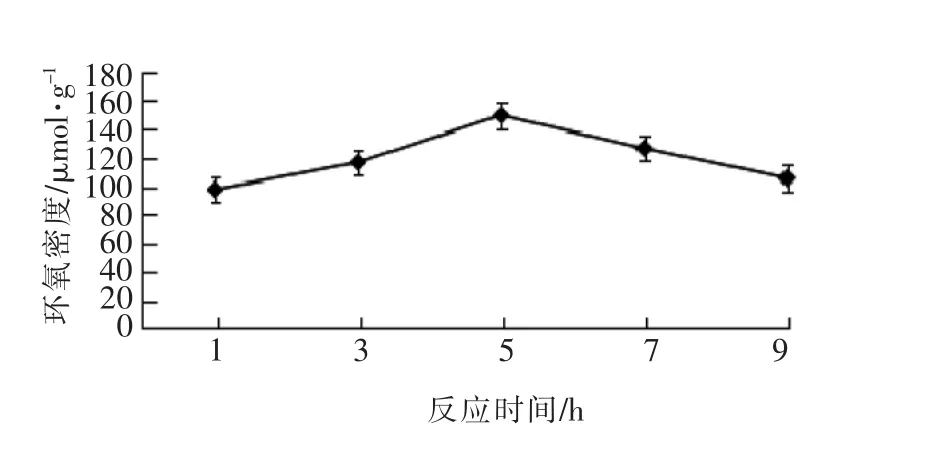
图3 反应时间对磁性糊精微球环氧密度的影响Fig.3 Effect of reaction time on epoxy density of magnetic starch microspheres
2)制备免疫磁性糊精微球时偶联时间的影响 由图5可知,在偶联时间为0.5~2 h时,随着时间的延长磁性糊精微球的交联率逐渐增加;当偶联时间由2 h到3 h时,交联率有所降低。这是因为抗体是一种具有生物活性的物质,在室温放置过久容易失活。
3)制备免疫磁性糊精微球时偶联温度的影响 从图6可知,偶联温度为5℃时,偶联的磁性糊精微球在偶联率上效果比较差,交联率在35%左右,达不到理想的效果;磁性糊精微球在偶联温度为25℃的免疫磁性糊精微球交联率更高,说明获得的产物性能更优。
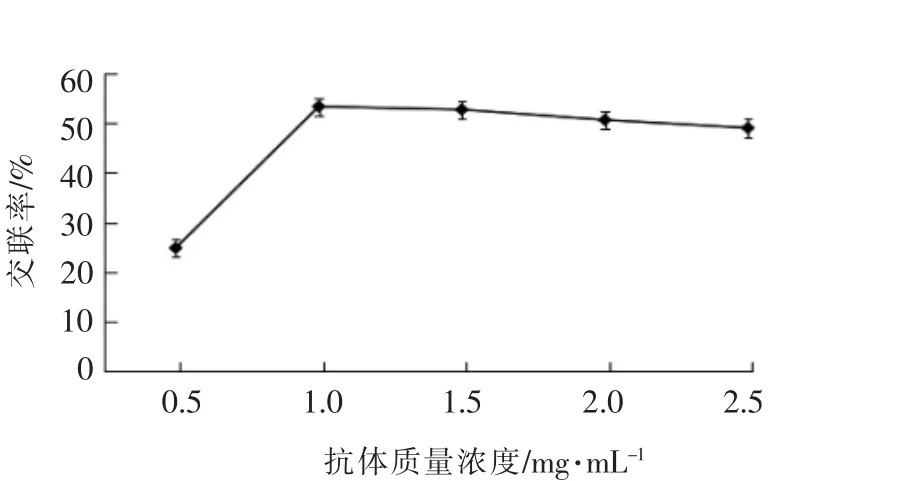
图4 抗体质量浓度对交联率的影响Fig.4 Effect of antibody mass concentrations on the degree of cross linking

图5 偶联时间对交联率的影响Fig.5 Effect of coupling time on the degree of cross linking
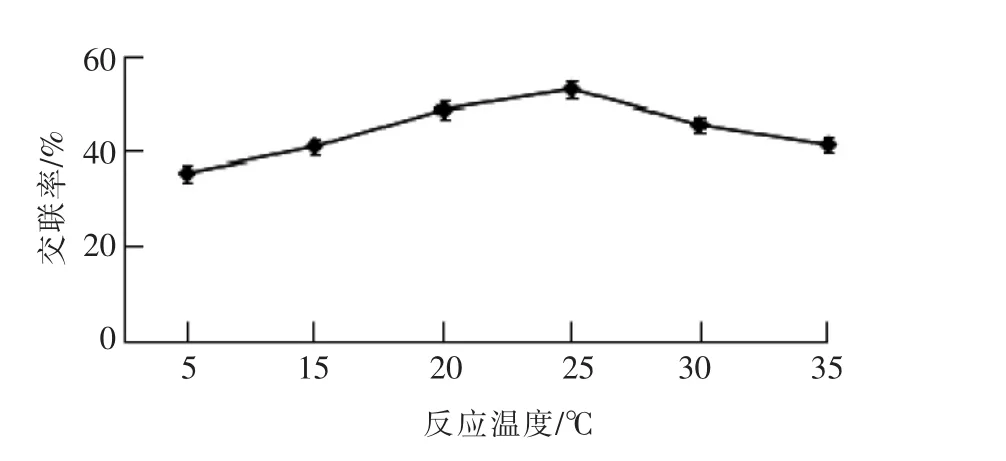
图6 偶联温度对交联率的影响Fig.6 Effect of coupling temperature on the degree of cross linking
3.2.2 正交试验结果 在单因素试验的基础上,确定各因素的最佳用量范围,设计了以抗体质量浓度、偶联时间、偶联温度组成的3因素3水平正交试验。如表2、3所示。
由表3的极差分析可知,抗体浓度对制备免疫磁性糊精微球的影响最大,对其它各因素也有不同程度的影响。考查的3个因素对制备免疫磁性糊精微球的影响大小为:抗体质量浓度>偶联温度>偶联时间。制备免疫磁性糊精微球的较优条件为A2B3C3,即抗体质量浓度为1.0mg/mL,偶联温度为28℃,偶联时间为2.5 h。正交分析与试验结果并不一致,需进一步验证,2组试验对比后可知,制备免疫磁性糊精微球的最优条件是抗体质量浓度为1.0mg/mL,偶联温度为28℃,偶联时间为2.5 h。
由表4的方差分析可知,抗体质量浓度对制备免疫磁性糊精微球的影响显著,偶联时间和偶联温度对制备免疫磁性微球的影响不显著。3个因素对制备磁性糊精微球的影响大小依次是:抗体质量浓度、偶联温度、偶联时间。

表2 正交试验的因素和水平Table2 Factors and levels of orthogonal experiment
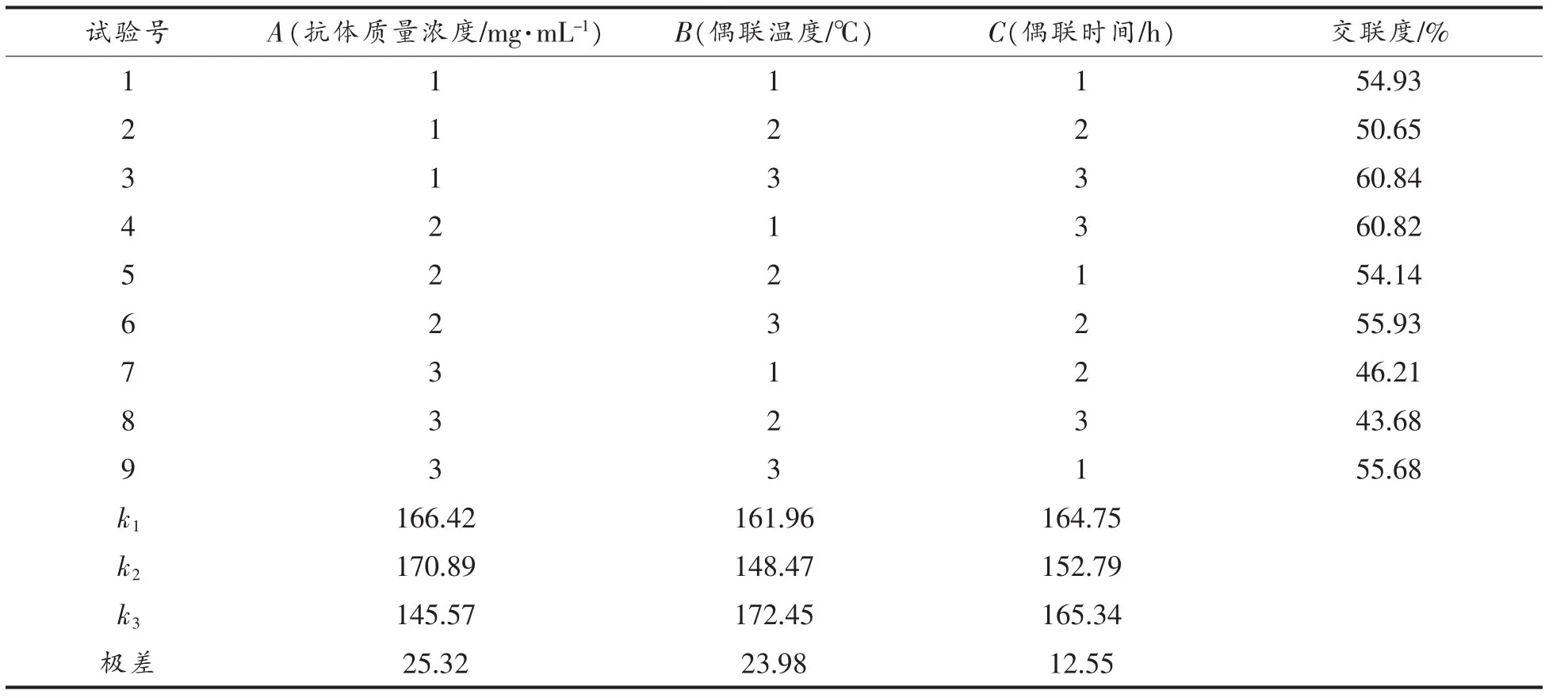
表3 制备免疫磁性糊精微球的正交表L9(33 )与试验结果Table3 Preparation of immunomagnetic starch microspheres orthogonal table L9(33 )and experimental results
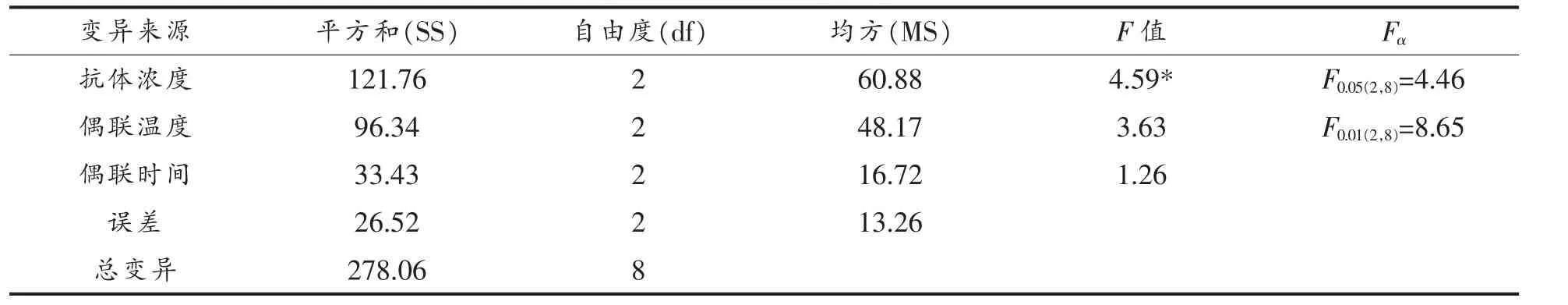
表4 制备免疫磁性糊精微球的正交试验方差分析Table4 Variance analysis of orthogonal test for preparing immunomagnetic dextrin microspheres
3.3 免疫磁性糊精微球捕获单增李斯特菌时各个因素的影响
通过对比捕获后残余菌液涂布平板与原菌液涂布平板所得到的菌落数,进而算出原菌液与捕获后菌液中各自的菌体数,利用捕获率公式:
捕获率=(捕获前菌液菌体数-捕获后菌液菌体数)/捕获前菌液菌体数
得到免疫磁性糊精微球捕获单増李斯特菌的捕获率。
3.3.1 捕获单增李斯特菌时免疫微球用量的影响 如图7所示,在5种菌液浓度下,当免疫磁性糊精微球用量从50μL变为100μL时,免疫磁性糊精微球的捕获率不断增大;继续增大免疫磁性糊精微球的用量直到250μL时,捕获率基本没有变化,免疫磁性糊精微球用量从100μL到250 μL时,对其捕获效率影响很小,后者都较为接近,变化几乎为零。因此确定100μL免疫磁性糊精微球为用于捕获样品中的单增李斯特菌的最佳用量。
3.3.2 免疫磁性糊精微球捕获单增李斯特菌时捕获时间的影响 如图8所示,在3种菌液浓度中,免疫磁性糊精微球捕获时间从0.5 h到1 h时,捕获效率逐渐提高;当捕获时间达到1 h时,免疫磁性糊精微球的捕获效率达到最大值,且继续延长捕获时间,捕获效率几乎不会增加。由于单增李斯特菌在2~42℃的温度环境条件下均可生长,如果捕获时间过长,可能会发生菌落生长的情况,导致计数不准确。此外,本试验目的是开发快速准确、便捷有效的检测方法。从整体考虑的话,选择1 h作为免疫微球捕获的最适时间。
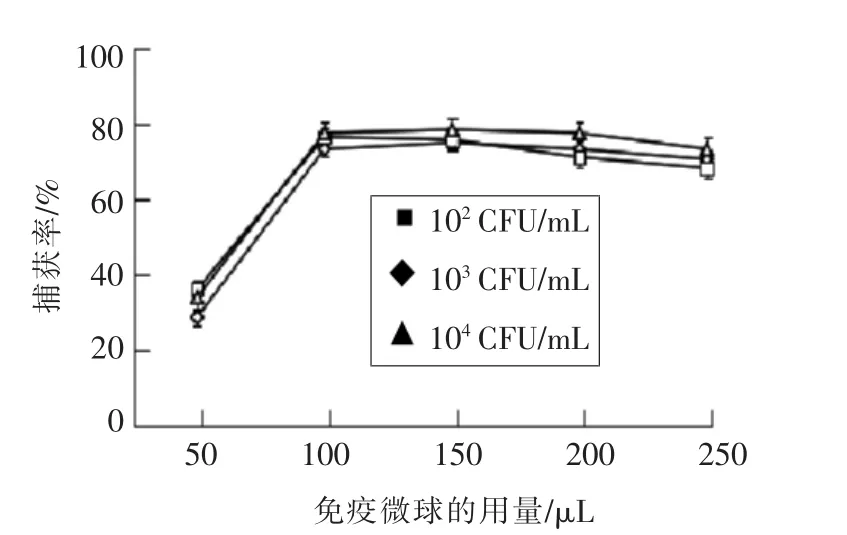
图7 免疫磁性糊精微球用量对不同浓度菌液中捕获效率的影响Fig.7 Effect of adding amount of IMBS on the capture efficiency to various concentrations of Listeria monocytogenes
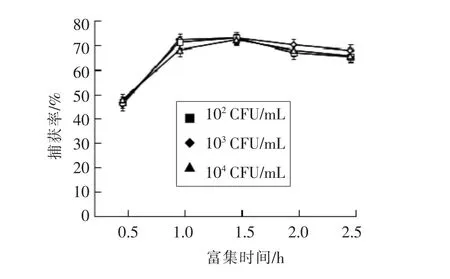
图8 捕获时间对免疫磁性糊精微球在不同浓度菌液中捕获效率的影响Fig.8 Effect of enrichment time on the capture efficiency to various concentrations of Listeria monocytogenes
3.4 DNA提取后琼脂糖凝胶电泳结果
取6个EP管,分别依次加入100μL浓度为101,102,103,104,105,106CFU/mL的单增李斯特菌菌液,每个管分别加入100μL免疫磁性糊精微球,在25℃的恒温振荡培养箱中反应1 h。在外加磁场的作用下,使附着有单增李斯特菌的免疫磁性糊精微球沉淀下来,待沉淀与悬浮液完全分离,按照细菌基因组DNA提取试剂盒说明书上的方法,分别提取沉淀与悬浮液中的DNA。提取后按照2.3.3的方法进行电泳,结果见图9、图10。采用相同的方法,同浓度的沙门氏菌作为对照,结果见图11、图12。
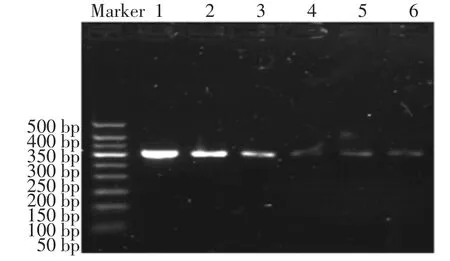
图9 提取沉淀中单增李斯特菌DNA电泳后结果Fig.9 The results of DNA electrophoresis of Listeria monocytogenes in precipitation
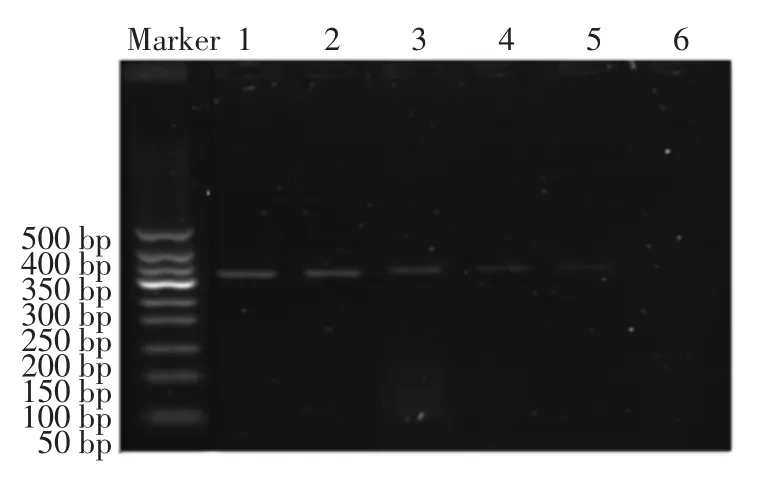
图10 提取上清液中单增李斯特菌DNA电泳后结果Fig.10 The results of DNA electrophoresis of Listeria monocytogenes in supernatant

图11 提取沙门氏菌沉淀中的DNA电泳后结果Fig.11 Extract the results of DNA electrophoresis after precipitation in Salmonella
由图9可知,随着菌液浓度的递减,条带亮度逐渐减弱,免疫磁性糊精微球能够有效与单增李斯特菌结合。从图10可以看出,上清液中还残留有一些单增李斯特菌没有被特异性结合,对比图9、图10可以看出,绝大部分的李斯特菌都被有效快速结合。图11和图12表示采用同种方法、同种浓度的沙门氏菌的电泳结果。从图11可以看出,免疫磁性糊精微球具有很好的特异性,只能特异性结合单增李斯特菌,而不能结合沙门氏菌;从图12可知沙门氏菌全部留在了上清液中。
3.5 PCR扩增后琼脂糖凝胶电泳结果
按照2.3.2的方法提取单增李斯特菌的DNA,以提取DNA作为模版,依照2.3.4的PCR扩增体系反应,用扩增产物进行琼脂糖凝胶电泳,成像并拍照,如图13所示。
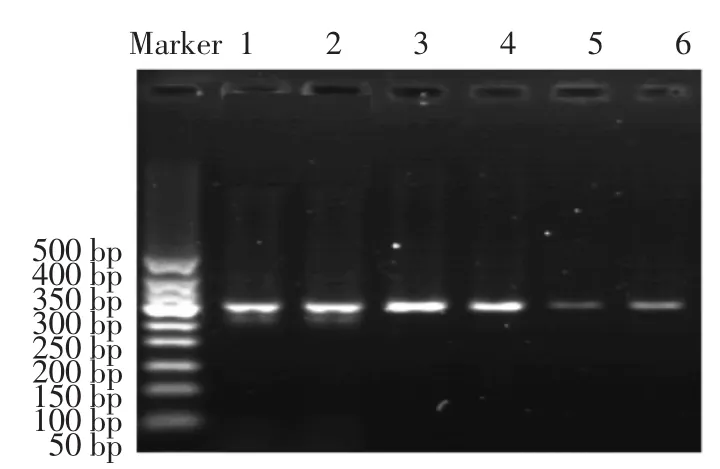
图13 提取沉淀中DNA扩增后电泳结果Fig.13 Extraction of DNA in the precipitate after electrophoresis results
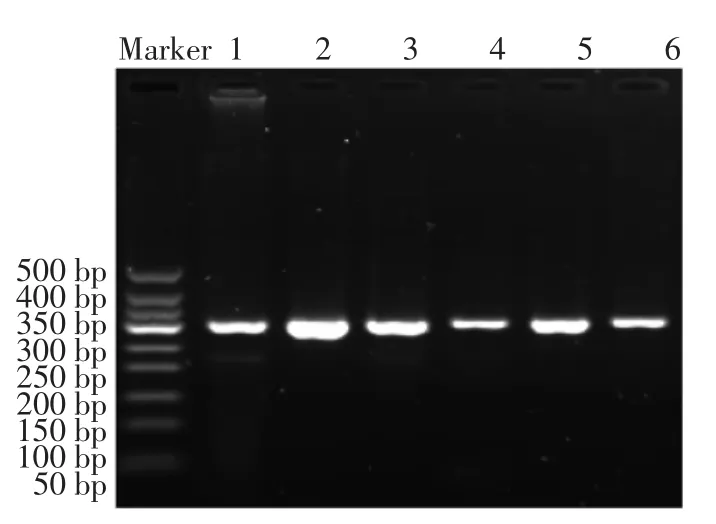
图12 提取沙门氏菌上清液中的DNA电泳后结果Fig.12 Extraction of Salmonella supernatant after DNA electrophoresis results
免疫磁性糊精微球能够捕获单增李斯特菌,并扩增出特异性产物,对比图9看出,扩增后的产物明显增多,说明此免疫磁性糊精微球可以快速、有效检测单增李斯特菌,特异性良好,检出限可以达到每mL菌液中10个单增李斯特菌。
4 结论
研究表明,在制备免疫磁性糊精微球之前,先需要活化磁性糊精微球,在此过程中,活化反应的最佳条件:环氧氯丙烷的用量0.4mL/g,NaOH浓度2.0mol/L,反应的最佳时间5 h。在此基础上,才能更好的交联抗体,制备出免疫磁性糊精微球,在制备过程中,抗体质量浓度、反应温度、反应时间这3个因素都对制备免疫磁性糊精微球产生了影响。随着抗体质量浓度的增加,微球与抗体的交联率逐渐增大,随着反应温度升高,反应时间延长,微球与抗体的交联率先增大后减小。正交试验结果表明,抗体质量浓度对制备免疫磁性糊精微球影响显著,反应时间和反应温度对制备免疫磁性微球的影响不显著,3个因素对制备磁性糊精微球的影响大小依次是:抗体质量浓度、反应温度、反应时间。同时得到了制备免疫磁性糊精微球的最优合成条件为抗体质量浓度1.0mg/mL,反应温度28℃,反应时间2.5 h。用制备好的免疫磁性糊精微球捕获单増李斯特菌时,免疫磁性糊精微球用于样品中的最佳用量为100μL;最佳的捕获时间为1 h。采用最优方案制备出的免疫磁性糊精微球可以快速、有效捕获单增李斯特菌,并能扩增出特异性产物,检出限可以达到每mL菌液中10个单增李斯特菌。
