蜡样芽孢杆菌高产新型中性蛋白酶发酵条件的优化
2020-01-16于平吴赟婷杨柳贞胡淳玉易明花
于平 吴赟婷 杨柳贞 贺 敏 胡淳玉 刘 航 易明花
(浙江工商大学食品与生物工程学院 杭州 310035)
中性蛋白酶是一类能够在中性和弱酸或弱碱性环境中催化蛋白质水解产生游离氨基酸和多肽片段的酶的总称[1],其作用最适pH值在6.0~7.5之间,分子质量为35 000~40 000 u,等电点为8.0~9.0[2]。中性蛋白酶是人类最早应用于工业化生产的蛋白酶制剂之一[3],由于其作用条件温和,催化速率高[4],在食品工业[5-7]、医药工业[8-10]、纺织业[11-13]、饲料工业[14-15]、化妆品行业[16-17]、洗涤行业[18-19]和废弃物处理[20]中得到广泛应用。
综合近十年国内外对中性蛋白酶的研究报道,可以看出我国对中性蛋白酶的研究仍处于初级水平,目前所研究的中性蛋白酶大多由陆生微生物发酵生产,对其研究仍主要集中在高产菌株的选育和发酵条件的优化上[21-22],如孙春华等[23]研究经紫外诱变和培养条件优化,使米曲霉产中性蛋白酶的活力比优化前提高了1.29倍。马宏颖等[24]以枯草芽孢杆菌N19为出发菌株,利用物理和化学复合诱变的方法,使中性蛋白酶的酶活力提高了1.72倍。国外对中性蛋白酶的研究主要集中在分离纯化和性质方面[25-26],如Ruf等[27]研究了抑制剂对细菌胞外蛋白酶的影响,Hamin等[28]研究了嗜热菌产生的中性蛋白酶的特异性和生化特性等。
在前期研究中,课题组从土壤中筛选了一株能够产新型中性蛋白酶的蜡样芽孢杆菌,该菌株所产的中性蛋白酶具有良好的耐热性,应用前景广阔。本文主要通过Plackett-Burman试验设计和响应面分析法对所筛选的蜡样芽孢杆菌高产新型中性蛋白酶的发酵条件进行优化,旨在进一步提高该菌株产中性蛋白酶的活力,从而为其产业化生产和应用奠定良好基础。
1 材料与方法
1.1 材料与试剂
蜡样芽孢杆菌:由课题组成员从土壤中经过反复初筛和复筛分离得到。该菌株能够产耐热性新型中性蛋白酶。经生理生化和分子生物学鉴定后,确定该菌株为蜡样芽胞杆菌。
葡萄糖、蛋白胨、酪蛋白、Tween-80、氯化钠、硫酸镁、盐酸和氢氧化钠等,国药化学试剂公司;Folin-酚试剂、三氯醋酸等,上海生工生物工程有限公司;其它试剂均为分析纯级。
1.2 仪器与设备
立式全自动高压灭菌锅,上海博迅实业有限公司;SKY-200B恒温摇床,上海苏坤实业有限公司;2K15型高速低温冷冻离心机,德国Sigma公司;CHB-100恒温水槽,杭州博日科技有限公司;UV-3200PC紫外分光光度计,美国Mapada公司。
1.3 试验方法
1.3.1 Plackett-Burman试验设计 在前期研究的基础上,初步确定了蜡样芽孢杆菌所产中性蛋白酶发酵培养基的组分和发酵条件。在该试验中,拟通过Plackett-Burman试验设计筛选出影响蜡样芽孢杆菌发酵生产中性蛋白酶的关键因子。利用Design-Expert 8.0软件进行 n=12的Plackett-Burman试验设计,每个因素取高低两水平,每组试验设计3个平行,以减少试验误差。Plackett-Burman试验设计的各因素与水平如表1所示。
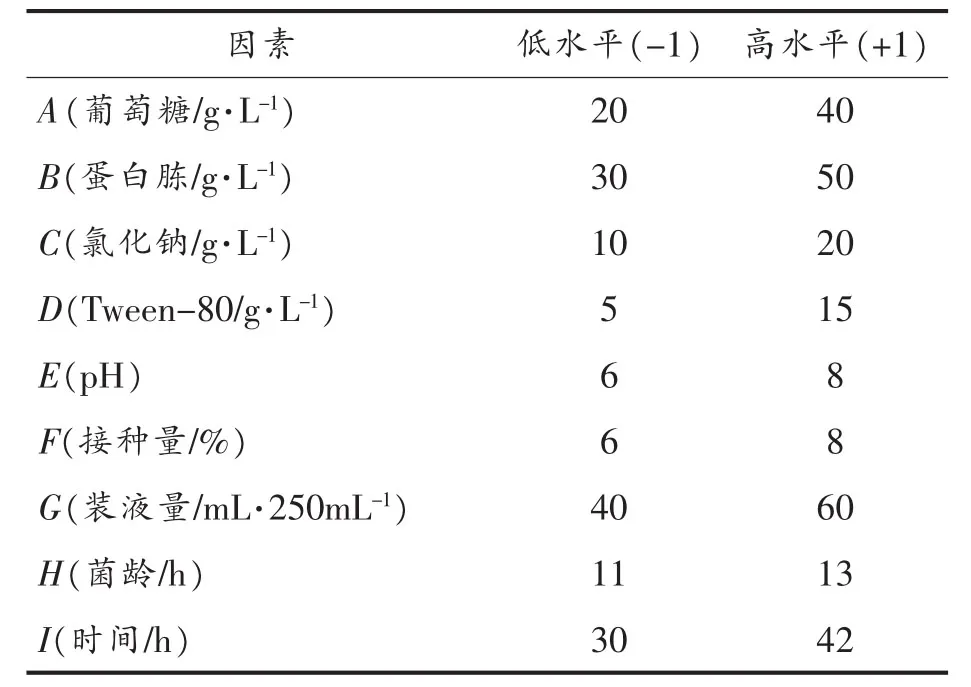
表1 Plackett-Burman试验设计的因素与水平Table1 Factors and coded values of the Plackett-Burman design
1.3.2 响应面分析 以筛选出的3个具有显著影响的因子作为响应面设计的自变量,中性蛋白酶的酶活力作为响应值,建立3因素3水平的Box-Behnken响应面试验模型。其中析因点12个,用于误差分析的零点5个,共17个试验点。每个试验点设置3个平行试验以减少试验误差。Box-Behnken试验设计的各因素和水平如表2所示。
1.3.3 1L摇瓶中蜡样芽胞杆菌发酵生产中性蛋白酶的过程分析 按照响应面设计取得的最佳培养基组分和培养条件,在1 L摇瓶中进行蜡样芽胞杆菌发酵生产中性蛋白酶的过程试验。将200μL甘油管保存的菌种接种到装有50mL Luria-Bertani(LB)培养基的250mL摇瓶中,于37℃,250 r/min条件下振荡培养24 h,培养液即为种子液。按5%的接种量将种子液接种到装有600mL优化培养基的1 L摇瓶中,于37℃,250 r/min进行中性蛋白酶的发酵试验,每隔12 h取样,测定发酵液中中性蛋白酶的酶活力,得到蜡样芽胞杆菌发酵生产中性蛋白酶的过程曲线。

表2 Box-Behnken试验设计的各因素及其水平Table2 Factors and coded values of the Box-Behnken design
1.4 中性蛋白酶酶活力的测定方法
1.4.1 酪氨酸标准曲线的制作 1mL浓度梯度的酪氨酸标准液,加入5mL浓度0.4mol/L的碳酸钠溶液、1mL福林试剂后,于40℃水浴中显色15min,取出后用冷水冷却至室温,在680 nm波长下测定其吸光度值。
1.4.2 中性蛋白酶酶活力的测定 参照国家标准GB/T23527-2009测定,具体如下:1mL稀释后的酶液与1mL 1%的酪蛋白溶液混合,40℃水浴中反应10 min后,加入2mL 0.4mol/L的三氯乙酸(TCA)以终止反应,静置过滤;空白对照加样顺序为酶液-TCA-酪蛋白。取1mL反应后的上清液,加入0.4mol/L的碳酸钠溶液5mL、福林试剂 1 mL,置于40℃水浴中显色20min后取出,冷水冷却至室温,在680 nm波长下测定反应液的吸光度值。以酶液在40℃、pH 7.0的条件下水解酪蛋白,每分钟释放1μg酪氨酸所需的酶量定义为一个酶活力单位。
中性蛋白酶活力(U/mL)=(A样品-B对照)×K×V/T×N
式中,A样品——样品液的吸光度值;B对照——对照液的吸光度值;K——标准曲线上A=1时,对应的酪氨酸的质量(μg);V——酶促反应液的体积(本试验为4mL);T——酶促反应时间(本试验为15min);N——酶液的稀释倍数。
1.5 数据分析
2 结果与分析
2.1 酪氨酸标准曲线的制作
以酪氨酸标准品的浓度为横坐标,A680为纵坐标,绘制酪氨酸标准曲线,如图1所示。对试验结果进行回归模拟,得到一次线性方程:y=0.0103x+0.002。该方程的R2=0.999,说明线性关系好,可用作酪氨酸标准曲线。
2.2 Plackett-Burman试验设计与结果

图1 酪氨酸标准曲线Fig.1 Standard curve of tyrosine
使用Design-Expert 8.0进行试验设计,筛选对蜡样芽孢杆菌高产中性蛋白酶酶活力具有显著影响的关键因子,试验结果如表3所示。
利用Design-Expert 8.0软件对表3中的试验数据进行方差分析,结果如表4所示。

表3 Placket-Burman试验设计与结果Table3 Experimental design and results of the Placket-Burman

表4 Plackett-Burman试验方差分析Table4 Anova for the Plackett-Burman design

(续表4)
由表4可知,葡萄糖、蛋白胨、pH值、装液量和时间这5个因子进行F检验后,所得的P值都小于显著性检验水平0.05,说明它们对酶活的影响显著,其中葡萄糖和蛋白胨的影响最为显著(P<0.01),pH值、时间及装液量的影响显著(P<0.05),其它因子影响不显著(P>0.05)。由于葡萄糖、蛋白胨和pH值是影响中性蛋白酶酶活力的主要因子,且在实际优化操作中容易控制,因此选择这3个因子进行下一步优化试验。
2.3 Box-Behnken试验设计与结果
Box-Behnken试验设计的结果如表5所示。
对表5中的试验数据进行多元回归分析,得到实际形式的二次回归模型:Y=697.43+5.22A+2.15B+1.62C-0.23AB-0.71AC-2.46BC-6.77A2-6.24B2-5.85C2,其中Y为中性蛋白酶的酶活力。
对此二次多项回归方程进行方差分析,结果见表6。从表6可以看出,回归方程因变量和自变量之间的线性关系显著(R2=0.9883)。回归方程系数的显著性检验见表7。
由表7可知,该模型的F值为81.1,P值小于0.0001,表明该模型在0.05的水平上足够拟合试验数据,即该模型能够解释试验数据的变化趋势。在此模型中,A,B,C,BC,A2,B2和C2对蜡样芽孢杆菌高产中性蛋白酶的酶活力有显著影响。
该模型失拟项的P=0.0535>0.05,说明失拟项不显著,试验模型可信度高,可以用此模型对实际值进行预测和分析。复相关系数的平方R2=0.9883,说明该回归方程的自变量和因变量间的函数关系显著。模型校正系数=0.9783,说明该模型能解释97.83%的酶活变化。本试验设计中信噪比=24.721>4,说明试验精确度高。预测决定系数0.8719与校正决定系数0.9783接近,说明试验预测值在可信区间内。综上分析可知:该模型与实际情况拟合较好,可用于预测蜡样芽孢杆菌发酵生产中性蛋白酶的酶活力变化情况。

表6 方差分析表Table6 Analysis of variance

表7 回归方程系数显著性检验表Table7 Significance test of the regression equation coefficient
2.4 3因素间相互作用的三维立体图和等高线图分析
通过多元回归方程分析可知葡萄糖、蛋白胨和pH值这3个因素及其交互作用对中性蛋白酶酶活力的影响情况。该影响可用响应曲面和等高线图表示。图2、图3和图4分别表示葡萄糖与蛋白胨、葡萄糖与pH值以及蛋白胨与pH值这3组因素之间的相互作用,对蜡样芽孢杆菌发酵生产中性蛋白酶酶活力的影响情况。
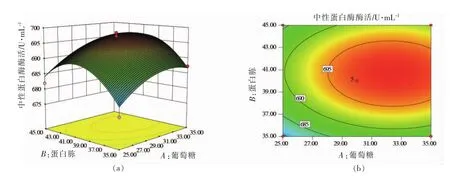
图2 葡萄糖和蛋白胨对中性蛋白酶酶活力影响的响应曲面和等高线图Fig.2 Response surface plot and contour plot showing the effect of glucose and peptone on the activity of neutral protease

图3 葡萄糖和pH对中性蛋白酶酶活力影响的响应曲面和等高线图Fig.3 Response surface plot and contour plot showing the effect of glucose and pH on the activity of neutral protease

图4 蛋白胨和pH对中性蛋白酶酶活力影响的响应曲面和等高线图Fig.4 Response surface plot and contour plot showing the effect of peptone and pH on the activity of neutral protease
等高线图可直观地反映各因素间的交互作用对响应值的影响,以便找出最佳工艺参数。等高线的形状为椭圆形,表示两因素间的交互作用显著,而越接近圆形,则表明两因素间的交互作用越不显著;并且在同一条线上,所有的试验方案都可以得到相同数值的响应值。
图2显示了葡萄糖和蛋白胨浓度对中性蛋白酶酶活力的交互影响。从其等高线图可以直观地看出,等高线呈圆形,说明葡萄糖与蛋白胨的交互作用不显著。从响应面三维立体图可以看出,当葡萄糖浓度一定时,随着蛋白胨浓度的升高,中性蛋白酶的酶活力呈现先增高后降低的趋势。这可能是因为当蛋白胨浓度过高时,影响了发酵液的通透性,使得发酵液底部供氧不足,引起部分蜡状芽孢杆菌死亡,从而使得其产酶能力下降。随着葡萄糖浓度的增加,蛋白胨浓度的高低两水平都能达到相同的酶活;而随着蛋白胨浓度的增加,为达到相同水平的酶活,葡萄糖浓度呈现先减少后增加的趋势。
图3显示了葡萄糖与pH值对中性蛋白酶酶活力的交互影响。从其等高线图可以直观地看出,等高线呈圆形,说明葡萄糖与pH值的交互作用不显著。从响应面三维立体图形可以看出,随着葡萄糖浓度的增加,为达到相同的酶活,pH值的变化呈现高、低两水平,低水平的pH值呈现先减少后增加的趋势,而高水平的pH值呈现不断增大的趋势;而随着pH值得增加,为达到相同的酶活,葡萄糖浓度呈现先减少后增加的趋势。
图4显示了蛋白胨与pH值对中性蛋白酶酶活力的交互影响。从其等高线图可以直观地看出,等高线呈椭圆形,说明蛋白胨与pH值对中性蛋白酶酶活力影响的交互作用显著。从响应面三维立体图形可以看出,随着蛋白胨浓度的增加,为达到相同的酶活,pH值呈现高、低两水平变化,低水平pH值呈现先减少后增加的趋势,而高水平pH值呈现先增加后减少的趋势;而随着pH值的增加,为达到相同的酶活,蛋白胨浓度呈现先减少后增加的趋势。
基于上述模型,通过Design-Expert 8.0软件对回归方程求极值,得出3个显著影响因子的最佳值为:葡萄糖质量浓度35 g/L,蛋白胨质量浓度40.38 g/L和pH 7.15。在上述条件下预测的中性蛋白酶酶活力最大值为697.3U/mL。
2.5 验证试验
在获得最佳发酵条件下进行3次平行试验,以观察中性蛋白酶酶活力的预测值和试验值的接近程度,试验结果如表8所示。

表8 验证试验结果Table8 Result of the verification experiment
由表8可知,3次试验获得的中性蛋白酶酶活力的平均值为696.6 U/mL,实际值与理论预测值接近,说明上述模型能较好地反映出蜡样芽胞杆菌发酵合成中性蛋白酶的实际情况。
2.6 1 L摇瓶中发酵试验结果
1 L摇瓶中的发酵试验结果如图5所示。

图5 1L摇瓶中蜡样芽孢杆菌发酵生产中性蛋白酶的时间过程Fig.5 Time-course of the neutral protease production by Bacillus cereus in 1 L shake flask
由图5可知,随着发酵时间的延长,中性蛋白酶的酶活力呈现先增加后减少的趋势。中性蛋白酶的酶活力在36 h达到最大值,为702.21U/mL,此后随着发酵时间的延长,中性蛋白酶的酶活力呈急剧减小的趋势。造成这一现象的原因可能是因为葡萄糖和蛋白胨等营养物耗尽,菌体所需的营养物质供应不足,导致菌体死亡[28]。
3 讨论
本研究首先通过Plackett-Burman试验设计,筛选出影响蜡样芽孢杆菌高产中性蛋白酶酶活力的显著因子:葡萄糖、蛋白胨和pH值。葡萄糖作为碳源,蛋白胨作为氮源,都是微生物生长的必备元素,对微生物代谢过程起着重要作用。pH值不仅可以影响细胞膜表面带电基团的解离及其微观结构,而且还影响营养物的吸收及代谢物的分泌,导致微生物的生长和代谢发生变化,影响菌体对基质的利用,以致影响菌体的生长和产物的合成。
通过一系列优化试验,得到了蜡状芽孢杆菌高产中性蛋白酶的最适培养基组分和培养条件,使得中性蛋白酶的酶活力达到了初始酶活的1.93倍。在1 L摇瓶中,蜡样芽胞杆菌发酵生产中性蛋白酶的酶活力达到了702.21U/mL,取得了较好的试验结果。今后将在以下两个方面继续深入研究:(1)对发酵工艺进一步调控,在发酵罐中采取分阶段控制pH值,分阶段控制温度和分阶段添加辅料等措施,进一步提高中性蛋白酶的酶活力及生产强度;(2)寻找一些能用于中性蛋白酶发酵的工业废弃物作为发酵培养基的组分,进一步降低生产成本。
4 结论
本文在Plackett-Burman试验结果的基础上,筛选出影响中性蛋白酶酶活力的显著因子:葡萄糖、蛋白胨和pH值,并对这3个因子进行了响应面试验设计及分析。通过优化,获得了蜡样芽胞杆菌发酵生产中性蛋白酶的最佳工艺条件:葡萄糖35 g/L,蛋白胨 40.38 g/L,氯化钠 15 g/L,硫酸镁1.5 g/L,Tween-80 10 g/L,装液量 50 mL/250mL,pH 7.15,菌龄 12 h,发酵时间 36 h。在上述条件下,做验证试验和1 L摇瓶中的发酵试验,获得的中性蛋白酶的最高酶活力分别为696.5 U/mL及702.21U/mL。研究结果为中性蛋白酶的产业化生产和应用提供了良好基础。
