川陈皮素通过调节长链非编码RNA LSINCT5影响胰腺癌细胞增殖及其机制
2020-01-16梅佳曾娟王琴李军韩永红
梅佳 曾娟 王琴 李军 韩永红
华中科技大学同济医学院附属武汉中心医院肿瘤科(武汉430024)
胰腺癌是一种恶性程度高、预后极差的肿瘤,其发病率在全世界范围内逐年上升。近20年来,胰腺癌的发病率在我国增加了6倍,严重危害人民的健康和生存质量[1]。对于胰腺癌的治疗,手术、放化疗仍是主要手段。但是化疗药物毒副作用较大,并且易产生耐药性。即使胰腺癌患者接受各种途径治疗后,其整体的预后水平并不理想,总体5年生存率只有3%[2-3]。因此,医学研究人员亟待寻找疗效好、毒副作用小的药物[4],缓解患者的痛苦。研究报道多种中药成分具有抗肿瘤作用,且毒副作用小,已经成为肿瘤的主要辅助治疗途径之一。
川陈皮素是陈皮的有效成分之一,为多甲氧基黄酮类化合物中的一种,在柑橘属植物果皮中的含量较为丰富,具有较高的生物利用度和渗透性。研究报道川陈皮素具有多种药理学活性,包括抗肿瘤、抗炎、抗氧化等[5-10]。川陈皮素对肝癌、结肠癌、肺癌、胃癌等多种肿瘤细胞具有选择性的抑制作用。
长链非编码 RNA(long non-coding RNA,LncRNA)是长度超过200个核苷酸的非编码RNA,在调节细胞分化、增殖、凋亡和迁移等生物学过程中发挥重要作用。近期研究表明,LncRNA调控多种关键的促癌基因或抑癌基因的表达,从而影响肿瘤发生发展。除了调节其他基因,LncRNA自身也作为致癌或者抑癌因子,与肿瘤的发生发展密切相关[11-12]。LncRNA是否参与了中药的抗肿瘤过程,尚未见报道。本研究旨在探讨川陈皮素对胰腺癌细胞增殖的抑制作用及其潜在分子机制。
1 方法
1.1 细胞培养胰腺癌细胞株MIAPaCa-2和PANC1及正常胰腺导管上皮细胞株H6C7均购于武汉大学保藏中心。所有细胞株均培养在加入10%胎牛血清、100 IU/mL青霉素和100 μg/mL链霉素的PRMI 1640培养基中,培养条件为37℃、5%CO2。采用二甲基亚砜(DMSO)溶解川陈皮素(上海索莱宝生物科技有限公司)。DMSO作为溶剂,其终浓度不超过0.1%。
1.2 CCK-8采用CCK8检测细胞活力变化。细胞消化后,用完全培养基将细胞浓度调整为3×103/mL,接种于96孔板中。培养48 h后,弃掉培养基,加入CCK8反应试剂,继续孵育2 h。采用酶标仪(美国Biotek公司)检测96孔板每孔在450 nm的吸光度值。
1.3 RT-PCR采用Trizol(美国Invitrogen公司)从癌组织及癌旁组织样品和细胞株中提取总RNA。超微量紫外分光光度计(德国Eppendorf公司)测定总RNA浓度以及纯度。逆转录试剂盒(日本TAKARA公司)以RNA为模板合成cDNA,之后运用SYBR Green RT-PCR试剂盒(日本TAKARA公司)检测LncRNA的表达丰度。
1.4 集落形成实验细胞消化后,完全培养基重新悬浮细胞制成单细胞悬液。按1×103/mL浓度将细胞接种于六孔板上。连续培养14 d后,加入10%的甲醛固定细胞15 min,1.0%的结晶紫染色5 min。空气干燥后进行计数。
1.5 流式细胞术转染si-LSINCT5 48 h后,用遇冷的70%乙醇固定细胞后,50 mg/mL PI对细胞进行染色,流式细胞仪检测每个阶段细胞数量。
1.6 Western BlotRIPA提取细胞的总蛋白,超微量分光光度计测定蛋白浓度后加入Loading Buffer,沸水煮5 min将蛋白变性。每个蛋白样本取40 μg加入SDS-PAGE进行电泳分离。通过电转方式将蛋白转移至PVDF膜上。PVDF膜在含有5%脱脂奶粉的TBST中室温封闭2 h。以1∶1 000比例稀释一抗,4°C下一抗孵育PVDF膜过夜。HRP标记的二抗以1∶3 000稀释后室温孵育PVDF膜2 h后,ECL显影。
1.7 统计学方法实验数据均以表示,采用SPSS 19.0分析软件和单因素方差分析ANOVA方法或非配对t检验对数据进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 LSINCT5在胰腺癌组织和细胞中表达增加采用RT-PCR检测LSINCT5在10对胰腺癌组织及其癌旁组织中LSINCT5的表达情况,LSINCT5在胰腺癌患者肿瘤组织(3.05±0.49)中的表达显著高于其癌旁组织(1.02±0.09)中的表达,差异有统计学意义(P<0.01),见图1A;进一步检测了LSINCT5在胰腺癌细胞株MIAPaCa-2和PANC1及正常胰腺导管上皮细胞株H6C7中的表达水平,结果显示,LSINCT5在MIAPaCa-2(2.19± 0.23)和PANC1(1.81± 0.20)中的表达与H6C7(1.03± 0.09)相比显著上调,差异有统计学意义(分别为P<0.01,P< 0.05),见图1B。
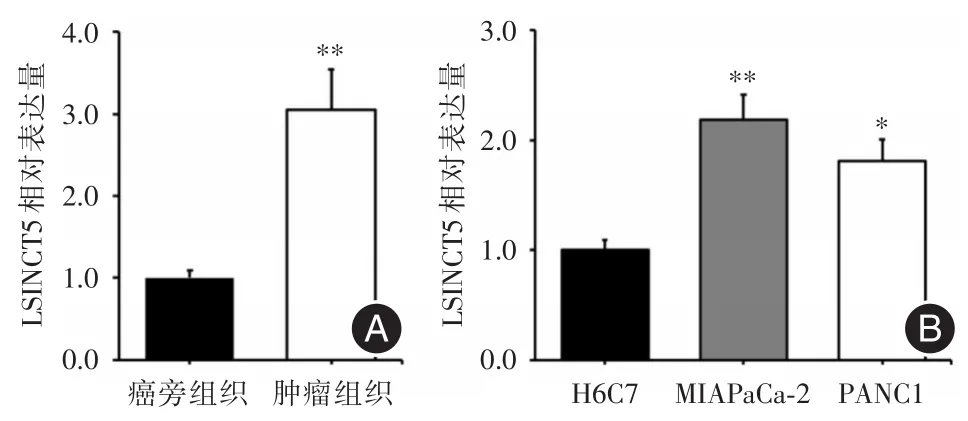
图1 LSINCT5在胰腺癌组织和癌旁组织(A)及细胞株(B)中表达Fig.1 Expression of LSINCT5 in pancreatic cancer tissues and adjacent tissues(A)and cell lines(B)
2.2 川陈皮素对胰腺癌细胞增殖能力的影响观察川陈皮素对胰腺癌细胞增殖的影响,运用CCK-8法检测川陈皮素不同浓度(40、80、160、320 μmol/L)对胰腺癌细胞株MIAPaCa-2和PANC1干预后,MIAPaCa-2增殖能力分别为(82.41±9.13)、(63.32±7.72)、(33.34 ± 4.12),(17.13 ±1.64),空白组为(99.92±9.41);PANC1增殖能力分别为(77.14±8.91)、(59.12 ± 7.23)、(39.61 ± 4.54),(16.12 ± 1.93),空白组为(99.75±9.22),川陈皮素分别作用MIAPaCa-2和PANC1细胞48 h后,与空白对照组相比,两组胰腺癌细胞株活力均受到不同程度的抑制(图2A、图2B)。川陈皮素的浓度为160 μmol/L时,对两种细胞株的活力抑制作用超过40%,因此,选择浓度为160 μmol/L的川陈皮素进行后续研究。
2.3 微阵列芯片筛选川陈皮素干预后,细胞中表达差异最大的LncRNA采用微阵列芯片分析川陈皮素干预胰腺癌细胞株后,细胞内LncRNAs的表达谱变化情况。结果如图3A所示,在MIAPaCa-2胰腺癌细胞中加入160 μmol/L川陈皮素处理48 h后,21个LncRNA表达上调(表达差异>2倍),19个LncRNA表达下调(表达差异>2倍),见图3B。其中,LncRNA LSINCT5表达下调的变化最为明显。接下来采用RT-PCR对微阵列芯片的结果进行进一步验证,结果显示160 μmol/L川陈皮素分别干预MIAPaCa-2和PANC1细胞48 h后,MIAPaCa-2和PANC1中LSINCT5表达分别为(0.42±0.06)、(0.32±0.05),与未加药组(0.99±0.09)相比,差异具有统计学意义(P<0.01),见图3C。结果提示在川陈皮素的作用下,LSINCT5表达明显下调,有可能作为致癌调节因子参与调节胰腺癌的细胞生物学功能。
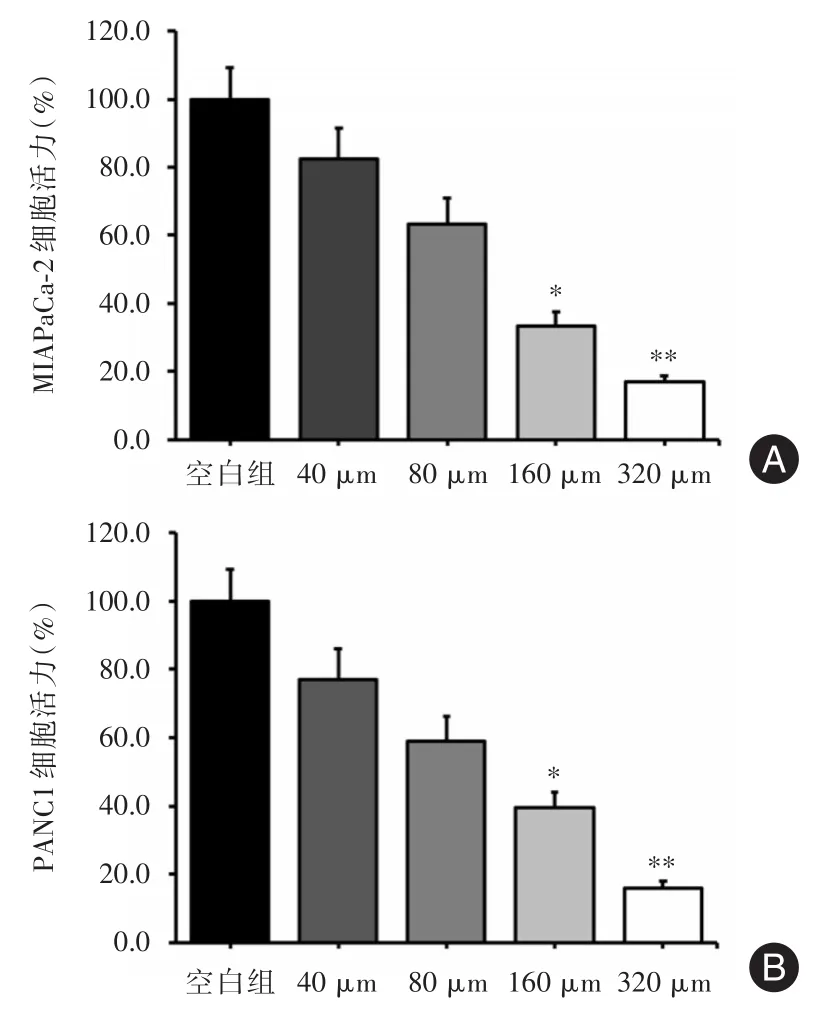
图2 川陈皮素对胰腺癌细胞株MIAPaCa-2(A)和PANC1(B)活力的影响Fig.2 Effects of nobiletin on the activity of pancreatic cancer cell line MIAPaCa-2(A)and PANC1(B)
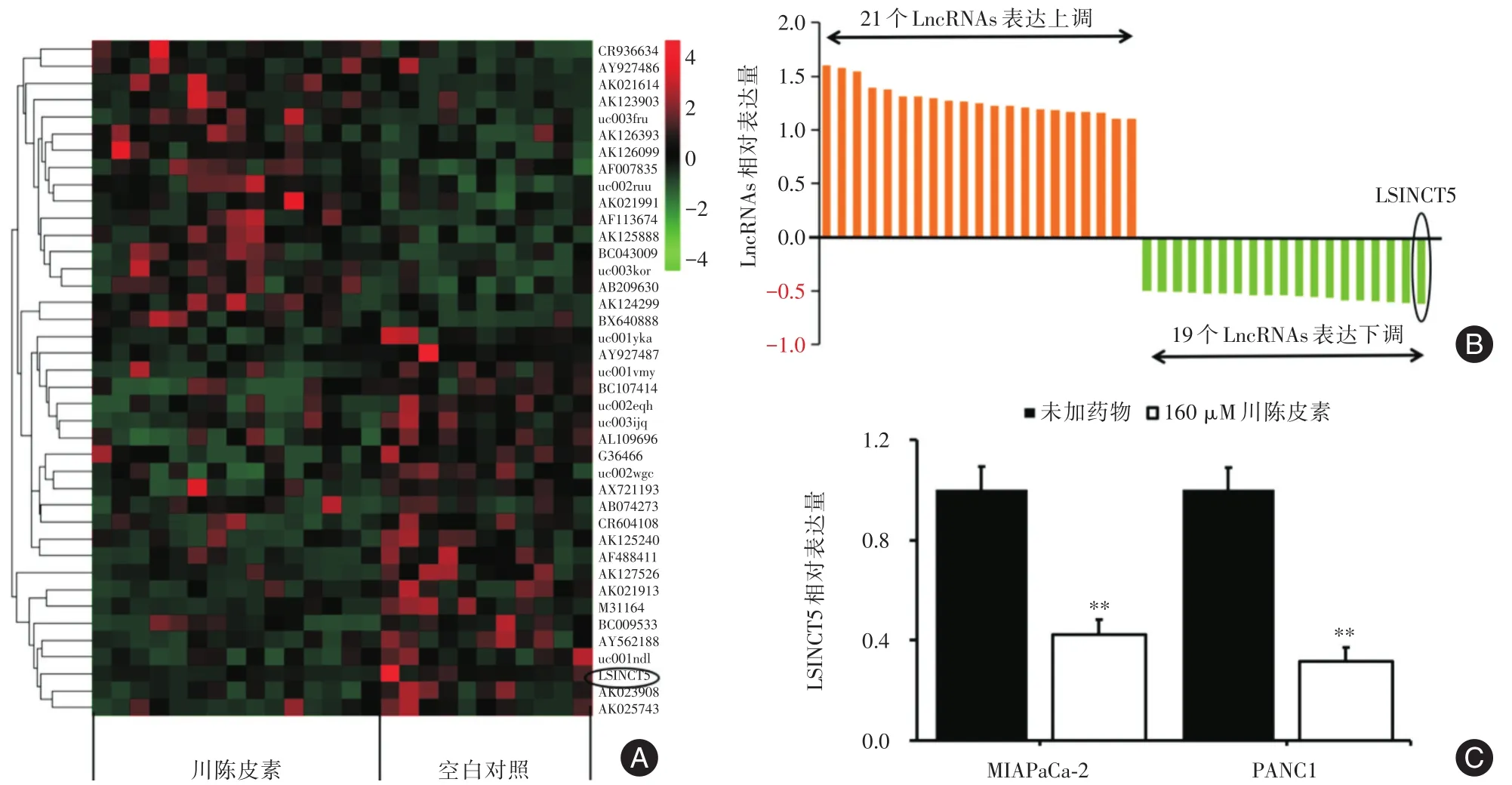
图3 川陈皮素对胰腺癌细胞株中LncRNA表达影响(A和B)和细胞株中(C)LSINCT5表达的影响Fig.3 Effects of nobiletin on LncRNA expression in pancreatic cancer cell lines(A and B)and LSINCT5 expression in cell lines(C)
2.4 LSINCT5促进胰腺癌细胞增殖笔者运用RNA干扰的方法,合成LSINCT5的干扰序列抑制其表达,观察LSINCT5对胰腺癌细胞增殖的影响。CCK-8实验结果如图4A显示,抑制LSINCT5表达后,MIAPaCa-2和PANC1细胞活力显著降低,与对照组si-NC相比,在72 h和96 h时差异有统计学意义(P<0.05,P<0.01)。集落形成实验结果如图4B显示,将si-LSINCT5转染进入MIAPaCa-2和PANC1细胞48 h后,两种胰腺癌细胞株分别为(0.42± 0.06)、(0.32± 0.05)mm2,菌落数量均明显减少,与si-NC组(0.98±0.08)mm2相比较,差异有统计学意义(P<0.01)。
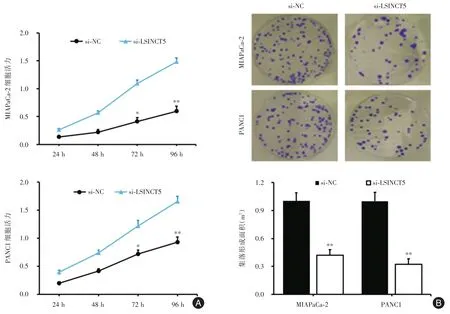
图4 LSINCT5对胰腺癌细胞株增殖能力的影响Fig.4 Effect of LSINCT5 on the proliferation of pancreatic cancer cell lines
2.5 LSINCT5促进胰腺癌细胞周期进展将LSINCT5干扰序列及对应的si-NC序列分别转染进MIAPaCa-2和PANC1细胞株后,提取细胞总RNA后,进行微阵列芯片分析。结果如图5A所示,与si-NC组相比较,转染LSINCT5干扰序列的细胞中,有20个与细胞周期相关的基因表达出现异常(表达差异>2倍)。其中,14个基因表达下调,6个基因表达上调。因此,接下来笔者采用流式细胞术检测LSINCT5对胰腺癌细胞细胞周期进展的影响情况。结果显示,转染LSINCT5干扰序列后,MIAPaCa-2处于G0/G1期细胞数量为(78.11±9.15)%,与si-NC组(58.15±6.19)%比较,差异有统计学意义(P<0.05);PANC1处于G0/G1期细胞数量为(74.19±8.51)%,与si-NC组(55.18±6.22%)比较,差异有统计学意义(P<0.05),见图5B、5C。结果提示,LSINCT5诱导肿瘤细胞增殖可能与其刺激细胞周期进展、促进G1期向S期转移相关。
2.6 LSINCT5调节细胞周期关键因子的蛋白表达水平上述结果提示LSINCT5对肿瘤细胞的细胞周期进展有显著地促进作用,本部分采用Western Blot和RT-PCR的方法检测LSINCT5对细胞周期关键因子Cyclin B1、CyclinE和P21表达影响,明确LSINCT5对细胞周期影响的内在机制。结果如图6显示,将LSINCT5干扰序列转染进入MIAPaCa-2和PANC1细胞48 h后,细胞周期关键因子CyclinB1、CyclinE的mRNA和蛋白表达均显著降低,P21的mRNA和蛋白表达均升高,与si-NC相比较,差异有统计学意义(P<0.05,P<0.01)。结果提示,LSINCT5直接或间接的影响细胞周期相关蛋白的mRNA和蛋白表达,进一步明确了LSINCT5对肿瘤细胞的细胞周期促进作用潜在可能机制。
2.7 川陈皮素抑制胰腺癌细胞增殖与LSINCT5明显相关上述结果提示LSINCT5促进胰腺癌细胞增殖,川陈皮素对胰腺癌细胞增殖有明显的抑制作用,并且胰腺癌细胞经过川陈皮素干预后,LSINCT5的表达降低,下一步探究LSINCT5是否作为关键因素参与川陈皮素的抑瘤作用。结果显示,川陈皮素160 μmol/L干预MIAPaCa-2和PANC1细胞48 h后,si-NC组两种细胞的增殖能力明显受到抑制(图7A),且细胞中LSINCT5表达均显著降低(图7B),与未加川陈皮素干预组比较,差异有统计学意义(P<0.01)。但是川陈皮素干预48 h后,si-LSINCT5组两种细胞的细胞活力没有受到显著抑制(图7C、D),LSINCT5的表达变化也不明显(图7E)。结果表明,抑制LSINCT5表达后,川陈皮素对胰腺癌细胞增殖的抑制作用明显减弱。
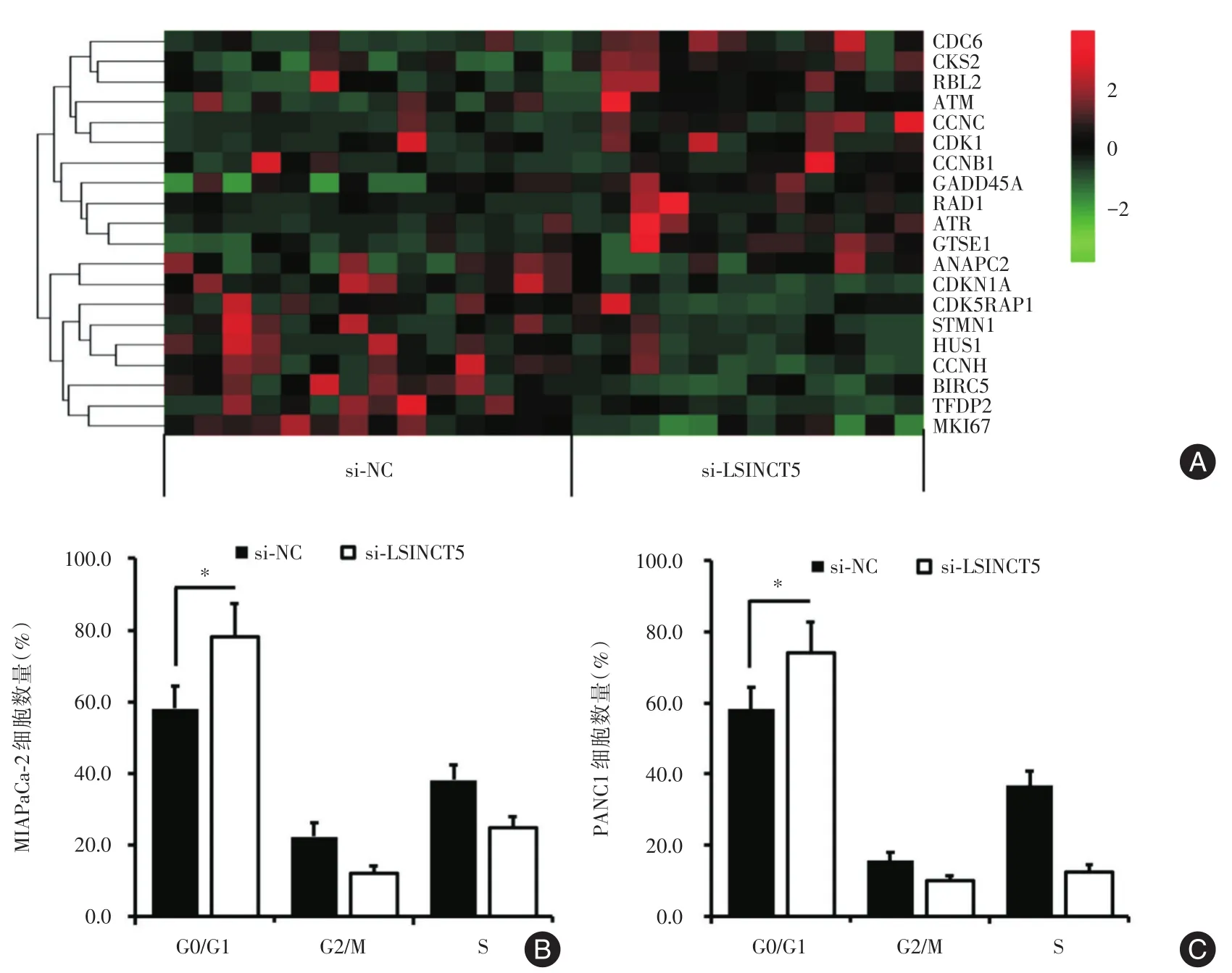
图5 LSINCT5对胰腺癌细胞周期的微阵列芯片分析(A)和细胞株(B和C)细胞周期的影响Fig.5 Effects of LSINCT5 on cell cycle by microarray chip analysis(A)and on pancreatic cancer cell lines and(B and C)
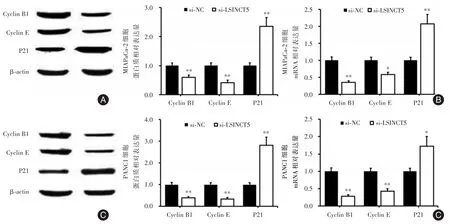
图6 LSINCT5对细胞周期关键因子蛋白质表达(A和C)和mRNA表达(B和D)的影响Fig.6 Effects of LSINCT5 on protein expression levels(A and C)and mRNA expression levels(B and D)of key cell cycle factors
3 讨论
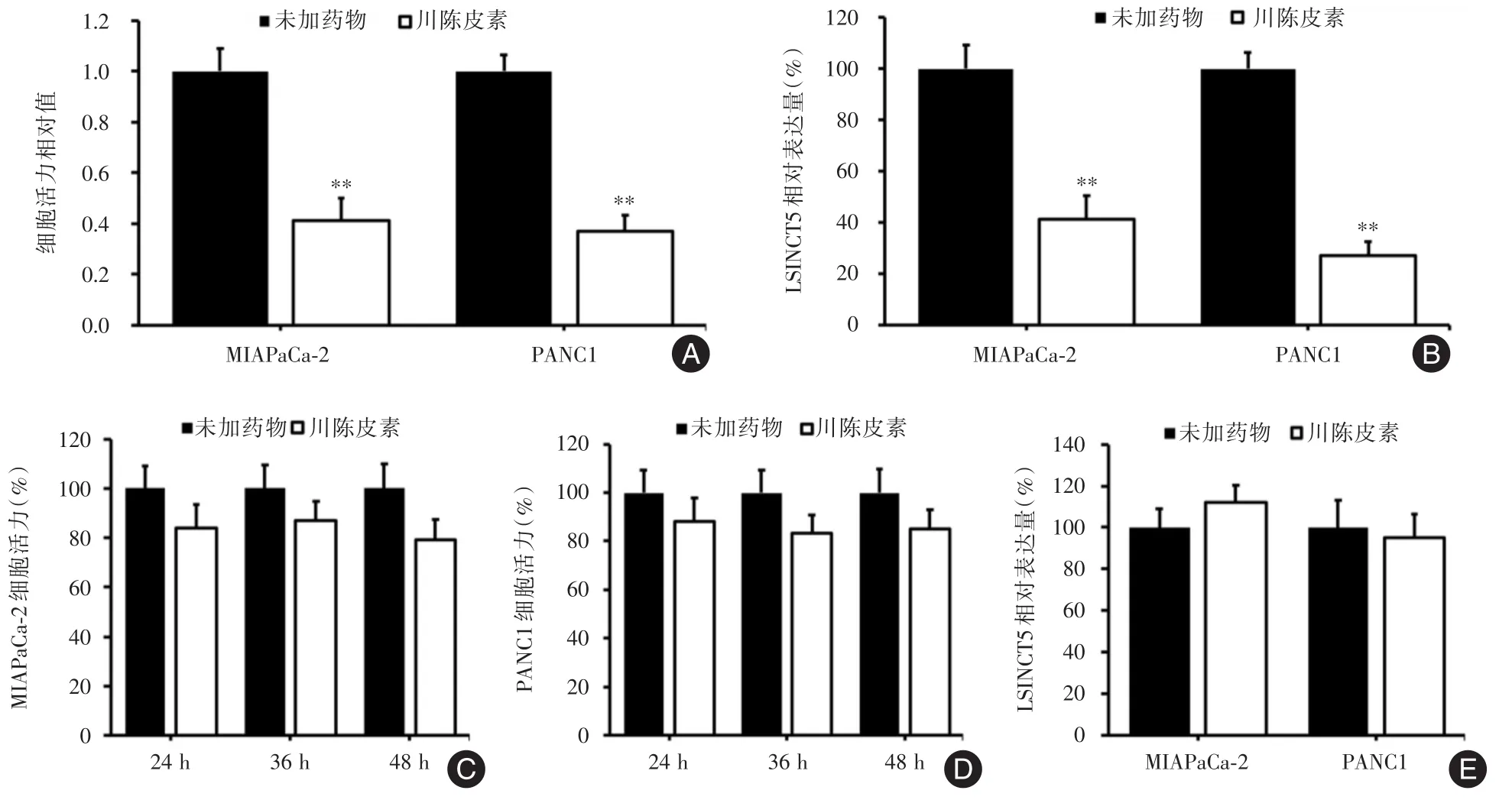
图7 川陈皮素对胰腺癌细胞增殖的影响及与LSINCT5的关系Fig.7 Effect of nobiletin on the proliferation of pancreatic cancer cells and its relationship with LSINCT5
LncRNA对细胞多个环节的生物学过程中所展现的调节功能逐渐受到医学研究者的关注,包括细胞分化、细胞周期、分子支架、DNA甲基化/去甲基化平衡、转录基因沉默等[13-17]。研究[18]显示,LncRNA在不同的肿瘤组织和肿瘤细胞株中表达出现异常,在肿瘤发生发展过程发挥重要作用。本研究发现长链非编码RNA LSINCT5的表达量在正常细胞和胰腺癌细胞中表达量具有显著差异,随后的功能研究揭示LSINCT5能够促进胰腺癌细胞增殖、提升细胞活力、刺激细胞周期进展,在胰腺癌中可能起到促癌因子的作用。与LONG等[19]在乳腺癌和宫颈癌中的研究结论相一致。
LncRNAs在调控抑癌基因或者促癌基因表达中发挥了重要作用,可作为肿瘤诊断、治疗方案选择和预后判断等的重要分子标记物[20]。LncRNAs在中药单体防治癌症过程中是否发挥作用值得探讨。本研究首先采用川陈皮素干预胰腺癌细胞株MIAPaCa-2和PANC1,筛选出最佳的药物作用浓度及表达量变化最明显的长链非编码RNA。微阵列芯片发现川陈皮素干预后,多个LncRNAs的表达发生变化,其中以LSINCT5表达变化最为明显。为了进一步探明LSINCT5在川陈皮素抑制胰腺癌细胞增殖中的作用,笔者加入si-LSINCT5阻断其表达丰度,发现川陈皮素对肿瘤细胞的抑制作用明显降低。因此,笔者推测川陈皮素抑制胰腺癌细胞增殖和LSINCT5明显相关。
由于胰腺癌细胞中LSINCT5在川陈皮素处理后,表达下调最为明显,其潜在机制与细胞生物学功能相关,功能研究表明抑制LSINCT5表达能够明显导致细胞周期阻滞,处于G0/G1期的细胞百分比显著增加。进一步采用Western Blot和RT-PCR检测抑制LSINCT5表达后,细胞周期变化相关基因表达水平变化,发现CyclinB1、CyclinE的mRNA和蛋白质表达均显著降低,P21的mRNA和蛋白质表达均升高。LSINCT5调节胰腺癌细胞增殖机制可能与细胞周期进展有关,涉及到调控G1、S和M期进展关键基因表达水平,与魏等在黑色素瘤中的研究结论相似[21]。
综上所述,本研究首次报道LSINCT5调节胰腺癌细胞多个功能,包括促进细胞增殖、刺激细胞周期进展,LSINCT5可作为重要的促癌调节因子,可能是一个有效的治疗胰腺癌的分子靶点;笔者还发现川陈皮素通过调控LSINCT5表达抑制胰腺癌细胞增殖和细胞活力,进而阻滞细胞周期,发挥抗肿瘤作用;为寻找有效的靶向作用LSINCT5的抑制剂或者天然抗肿瘤中药提供了新思路,为胰腺癌的防治提供新的途径和策略。本研究的不足之处未在体内研究LSINCT5在胰腺癌中的功能,后续笔者将采用实验动物模型进一步验证LSINCT5的功能及川陈皮素抗肿瘤的新机制及途径。
