红豆皮多酚提取工艺优化及抗氧化活性分析
2020-01-15谢佳函刘回民刘美宏郑明珠刘景圣
谢佳函 刘回民 刘美宏 郑明珠 徐 倩 刘景圣 *
(1 吉林农业大学食品科学与工程学院 长春 130118
2 小麦和玉米深加工国家工程试验室 长春 130118
3 吉林农业大学生命科学学院 长春 130118)
现代都市人群因其生活节奏快,工作压力大,饮食不合理,作息不规律,缺乏运动等诸多因素,导致长期情绪不良,机体代谢紊乱,亚健康状态频发。亚健康状态使机体内产生大量过剩的活性氧自由基,造成组织细胞中的脂质、糖类、蛋白质、DNA和RNA等生物大分子发生变形、交联、断裂等现象,从而造成氧化损伤,引发各种疾病[1]。开发天然高效的抗氧化剂不仅对预防和治疗各种自由基引起的疾病具有深远的意义,还能够避免人工合成抗氧化剂产生的毒副作用。
红豆(Vigna angularis)又名赤豆、赤小豆、小豆、红小豆、饭豆等[2],是中国、日本、韩国等亚洲国家最常食用的的杂粮作物之一,常用来做粥、汤以及甜点等。中医认为,红豆的药用价值很高,具有补血补脾、健胃生津、祛湿益气、排脓解毒等多种功效,被李时珍形象地称为“心之谷”[3]。红豆皮是红豆沙加工的副产物,其中含有丰富的多酚类物质[4-5],例如原花青素、芦丁、儿茶素、槲皮素、金丝桃苷等[6]。多酚化合物具有清除机体内自由基,缓解氧化损伤,预防和治疗许多氧化应激相关疾病的功效,例如:阿尔茨海默氏症、慢性疲劳综合症、心脏病、糖尿病、帕金森等[7-10]。以膳食多酚作为原料开发食品和药品,具有来源广泛,安全可靠,功效显著等优势[11]。本研究从红豆皮中提取多酚类物质,不仅能够变废为宝,还能够增加红豆的经济效益,开发利用前景极为广阔。
目前,提取多酚的方法有很多,例如:溶剂浸提法、超声辅助提取、酶解提取法、微波辅助提取、超临界CO2萃取法等[12-14]。本试验采用超声辅助乙醇提取法,考察乙醇体积分数、超声功率、超声时间、料液比对红豆皮多酚提取量的影响,具有时间短,操作简单,提取量高等优点。通过响应面法优化工艺参数,提取的多酚粗提物经大孔树脂纯化后采用HPLC分析单体成分并进行体外抗氧化试验,旨在为开发安全、高效的红豆皮多酚抗氧化剂在食品领域的应用提供技术支撑。
1 材料与方法
1.1 材料与试剂
红豆,小麦和玉米国家工程试验室提供;没食子酸、芦丁、儿茶素、绿原酸、原花青素B2、表儿茶素、阿魏酸、异牡荆素、牡荆素、异鼠李素、金丝桃苷、山奈酚、槲皮素、VC标准品,上海甄准生物科技有限公司;Folin-Ciocalteu显色剂,天津市光复精细化工研究所;大孔树脂,郑州华溢科技新材料股份有限公司;DPPH、ABTS,美国Sigma公司;所用化学试剂均为分析纯级。
1.2 仪器与设备
JY 92-IIN超声波细胞破碎仪(配备φ6变幅杆),宁波新芝生物科技股份有限公司;高速万能粉碎机,北京市永光明医疗仪器有限公司;全自动酶标仪,德国BMG公司;超纯水系统,上海和泰仪器有限公司;101A-1ET电热恒温鼓风干燥箱,上海试验仪器厂有限公司;SHB-Ⅲ 循环水式真空泵,郑州长城科工贸有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;电子分析天平,Sartorious(北京)有限公司;Allegra X-30R高速离心机,美国Beckman公司;2-16 LSC冷冻干燥仪,美国Ghrist公司;1200型高效液相色谱仪,美国Agilent公司。
1.3 试验方法
1.3.1 红豆皮粉的制备 将红豆用蒸馏水快速冲洗3次,在25℃条件下浸泡24 h,手工剥皮,将收集的红豆皮在40℃条件下烘干10 h至质量恒定,用粉碎机将干燥的红豆皮粉碎,过80目筛,备用。
1.3.2 没食子酸标准曲线的绘制 准确称取5 mg没食子酸标准品于5mL双蒸水中,定容至刻度线,配制成1mg/mL的没食子酸标准液,分别稀释得到质量浓度为10,20,30,40,50,60 μg/mL的标准溶液,双蒸水做空白对照。精确吸取上述标准溶液各50μL,依次加入200μL双蒸水和250μL福林酚工作液(1mL FC用8mL双蒸水稀释),室温下避光静置5min,再加入250μL 10%Na2CO3溶液,于30℃水浴锅中避光反应1 h,使用酶标仪在765 nm波长处测定吸光度值。以没食子酸浓度为横坐标,吸光度值为纵坐标绘制标准曲线,求得标准曲线线性回归方程为:y=0.0032x+0.0015,R2=0.9993。
1.3.3 红豆皮多酚含量的测定 准确称取红豆皮粉末2.000 g,置于200mL烧杯中,并按一定液料比加入一定体积分数的乙醇溶液,摇匀。然后在室温条件下,用一定功率的超声波分别处理一定时间,取出后溶液立刻离心20min(4 000 r/min),取上清液,45℃旋转蒸发浓缩样品,蒸馏水定容至50mL。精确吸取已制备好的红豆皮多酚溶液50 μL,测定方法同标准曲线。通过标准曲线方程计算出溶液中多酚的质量浓度(μg/mL),每组做3个平行样。红豆皮多酚提取量按式(1)计算:
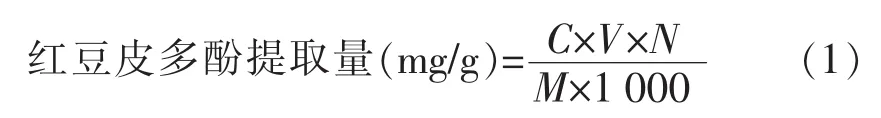
式中,C——红豆皮多酚的质量浓度,mg/mL;V——提取液体积,mL;N——稀释倍数;M——红豆皮粉质量,g。
1.3.4 单因素试验设计 称取红豆皮粉末2.000 g,按照料液比1∶50加入一定体积分数的乙醇溶液,在超声波功率350W条件下超声20min测定红豆皮多酚提取量。固定其它条件,分别考察乙醇体积分数、超声功率、提取时间、料液比对多酚提取量的影响。
1.3.5 响应面试验设计 根据Box-Behnken试验设计原理,以单因素试验为基础,选取乙醇体积分数、超声功率、超声时间、料液比4个因素,采用4因素3水平的响应面分析方法。
1.3.6 纯化 将提取的红豆皮多酚粗品使用AB-8型大孔树脂进行纯化,上样质量浓度为2.5mg/mL红豆皮多酚粗提液,洗脱液是体积分数为70%的乙醇溶液,上样液流速和洗脱液流速均为1.0 mL/min。将纯化后的多酚溶液冷冻干燥,用于HPLC分析和抗氧化活性的检测。
1.3.7 高效液相色谱测定红豆皮多酚单体酚 色谱条件:Zorbox SB-C18 柱(150 mm×4.6 mm,5 μm);柱箱温度:30℃;检测器:DAD,检测波长280 nm。流动相组成:100%甲醇(A)和0.5%冰醋酸(B);流速:1.0mL/min;洗脱梯度见表1。根据样品色谱峰保留时间与标准品保留时间比较,判定单体酚种类。
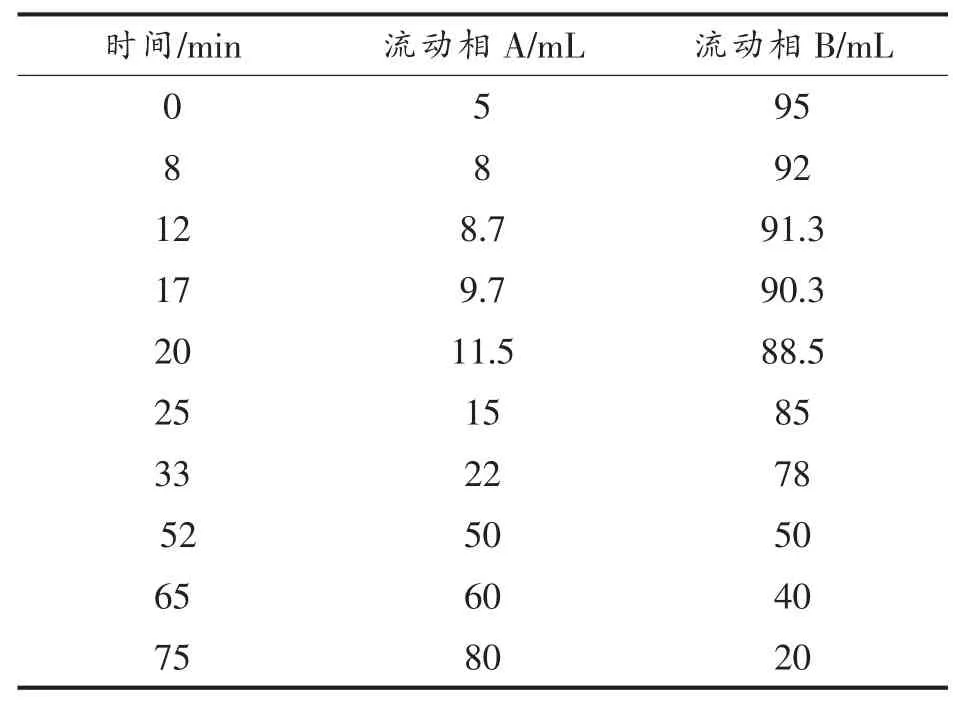
表1 梯度洗脱表Table1 Gradient elution table
1.3.8 抗氧化试验
1.3.8.1 DPPH自由基清除率测定[15]精确配制0.2mmol/L DPPH乙醇溶液,避光放置,现用现配。精确配制不同质量浓度样液按照表2加入试剂后,室温条件下避光放置30min,于517 nm波长处测定吸光度,并按公式(2)计算DPPH自由基清除率。

表2 DPPH自由基清除试验加样表Table2 Sample table for DPPH free radical scavenging test
1.3.8.2 超氧阴离子自由基清除率测定[16]精确配制不同质量浓度样液分别取0.5mL加入1mL 0.05mol/L的Tris-HCl缓冲液(pH 8.2),于25℃水浴10min,再加入50μL预热好的0.01mol/L邻苯三酚溶液,迅速混匀,空白用10mmol/L的HCl溶液代替。于320 nm波长处每30 s测定吸光度1次。邻苯三酚的自氧化速率用吸光度的斜率A0表示,加入样品溶液后的邻苯三酚氧化速率记为A1,并按公式(3)计算超氧阴离子自由基清除率。

1.3.8.3 羟自由基清除率测定[17]精确配制不同质量浓度样液分别取2mL,分别加入2.0mL 8 mmol/L硫酸亚铁溶液、2.0 mL 8mmol/L的水杨酸溶液和2mL 8mmol/L的过氧化氢溶液混匀,于37℃水浴30min,于510 nm波长处测定吸光度记为A1。蒸馏水代替样液的混合液吸光度记为A0,蒸馏水代替水杨酸的混合液吸光度记为A2,并按公式(4)计算羟自由基清除率。

1.3.8.4 ABTS+·自由基清除率测定[18]将 7.4 mmol/L ABTS+·溶液与2.6mmol/L过硫酸钾溶液按体积比1∶1混匀,室温避光静置12 h,用pH 7.4的磷酸缓冲液稀释至在734 nm处吸光度为0.7±0.02,记为A0,精确配制不同质量浓度样液分别取0.2mL与0.8mL ABTS工作液充分混合,避光静置6min,于734 nm波长处测定吸光度记为A1,并按公式(5)计算ABTS自由基清除率。
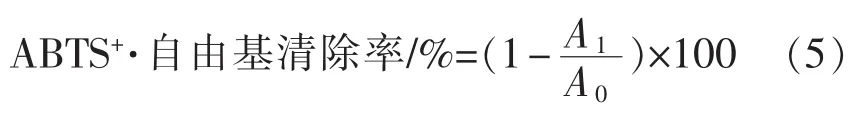
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对红豆皮多酚提取量的影响由图1可知,随着乙醇体积分数的增加,红豆皮多酚的提取量逐渐增大,并在体积分数为60%时达到最大值135.85mg/g,当体积分数大于60%时逐渐降低。这可能是由于水相比例较大时,溶出的水溶性杂质较多,抑制了多酚的溶出。当乙醇体积分数达到60%时,多酚溶出量趋于饱和。当乙醇体积分数达到70%时,会使蛋白质变性,阻止结合酚的溶出,此外,较高的乙醇使脂溶性杂质增多,形成多酚的竞争性抑制剂,导致多酚提取量降低。因此,选择乙醇体积分数为60%。
2.1.2 超声功率对红豆皮多酚提取量的影响 由图2可知,随着超声功率的增大,红豆皮多酚的提取量逐渐增大,并在350W时达到最大值137.77 mg/g。然而当超声功率大于350W时,提取量逐渐下降,这可能是由于过大的超声功率使溶液温度过高,降低了多酚的稳定性,破坏了分子结构,导致提取量降低。因此,选择超声功率为350W。
2.1.3 超声时间对红豆皮多酚提取量的影响 由图3可知,随着超声时间的延长,红豆皮多酚提取量逐渐增大,并在30min时达到最大值143.41 mg/g。当超声时间在30min内时,对细胞的破碎程度更加充分,多酚的提取量也逐渐增大,30min后趋于平稳,这可能是因为红豆皮多酚可能已被基本提取,继续超声导致溶液温度升高,多酚结构被破坏,发生降解。因此,选择超声波时间为30 min。
2.1.4 液料比对红豆皮多酚提取量的影响 由图4可知,在液料比为30∶1~40∶1(mL/g)之间时,红豆皮多酚的提取量逐渐增大,并在40∶1(mL/g)时达到最大值144.59mg/g。随着液料比增大,多酚的提取量逐渐下降,这可能是因为40∶1(mL/g)时多酚类物质已达到饱和,提高液料比反而会促进其它杂质溶出,造成提取溶剂的浪费[19-20]。因此,选择液料比为40∶1(mL/g)。

图1 乙醇体积分数对红豆皮多酚提取量的影响Fig.1 Effect of ethanol concentration on the extraction yield of azuki bean coat polyphenols
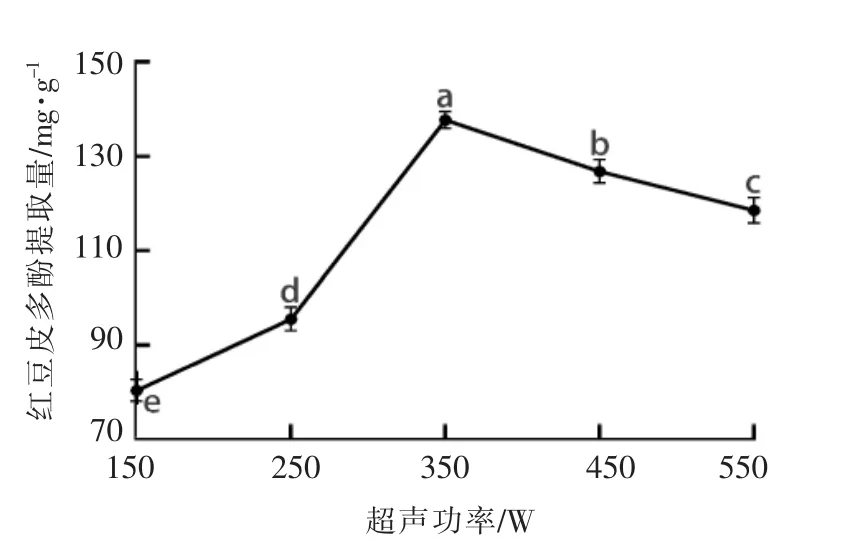
图2 超声功率对红豆皮多酚提取量的影响Fig.2 Effect of ultrasonic power on the extraction yield of azuki bean coat polyphenols
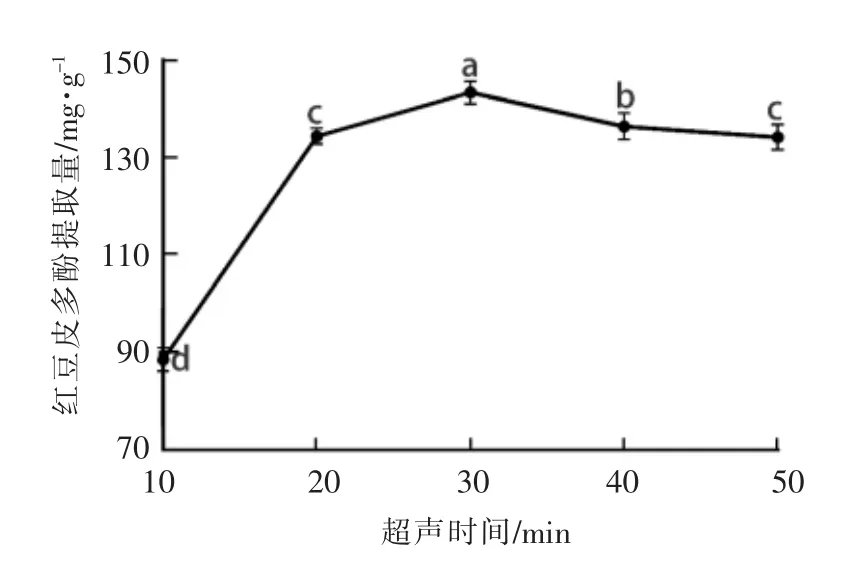
图3 超声时间对红豆皮多酚提取量的影响Fig.3 Effect of ultrasonic treatment time on the extraction yield of azuki bean coat polyphenols
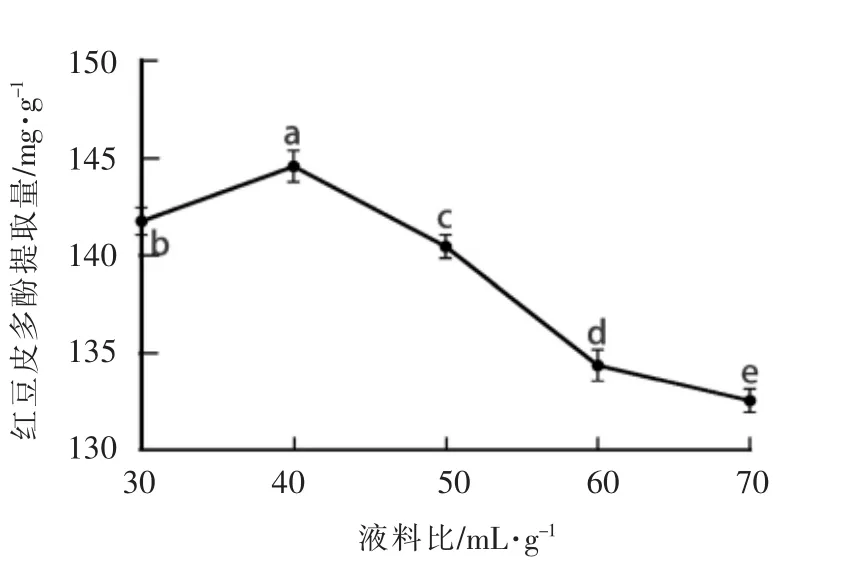
图4 液料比对红豆皮多酚提取量的影响Fig.4 Effect of liquid to solid ratio on the extraction yield of azuki bean coat polyphenols
2.2 响应面分析法优化工艺
2.2.1 响应面试验设计及结果 根据响应面法中的Box-Behnken试验设计方法,以红豆皮多酚提取量为响应值,在单因素试验的基础上进行4因素3水平的工艺优化试验。总共29个试验点,包括24个析因点和5个零点,试验设计结果见表3。
2.2.2 回归方程拟合和方差分析 采用 Design-Expert 8.05软件对试验数据进行多元回归拟合分析得到红豆皮多酚提取量与各因素变量的二次方程模型为:Y=143.25+1.12A+2.80B-1.91C-0.59D+3.33AB+5.33AC+2.11AD-1.30BC-0.048BD-1.26CD-8.97A2-11.81B2-8.87C2+0.80D2。

表3 Box-Behnken试验设计及结果Table3 Box-Behnken design with experimental results
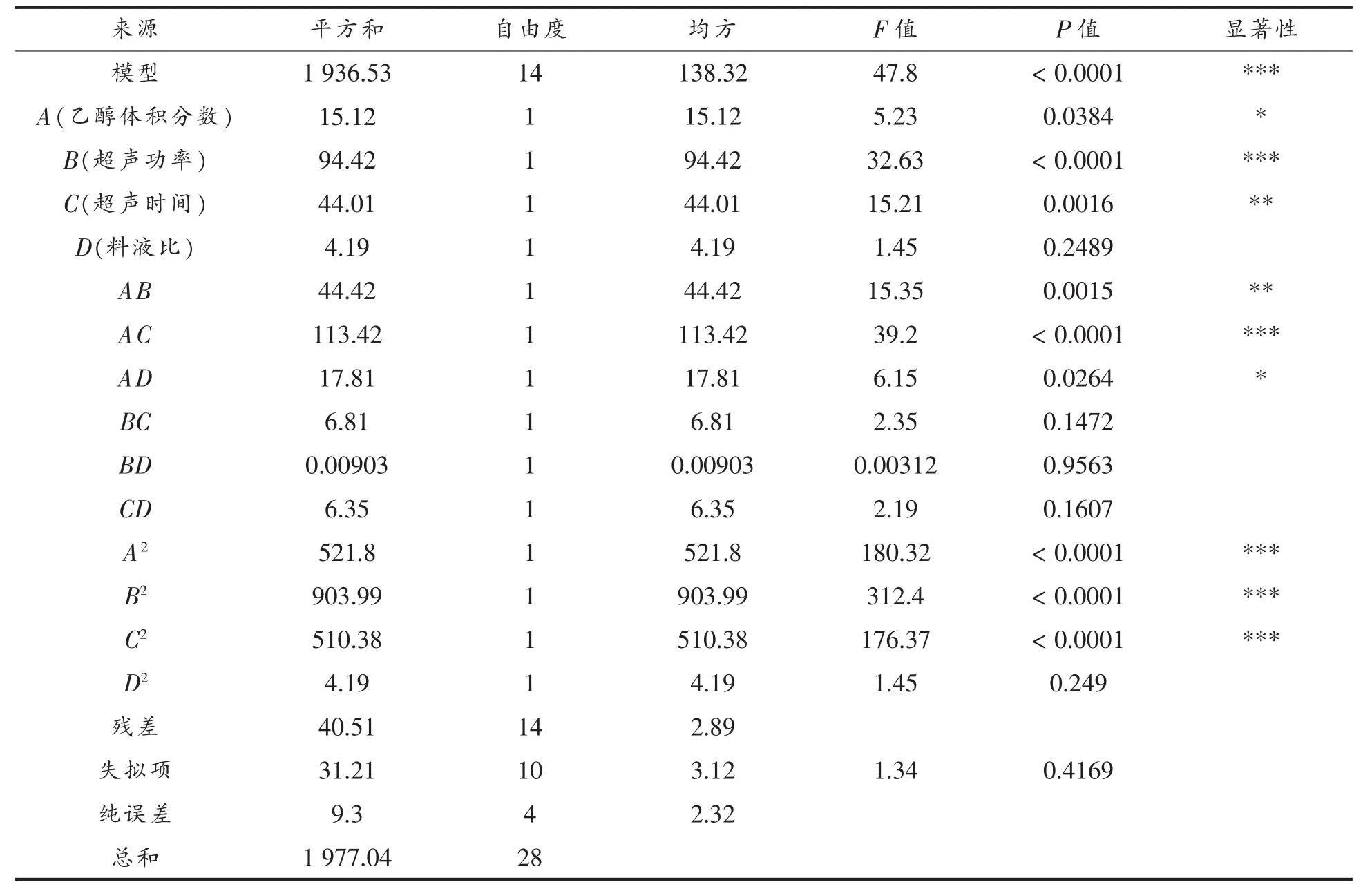
表4 方差分析Table4 Analysis of variance of regression model
从表4可以看出,该回归方程模型的P<0.0001,表明该二次多项回归模型极度显著;失拟项不显著(P=0.4169>0.05),说明模型与实际情况拟合程度较好。由R2=0.9795,RAdj2=0.9590,进一步说明模型方程能够很好地反映真实的试验值。各因素对红豆皮多酚提取量的影响大小顺序为:超声功率>超声时间>乙醇体积分数>料液比。
方程的一次项中B项对红豆皮多酚提取量的影响达到极度显著水平(P<0.0001),C项达到了高度显著水平(P<0.01),A 项达到了显著水平(P<0.05),而 D 项不显著(P>0.05),说明超声功率和超声时间对红豆皮多酚提取量的影响比较大,乙醇体积分数次之,料液比相对影响较小,因此,在试验中应严格控制超声功率和超声时间;两两交互项中AC项极度显著(P<0.0001),AB项高度显著(P<0.01),AD 项显著(P<0.05),说明乙醇体积分数和超声功率、乙醇体积分数和超声时间两两因素交互作用对红豆皮多酚提取量的影响比较大,乙醇体积分数和料液比次之;各因素的二次项中,除了因素D2项外,其余因素的二次项对红豆皮多酚提取量均有显著影响。
2.2.3 响应面分析 响应面图形是响应值对应于各试验因素A、B、C和D所构成的三维空间的曲面图,能够更加形象的描述回归方程,其二维平面的等高线图能够直观地反映出各试验因素以及两两因素交互作用对响应值的影响[21]。由响应面图形可知,超声功率、超声时间、乙醇体积分数的曲面弯曲程度较大,说明这3个因素对红豆皮多酚提取量影响显著。由等高线图可知,乙醇体积分数和超声功率、超声时间、料液比之间的交互作用对红豆皮多酚提取量的影响显著,其它因素交互作用则不明显,与方差分析结果一致。
利用Design-Expert 8.05软件对红豆皮多酚提取工艺进行参数优化,得到的最佳提取条件为乙醇体积分数59.48%,超声功率361.64W,超声时间 29.39min,液料比 1∶30(g/mL),此条件下得出的红豆皮多酚提取量预测值为144.86mg/g。考虑到实际操作的局限性,将理论值修改为乙醇体积分数60%,超声功率360 W,超声时间30min,液料比1∶30(g/mL),通过3次平行试验,得出多酚提取量为(145.28±2.21)mg/g,说明试验优化后的工艺参数比较可靠。
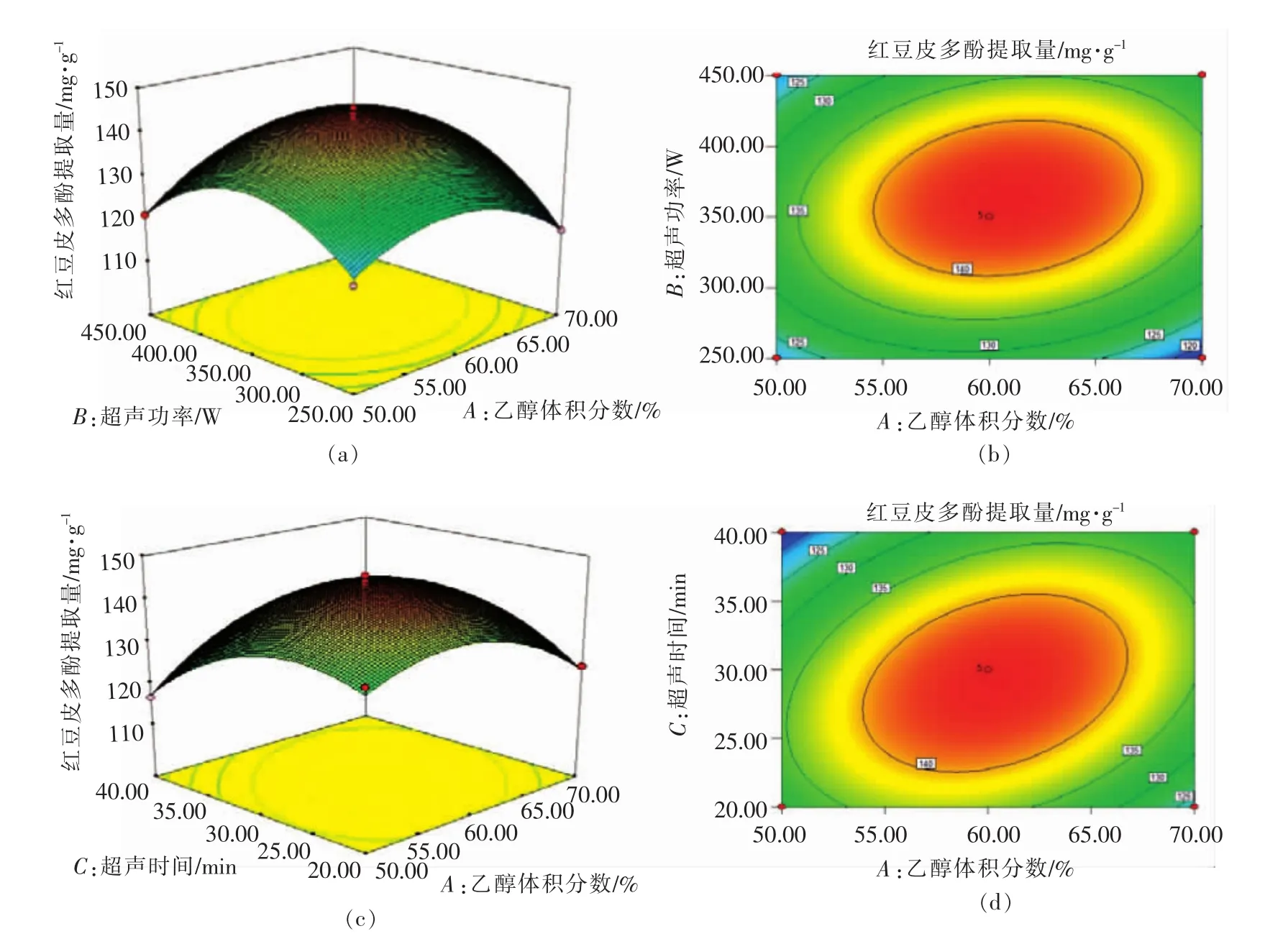
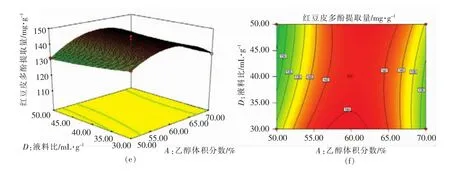
图5 两因素交互作用对红豆皮多酚提取量的响应面和等高线图Fig.5 Response surface and corresponding contour plots showing the effects of operating parameters on the extraction yield of azuki bean coat polyphenols
2.3 红豆皮多酚高效液相色谱的测定结果
为进一步探究红豆皮中多酚类物质成分,本研究通过高效液相色谱法测定了红豆皮中13种单体酚,如图6B。通过与图6A中各标准品的色谱峰保留时间相对比,分析鉴定出13种成分如下:没食子酸、芦丁、儿茶素、绿原酸、原花青素B2、表儿茶素、阿魏酸、异牡荆素、牡荆素、异鼠李素、金丝桃苷、山奈酚、槲皮素,其中金丝桃苷为主成分峰。目前,很多研究表明这些单体酚能够预防和治疗很多由氧化应激引起的相关疾病,例如原花青素、儿茶素、表儿茶素等具有多种生物活性,能够预防心血管疾病[22],抗肿瘤等[23]。芦丁能够在体内转化生成槲皮素,从而抑制脂肪细胞分化,起到缓解肥胖的作用[24]。没食子酸具有抗心肌梗死,保护肝损伤等生物活性[25-26],金丝桃苷具有抗抑郁,抗病毒等作用[27]。因此,红豆皮多酚作为一种新型的天然抗氧化剂,具有重要的研究开发和利用价值。
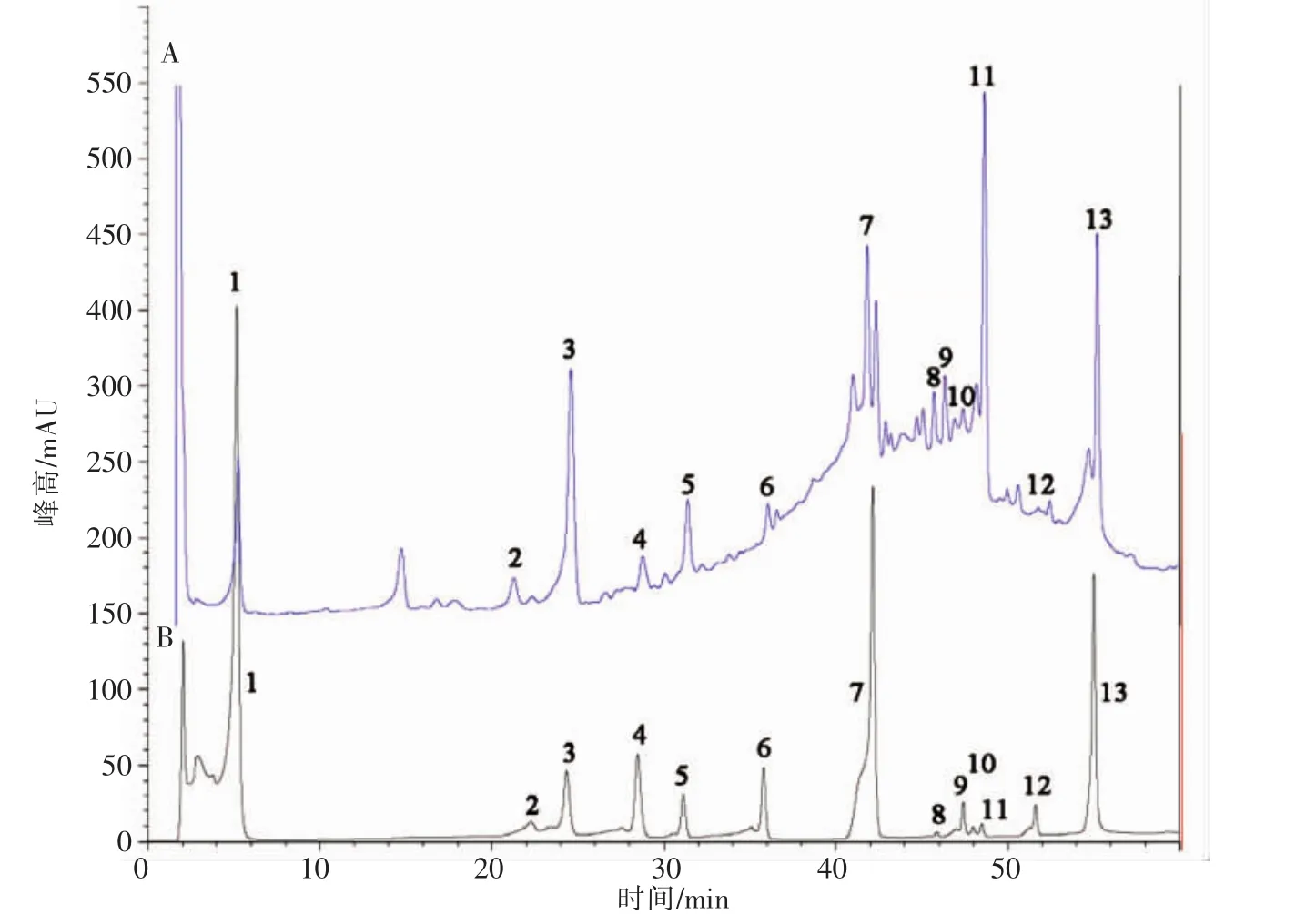
图6 红豆皮多酚样品(A)中13种单体酚和标准品混合液(B)的HPLC图Fig.6 HPLC chromatograms of the 13 monomer phenolics from azuki bean coat polyphenols(A)and the reference substance(B)
2.4 红豆皮多酚抗氧化活性的测定结果
2.4.1 红豆皮多酚对 DPPH自由基的清除能力如图7所示,随着质量浓度的增大,多酚粗提物、纯化物和VC对DPPH的清除率先不断增大再趋于平缓,在质量浓度为150μg/mL时多酚纯化物与VC的清除效果相当,达到最大值(96.53±1.38)%;多酚粗提物的效果最差,最大值为(74.56±2.85)%,说明红豆皮多酚经过纯化后对DPPH有较强的清除效果稍弱于VC。
2.4.2 红豆皮多酚对超氧阴离子自由基的清除能力 如图8所示,不同质量浓度的多酚粗提物、纯化物和VC都具有一定的清除超氧阴离子自由基的能力,在75μg/mL之前,多酚纯化物的清除效果最好,VC次之,多酚粗提物最差。当质量浓度为125μg/mL时,多酚纯化物的清除能力达到最大值(71.85±2.84)%,稍弱于VC,显著高于粗提取物。
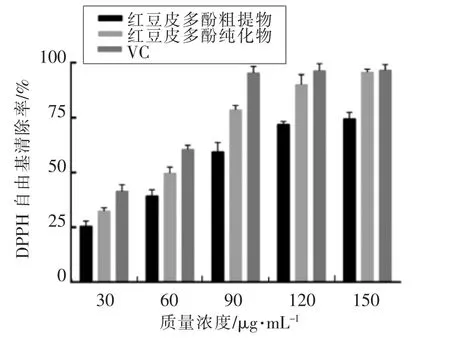
图7 红豆皮多酚对DPPH自由基的清除能力Fig.7 DPPH free radical scavenging capacity of azuki bean coat polyphenols
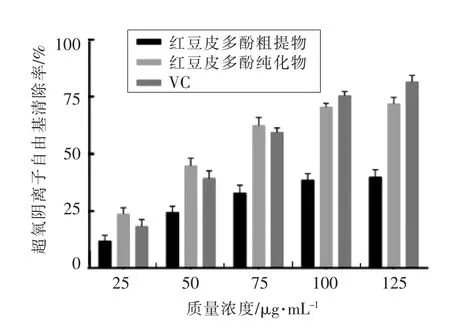
图8 红豆皮多酚对超氧阴离子自由基的清除能力Fig.8 Superoxide free radical scavenging capacity of azuki bean coat polyphenols
2.4.3 红豆皮多酚对羟自由基的清除能力 如图9所示,多酚粗提物、纯化物清除羟自由基的能力随着质量浓度的升高呈上升趋势。在100μg/mL时多酚纯化物对羟自由基清除率达到最大值(89.49±1.76)%,比VC高7%左右,比多酚粗提物高38%左右,说明经过纯化的多酚对羟自由基的清除能力高于VC。
2.4.4 红豆皮多酚对ABTS+·自由基的清除能力如图10所示,在质量浓度小于60μg/mL时,VC对ABTS+·自由基的清除率高于多酚纯化物和粗提物。当质量浓度达到90μg/mL时,多酚纯化物的清除效果高于VC和粗提物,在质量浓度150 μg/mL 时,达到最大值(93.97±2.37)%,说明红豆皮多酚经过纯化后清除ABTS+·自由基的效果增强,且高于VC。
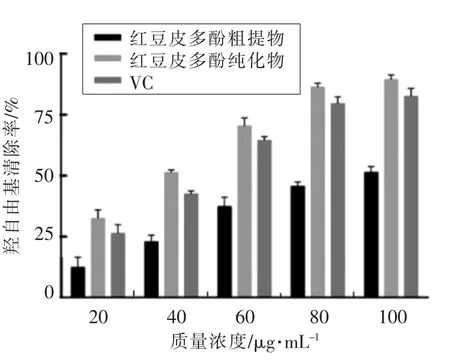
图9 红豆皮多酚对羟自由基的清除能力Fig.9 Hydroxyl free radical scavenging capacity of azuki bean coat polyphenols
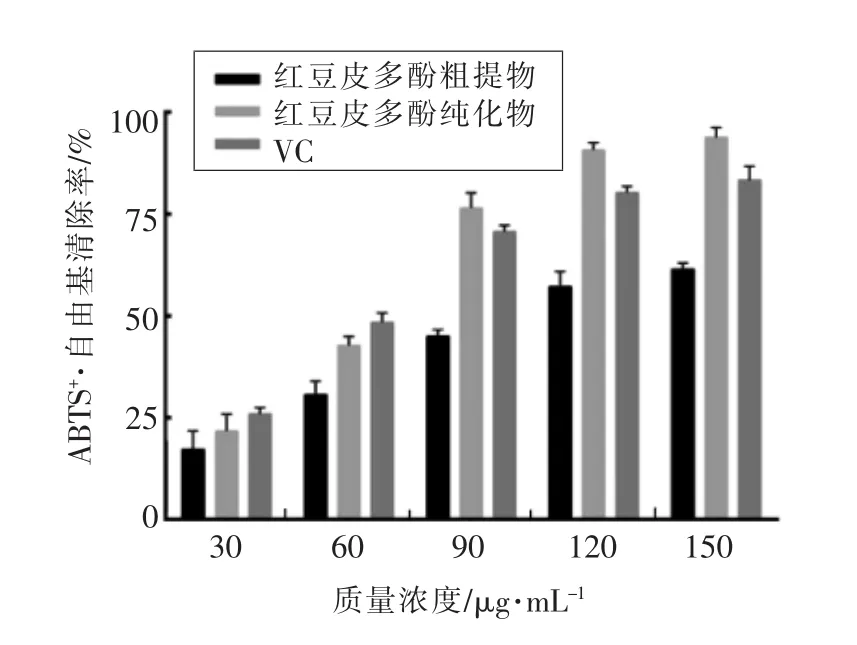
图10 红豆皮多酚对ABTS+ ·自由基的清除能力Fig.10 ABTS+ ·free radical scavenging capacity of azuki bean coat polyphenols
通过SPSS软件回归分析得到多酚粗提物、多酚纯化物和VC对上述4种自由基的半抑制质量浓度IC50值见表4。

表4 红豆皮多酚及VC的值Table4 IC50 values of azuki bean coat polyphenols and VC
3 结论
本研究通过响应面法优化超声辅助提取红豆皮多酚,最佳工艺参数:乙醇体积分数60%,超声功率360W,超声时间30min,液料比30∶1(mL/g),在此条件下的多酚提取量为(145.28±2.21)mg/g,与理论值相符,说明该响应面法优化后的工艺参数可靠。各因素对红豆皮多酚提取量的影响大小顺序为超声功率、超声时间、乙醇体积分数、料液比。通过此条件下得到的红豆皮多酚的提取量比日本学者[6](103mg/g)高出约 42mg/g。采用高效液相色谱法测定出红豆皮多酚中的13种单体酚:没食子酸、芦丁、儿茶素、绿原酸、原花青素B2、表儿茶素、阿魏酸、异牡荆素、牡荆素、异鼠李素、金丝桃苷、山奈酚、槲皮素。红豆皮多酚DPPH自由基、超氧阴离子自由基清除能力略低于VC,而对羟自由基、ABTS+·自由基清除能力高于VC,证明了从红豆皮中提取的多酚化合物具有良好的抗氧化活性,可以作为天然的抗氧化剂。目前,日本学者对红豆多酚类成分的研究较多[28],我国红豆资源丰富,因此对于红豆皮多酚的研究应该予以重视,研究要不断深入到细胞、分子水平。本研究优化了红豆皮中多酚类物质的提取工艺,并对其单体成分、抗氧化活性进行检测,不仅能够提高红豆的经济效益,也为红豆皮多酚在食品及医药领域的应用提供了良好的理论基础。
