戊糖片球菌YF-8对温和气单胞菌毒力因子及生物膜的影响
2022-09-07吕欣然崔晓玲夏文敬白凤翎励建荣王明丽
吕欣然,崔晓玲,杜 宏,夏文敬,白凤翎*,励建荣,2,王明丽
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁省高等学校生鲜食品产业技术研究院 辽宁锦州 121013 2 大连工业大学海洋食品精深加工关键技术省部共建协同创新中心 辽宁大连 116034 3 蓬莱京鲁渔业有限公司 山东烟台 265600)
群体感应(Quorum sensing,QS)是一种细胞间独特的通信方式,即微生物能够通过群体依赖的方式分泌化学自诱导剂来进行通信并调控其行为和活性。细菌在低浓度时开始分泌信号分子,当其积累到一定浓度后便与受体蛋白相结合,启动相关下游基因的表达。这个过程由N-酰基高丝氨酸内酯类(N-Acylated homoserine lactones,AHLs)合成酶(LuxI 型家族蛋白)和AHLs 受体(LuxR 型家族转录调节蛋白)调控[1]。群体感应系统主要参与调控生物膜的形成,生物发光,色素和抗生素的产生以及毒力因子的形成等。
温和气单胞菌(Aeromonas sobria)的QS 调控系统为LuxI/R 型,产生的信号分子为AHLs 类,主要包括N-辛酰基-L-高丝氨酸内酯(N-Octanoyl-L-homoserine lactone,C8-HSL)和N-癸酰基-L-高丝氨酸内酯 (N-Decanoyl-L-homoserine lactone,C10-HSL)等,其生物膜的形成以及胞外蛋白酶、胞外多糖、嗜铁素等致腐因子的产生均与QS系统密切相关。寻找一种能够有效淬灭温和气单胞菌QS 的活性物质,成为解决其致腐能力的新途径。目前已经发现多种具有AHLs 淬灭能力的细菌和真菌。Pattnaik 等[2]研究发现,真菌大豆茎溃疡菌(Diaporthe phaseolorum)SSP12 的次生代谢产物在750 μg/mL 的质量浓度下能够显著抑制铜绿假单胞菌 (Pseudomonas aeruginosa)PAO1 由LasI/R系统介导的蛋白酶LasA、弹性蛋白酶LasB、几丁质酶、胞外多糖和鼠李糖脂及生物膜的形成。Torres 等[3]研究发现,极地寡单胞菌(Alteromonas stellipolaris)PQQ-42 与弧菌体外共培养时,可有效减少弧菌AHLs 的积累,降低其蛋白酶和几丁质酶的产生,并抑制其群集和泳动的能力。
乳酸菌因安全、绿色、高效的特点而被广泛应用于食品领域。研究表明,乳酸菌来源的苯乳酸、细菌素等代谢产物可通过抑制AHLs 合成,竞争性抑制AHLs 与受体蛋白结合,使AHLs 失活等作用方式干扰细菌QS 系统[4]。课题组前期筛选获得1 株对温和气单胞菌AHLs 具有淬灭作用的戊糖片球菌(Pediococcus pentosaceus)YF-8,其乙酸乙酯粗提物在2.0,4.0 mg/mL 和6.0 mg/mL 3 个亚最小抑菌浓度(Subminimal inhibitory concentration,sub-MIC)下不影响温和气单胞菌的正常生长。
本文从细胞水平探究戊糖片球菌YF-8 粗提物对温和气单胞菌蛋白酶、胞外多糖、嗜铁素、溶血性、运动能力等致腐因子的影响。采用结晶紫染色法和扫描电镜技术分析YF-8 粗提物对温和气单胞菌生物膜形成的抑制作用及对已有生物膜的清除作用。从分子水平研究YF-8 粗提物对温和气单胞菌QS 调控基因的影响,以期为控制由温和气单胞菌导致的水产品腐败及病害提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及其来源 乳酸菌菌株:戊糖片球菌YF-8,分离自辽宁朝阳泡菜;目标菌株:温和气单胞菌,分离自腐败大菱鲆体表。
1.1.2 培养基和试剂 MRS 培养基、LB 培养基、平板计数(PCA)培养基、酪蛋白培养基、血琼脂基本培养基、无菌脱纤维羊血,北京奥博星生物技术有限公司;细菌总RNA 快速抽提试剂盒、反转录试剂盒、qRT-PCR 引物,上海生工生物工程有限公司;2.5%戊二醛,北京索莱宝科技有限公司;铬天青,天津市科密欧化学试剂科技有限公司;溴化十六烷基三甲铵,天津市光复精细化工研究所;无水乙醇,山东普利斯化工厂。
1.2 仪器与设备
LHG-3 超级洁净工作台,青岛翌宏仪器有限公司;MHP-500HE 生化培养箱,常州梅香仪器;TGL20M 高速冷冻离心机,常州金坛良友仪器有限公司;Czone5F 全自动菌落计数仪,杭州迅数科技有限公司;ReadMax 1900Plus 酶标仪,上海闪普生物科技有限公司;752N 紫外-可见分光光度计,鑫贝西科学仪器有限公司;DED-2M 显微镜,康华瑞明科技有限公司;S-4800 扫描电镜,日本日立公司;QuantGene 9600 实时荧光定量PCR 分析仪,杭州博日科技股份有限公司。
1.3 试验方法
1.3.1 YF-8 乙酸乙酯粗提物的制备 参照孙梦桐等[5]的方法制备乳酸菌无细胞上清液,将100 mL 上清液倒入分液漏斗中,加入20 mL 乙酸乙酯充分混匀,静置萃取5 min,待分层后收集乳化层,重复此步骤5 次。将萃取液于50 ℃下真空旋转蒸发至无乙酸乙酯气味,收集残留液,真空冷冻干燥成粉末,置于-80 ℃冰箱备用。
1.3.2 YF-8 粗提物对温和气单胞菌蛋白酶的影响 采用琼脂平板扩散法检测蛋白酶活性。取10 μL YF-8 粗提物分别添加到1 mL 温和气单胞菌培养物中,使粗提物终质量浓度为2.0,4.0 mg/mL和6.0 mg/mL,于30 ℃共培养24 h 后,将共培养物于4 ℃,8 000 r/min 下离心5 min,收集上清液。同时以MRS 肉汤组为对照组。
在摆有牛津杯的素琼脂平板中倒入酪蛋白培养基,冷却后将牛津杯取出,在孔内加入180 μL共培养物上清液,30 ℃下培养24 h,使用菌落计数仪测量水解圈的直径。YF-8 粗提物对温和气单胞菌蛋白酶的抑制率按式(1)计算:
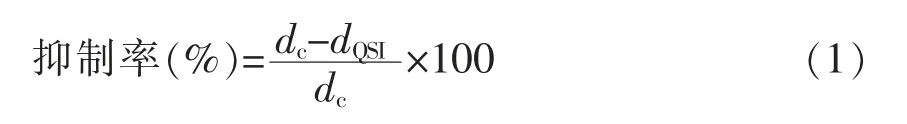
式中,dc——对照组水解圈直径,mm;dQSI——-YF-8 处理组水解圈直径,mm。
1.3.3 YF-8 粗提物对温和气单胞菌胞外多糖的影响 采用苯酚硫酸法测定胞外多糖的含量。按1.3.2 节方法制备YF-8 粗提物和温和气单胞菌的共培养物,将其以10 000 r/min 离心15 min,获得的沉淀重悬于0.5 mL 0.85%生理盐水中,然后在相同条件下继续离心30 min,获得的上清液与冷乙醇(100%)以体积比1∶3 的比例混合,4 ℃条件下过夜沉淀。将沉淀的胞外多糖加入到浓硫酸和冷酚的混合液中,并在波长490 nm 处测量溶液的吸光度值。胞外多糖的抑制率按式(2)计算:
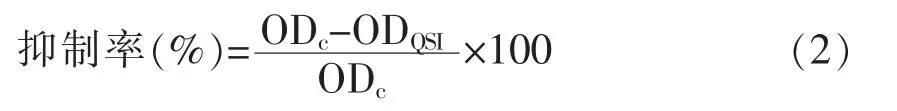
式中,ODc——对照组OD490nm值;ODQSI——YF-8 处理组OD490nm值。
1.3.4 YF-8 粗提物对温和气单胞菌嗜铁素的影响 采用琼脂平板扩散法测定嗜铁素含量。按1.3.2 节方法制备YF-8 粗提物和温和气单胞菌的共培养物上清液,依据李婷婷等[6]的方法配制CASAD 嗜铁素检测培养基,将其倒入摆有牛津杯的素琼脂平板中,冷却后将牛津杯取出,在孔内加入180 μL 共培养物,30 ℃下培养24 h,使用菌落计数仪测量黄色晕圈的直径。嗜铁素的抑制率按式(1)计算。
1.3.5 YF-8 粗提物对温和气单胞菌溶血性的影响 采用琼脂平板扩散法检测溶血性。按1.3.2 节方法制备YF-8 粗提物和温和气单胞菌的共培养物上清液,将含5%无菌除颤羊血的LB 培养基倒入摆有牛津杯的素琼脂平板中,在孔内加入180 μL 共培养物上,30 ℃下培养24 h,使用菌落计数仪测量溶血圈的直径。溶血性的抑制率按式(1)计算。
1.3.6 YF-8 粗提物对温和气单胞菌运动能力的影响 采用Gutierrez-Pacheco 等[7]的方法测定运动能力。取1 mL YF-8 粗提物分别添加到群集培养基(0.5% NaCl、0.6%琼脂、0.5%葡萄糖和1%蛋白胨)和泳动培养基(0.5% NaCl、0.3%琼脂和1%胰蛋白胨)中,使粗提物终质量浓度为2.0,4.0 mg/mL 和6.0 mg/mL,混匀后倒板,待其凝固后将5 μL 温和气单胞菌的过夜培养物点样于平板的中央。于30 ℃培养24 h 后,使用菌落计数仪测量温和气单胞菌迁移的直径,以MRS 肉汤组为对照组。迁移抑制率按式(1)计算。
1.3.7 YF-8 粗提物对温和气单胞菌生物膜的抑制和清除定量分析
1.3.7.1 生物膜抑制 采用结晶紫染色法测定。将YF-8 粗提物添加到含温和气单胞菌的LB 肉汤中,使粗提物终质量浓度分别为2.0,4.0 mg/mL和6.0 mg/mL,于30 ℃培养24 h 后,移除孔中的悬浮液,用PBS(pH 7.2)冲洗孔3~5 次,每个孔添加100 μL 结晶紫(0.4%)染色20 min,最后用无菌水缓慢冲洗至孔内无明显紫色。将96 孔板置于干燥箱中干燥10~15 min,在每个孔内加入200 μL 95%乙醇溶液,使用酶标仪测量波长595 nm 处的OD 值。
1.3.7.2 生物膜清除 在含有200 μL LB 肉汤的96 孔板中加入2 μL 温和气单胞菌过夜培养物,于30 ℃培养24 h 后,吸出孔中的悬浮液用于浮游细胞的存活测定,用PBS(pH 7.2)冲洗孔3~5 次。向孔内添加200 μL 含有YF-8 粗提物的新鲜LB肉汤,使粗提物终质量浓度分别为2.0,4.0 mg/mL和6.0 mg/mL,于30 ℃培养72 h 后,使用结晶紫染色法定量分析。
1.3.7.3 对浮游细胞的影响 采用平板计数法检测浮游细胞的存活率。取100 μL 生物膜清除中的悬浮液,8 000 r/min 离心5 min,将沉淀用0.85%的生理盐水溶液重悬后10 倍梯度稀释,选择合适的稀释度进行涂布,于30 ℃培养48 h 后,测定浮游细胞存活数目。
1.3.8 YF-8 粗提物对温和气单胞菌生物膜结构的影响 在24 孔板中放入预先制好的无菌载玻片(1 cm×1 cm),按1.3.7.1 节或1.3.7.2 节方法用YF-8 粗提物抑制或清除温和气单胞菌生物膜。YF-8 粗提物处理完成后移除孔中悬浮液,用PBS(pH 7.2)冲洗载玻片3~5 次。
1.3.8.1 光学显微镜 添加500 μL 结晶紫(0.4%)染色20 min,用无菌水缓慢冲洗至载玻片上无明显紫色。置于干燥箱中干燥固定10~15 min 后,通过油镜观察载玻片上生物膜结构。
1.3.8.2 扫描电镜 用2.5%的戊二醛溶液固定生物膜12 h。用无菌水洗去残留的戊二醛,再用不同梯度(40%,70%,90%,100%)乙醇依次脱水处理各15 min,真空干燥后喷金,扫描电镜观察。
1.3.9 YF-8 粗提物对温和气单胞菌QS 调控基因的影响 将YF-8 粗提物添加至温和气单胞菌的过夜培养物中,使粗提物终质量浓度为6.0 mg/mL,于30 ℃培养24 h 后,8 000 r/min 离心5 min,弃上清,收集菌体,用0.02 mol/L 的磷酸盐缓冲液(PBS,pH 7.2) 洗涤菌体3 次,收集菌体,采用RNA 抽提试剂盒提取总RNA,按照反转录试剂盒将提取的总RNA 反转录合成cDNA。
利用定量实时聚合酶链反应(qRT-PCR)检测QS 调控基因LuxI/LuxR 表达量的变化,引物序列如表1所示。反应体系(20 μL):包含10 μL 2×SYBR Green PCR Master Mix,4 μL 超纯水,0.5 μL 上游引物,0.5 μL 下游引物,5 μL cDNA。PCR反应条件:95 ℃,30 min;95 ℃,10 s;55 ℃,20 s;72℃,20 s;75 ℃停留5 s 收集荧光信号,反应共进行40 个循环[8]。以温和气单胞菌16S rRNA 为内参基因,基因表达差异依据2-ΔΔCt法计算。
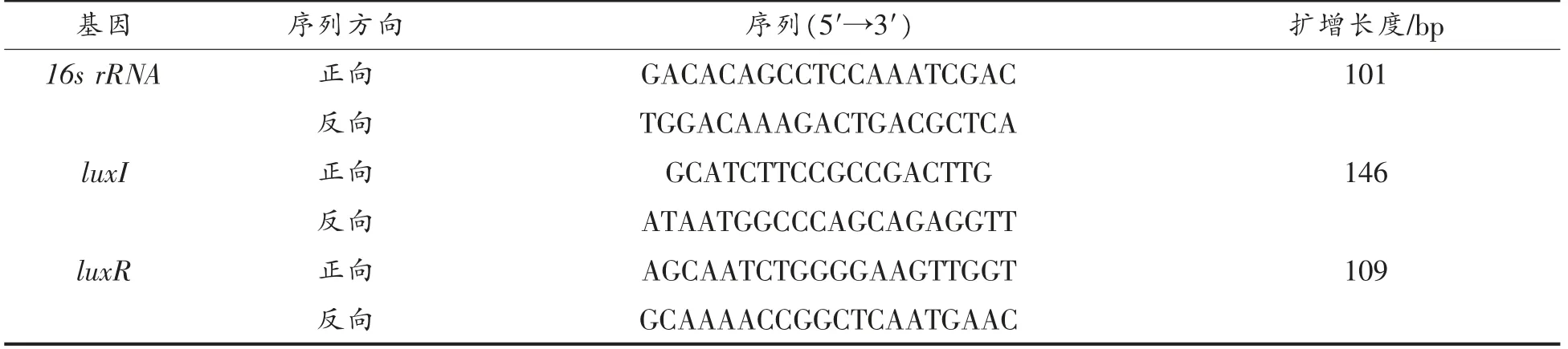
表1 qRT-PCR 引物序列Table 1 Sequences of primers used for qRT-PCR
1.4 数据处理与统计分析
每项试验重复3 次,数据以平均值±标准差表示。采用SPSS 19.0 进行数据分析,Origin 8.0 进行绘图。
2 结果与讨论
2.1 YF-8 粗提物对温和气单胞菌蛋白酶的影响
温和气单胞菌可以产生丰富的胞外蛋白酶,这些蛋白酶水解能力很强,能够使水产品中的蛋白质分解,从而促进其自身的生长繁殖,并导致水产品腐败[9]。3 个sub-MICs 的YF-8 粗提物对温和气单胞菌蛋白酶的影响如图1a 所示。从图中可以看出,随着YF-8 粗提物质量浓度的升高,其对温和气单胞菌蛋白酶的抑制作用也随之增强,且具有质量浓度依赖性。当YF-8 粗提物质量浓度为6.0 mg/mL 时,抑制作用最强,抑制率为32.72%。表明YF-8 粗提物在3 个sub-MICs 下对温和气单胞菌蛋白酶有较强的抑制作用。
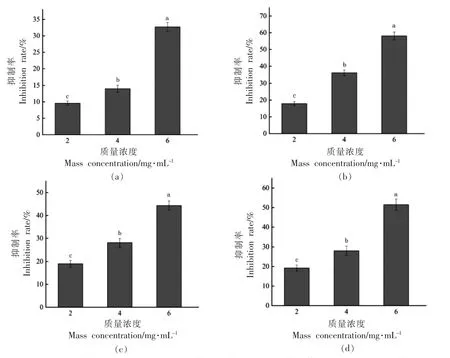
图1 YF-8 粗提物对温和气单胞菌蛋白酶(a)、胞外多糖(b)、嗜铁素(c)和溶血性(d)的影响Fig.1 Effects of YF-8 crude extract on protease (a),extracellular polysaccharide (b),siderophore (c) and hemolysis (d) of A.sobria
2.2 YF-8 粗提物对温和气单胞菌胞外多糖的影响
胞外多糖在黏附宿主的过程中起着重要的作用,有利于腐败菌或致病菌生物膜的形成及发育[10]。抑制细菌胞外多糖的分泌可以一定程度上降低细菌对宿主的伤害。从图1b 中可以看出,温和气单胞菌的胞外多糖分泌会受到YF-8 粗提物的干扰,且质量浓度越高,干扰作用越强。当粗提物质量浓度为6.0 mg/mL 时,其胞外多糖的分泌量比对照组降低了58.09%,干扰作用最强,表明YF-8 粗提物可以抑制温和气单胞菌胞外多糖的分泌。Ding 等[11]研究发现,当用苯甲醇处理荧光假单胞菌(Pseudomonas fluorescens)时,其分泌的胞外聚合物在种类和数量上都显著减少,且具有质量浓度依赖性,与本研究结果一致。
2.3 YF-8 粗提物对温和气单胞菌嗜铁素的影响
嗜铁素是指细菌、真菌等微生物在铁含量较低的环境中合成的相对分子质量较小(1~2 ku)的次级代谢产物[12],能特异性地螯合Fe3+。温和气单胞菌可以在生存环境中分泌大量嗜铁素,使其它微生物无法获得足够的铁营养,生长繁殖受抑制,从而保持其自身的菌群密度,导致水产品腐败变质。从图1c 中可以看出,3 个sub-MICs 的YF-8粗提物对温和气单胞菌嗜铁素的抑制率分别为19.04%,28.12%和44.35%,表明温和气单胞菌嗜铁素的产生受到YF-8 粗提物的抑制,且具有剂量依赖性。
2.4 YF-8 粗提物对温和气单胞菌溶血性的影响
溶血性被认为是温和气单胞菌能够引发水产品病害的潜在原因之一,因此其常被作为研究温和气单胞菌潜在致病性的重要指标[13]。从图1d 中可以看出,温和气单胞菌的溶血活性随着YF-8粗提物质量浓度的升高而降低,当粗提物质量浓度为6.0 mg/mL 时溶血活性最低。表明YF-8 粗提物对温和气单胞菌溶血活性的抑制作用具有质量浓度依赖性。Kannan 等[14]研究发现,750 μg/mL 迷迭香酸显著抑制嗜水气单胞菌 (Aeromonas hydrophila)溶血素的产生,抑制率可以达到89%,这与本研究结果一致。
2.5 YF-8 粗提物对温和气单胞菌运动能力的影响
细菌的群集和泳动是鞭毛介导的两种迁移形式,与致病菌的致病性及生物膜形成有着密切的关系[15]。抑制温和气单胞菌群集和泳动的能力对防治其引起的水产品腐败和病害有着非常重要的作用。YF-8 粗提物对温和气单胞菌运动能力的影响如图2所示。由图2可知,经YF-8 粗提物处理后,温和气单胞菌迁移的距离明显缩短。2.0,4.0 mg/mL 和6.0 mg/mL 的YF-8 粗提物对温和气单胞菌群集和泳动的抑制率范围为21.05%~65.79%和51.61%~93.55%。当粗提物质量浓度为6.0 mg/mL 时,温和气单胞菌的群集和泳动能力几乎完全被抑制,表明YF-8 粗提物可以很好地抑制温和气单胞菌的运动能力,且这种抑制作用呈质量浓度依赖性,这可能是由于温和气单胞菌鞭毛的黏附能力受到了抑制,进而影响了其运动能力。Ding等[9]研究发现,sub-MIC 的姜黄素脂质体对温和气单胞菌的胞外蛋白酶活性、嗜铁素分泌能力以及群集泳动能力等均有一定的抑制作用,与本试验结果类似。

图2 YF-8 粗提物对温和气单胞菌群集和泳动的影响Fig.2 Effects of YF-8 crude extract on swarming and swimming in A.sobria
2.6 YF-8 粗提物对温和气单胞菌生物膜抑制和清除的定量分析
生物膜是细胞通过附着在物体表面的胞外聚合物结合在一起而形成的稳定的多细胞簇。其可以保护细菌免受抗菌剂的作用,比浮游细胞具有更强的抵抗外界变化的能力。AHLs 介导的QS 系统对温和气单胞菌生物膜的形成、附着及固定起着关键性作用[16]。
2.6.1 YF-8 粗提物对温和气单胞菌生物膜形成的抑制 从图3a 中可以看出,3 个sub-MICs 下YF-8 粗提物对温和气单胞菌生物膜形成的抑制率在31.28%~66.64%范围内,随着YF-8 粗提物质量浓度的增加,温和气单胞菌生物膜的形成量逐渐降低,抑制作用呈质量浓度依赖性。
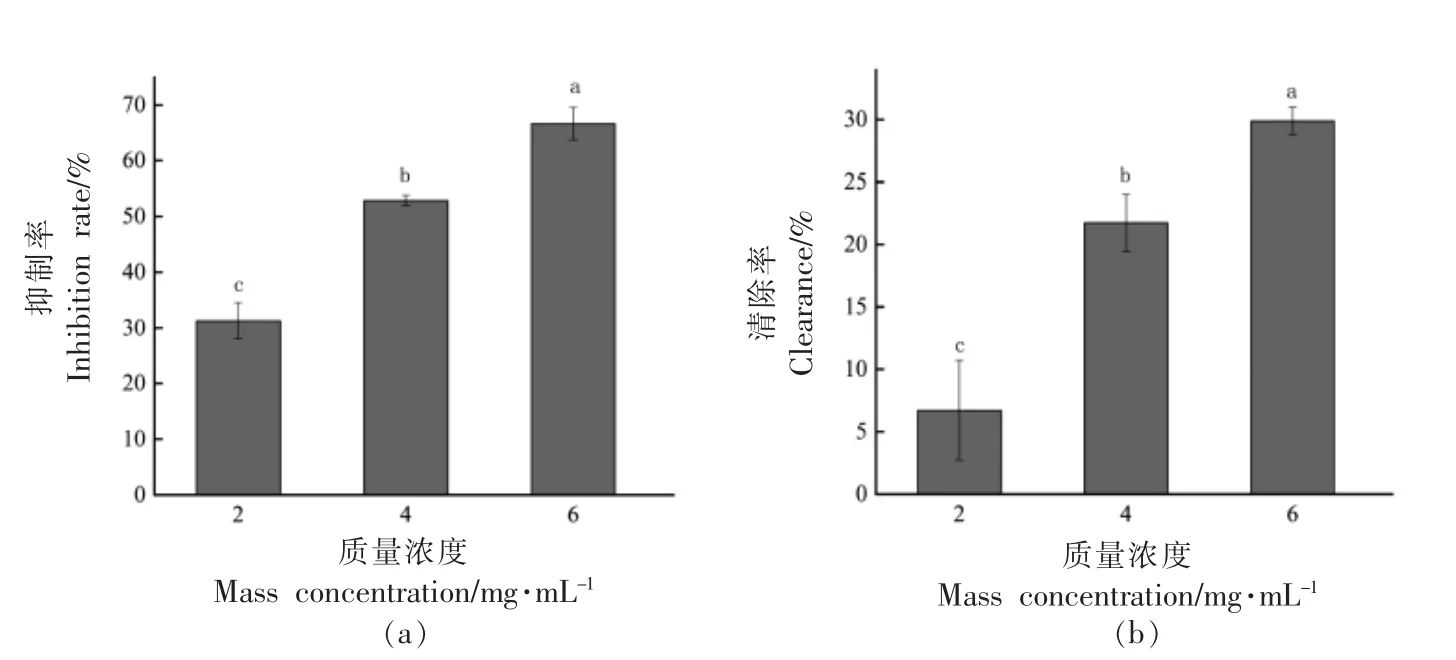
图3 YF-8 粗提物对温和气单胞菌生物膜抑制(a)和清除(b)的定量测定Fig.3 Quantitative determination of YF-8 crude extract on the inhibition (a) and clearance (b) of A.sobria biofilm
2.6.2 YF-8 粗提物对温和气单胞菌生物膜的清除作用 从图3b 中可以看出,3 个sub-MICs 下YF-8 粗提物对温和气单胞菌预先形成的生物膜均具有一定的清除效果,清除率分别为6.70%,21.72%和29.88%。用6 mg/mL 的YF-8 粗提物处理时,清除效果最好。
2.6.3 YF-8 粗提物对温和气单胞菌浮游细胞的影响 YF-8 粗提物在清除温和气单胞菌生物膜时,对其浮游细胞的影响如图4所示。由图4可知,与对照组相比,3 个sub-MICs 的YF-8 粗提物均不影响温和气单胞菌浮游细胞的正常生长,表明YF-8 粗提物对温和气单胞菌没有抑制和杀死的作用。
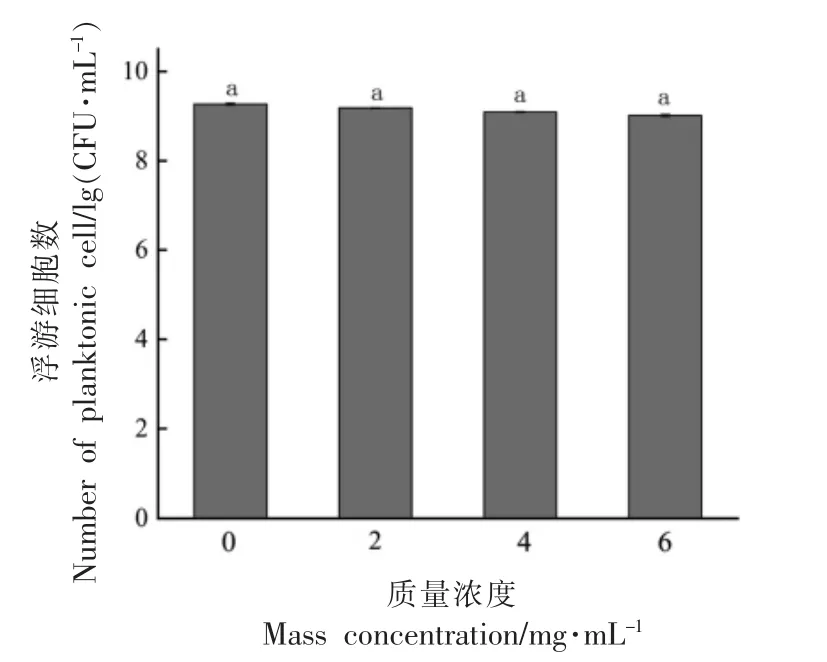
图4 YF-8 粗提物对温和气单胞菌浮游细胞的影响Fig.4 Effects of YF-8 crude extract on planktonic cells of A.sobria
2.7 光学显微镜分析YF-8 粗提物对温和气单胞菌生物膜的抑制和清除作用
2.7.1 YF-8 粗提物对温和气单胞菌生物膜的抑制 从图5a~d 中可以看出,对照组中温和气单胞菌菌体相互连接、聚集,形成典型的生物膜结构,而YF-8 粗提物处理组则随着粗提物质量浓度的升高,生物膜逐渐稀疏,形成量逐渐减少,菌体逐渐分散,即抑制作用具有剂量效应。当YF-8 粗提物质量浓度为6.0 mg/mL 时,抑制作用最强,表明YF-8 粗提物对温和气单胞菌生物膜的形成有较好的抑制作用。
2.7.2 YF-8 粗提物对温和气单胞菌生物膜的清除 从图5e~h 可以看出,对照组中大量温和气单胞菌菌体聚集成片状,形成致密的生物膜结构,而YF-8 粗提物处理组中,虽然细菌仍大量累积,但是随着粗提物质量浓度的升高,生物膜的量逐渐减少,厚度逐渐变薄,结构逐渐变得松散。用6.0 mg/mL 粗提物处理时,清除效果最好,表明YF-8粗提物对温和气单胞菌生物膜有较好的清除效果。同时,不同质量浓度的YF-8 粗提物对温和气单胞菌生物膜结构的影响与定量测定的结果一致。

图5 光学显微镜分析YF-8 粗提物对温和气单胞菌生物膜的抑制和清除作用Fig.5 Analysis of the inhibitory and removal effect of YF-8 crude extract on A.sobria biofilm by optical microscope
2.8 扫描电镜分析YF-8 粗提物对温和气单胞菌生物膜的抑制和清除作用
2.8.1 YF-8 粗提物对温和气单胞菌生物膜的抑制 从图6a~d 中可以看出,对照组中温和气单胞菌微菌落连接形成致密而完整的生物膜结构,而用YF-8 粗提物处理过的细菌生物膜表现出少量的微菌落以及一些孔隙和通道,表明YF-8 粗提物可能通过这些孔隙和通道引起营养物质的泄漏和生物膜基质的减少,从而抑制温和气单胞菌生物膜的形成。

图6 扫描电镜分析YF-8 粗提物对温和气单胞菌生物膜的抑制和清除作用Fig.6 Analysis of the inhibitory and removal effect of YF-8 crude extract on A.sobria biofilm by scanning electron microscope
2.8.2 YF-8 粗提物对温和气单胞菌生物膜的清除 从图6e~h 中可以看出,对照组中温和气单胞菌的生物膜结构厚而平坦,而经不同质量浓度的YF-8 粗提物处理后,温和气单胞菌的生物膜明显被破坏,生物膜量显著降低且厚度明显减小,结构越来越稀疏。此结果与光学显微镜观察到的结果具有一致性,表明YF-8 粗提物对温和气单胞菌生物膜有较好的清除效果。Younis 等[17]研究表明,15 mg/mL 海洋链霉菌(Marine streptomyces)的次生代谢物处理奇异变形杆菌 (Proteus mirabilis)UCB4 后,对其生物膜的抑制率为63%,且处理后的奇异变形杆菌在光学显微镜和扫描电镜下生物膜结构稀疏松散,与本研究结果一致。
2.9 YF-8 粗提物对温和气单胞菌QS 调控基因的影响
LuxI 和LuxR 是与温和气单胞菌QS 相关的基因,LuxI 型蛋白主要负责合成信号分子AHLs,LuxR 型蛋白主要与AHLs 结合,从而触发毒力因子和生物膜等相关基因的表达[18]。从图7中可以看出,用6 mg/mL YF-8 粗提物处理温和气单胞菌后,LuxI 和LuxR 的表达明显下调,相对表达量分别降低了69.48%和80.76%。表明温和气单胞菌QS 调控基因LuxI 和LuxR 的转录水平均受到YF-8 粗提物的干扰。QS 调控基因的下调与上述毒力因子的研究结果一致。Li 等[19]研究发现,蜂房哈夫尼亚菌(Hafnia alvei)经1.0 mg/mL 的香兰素处理后,QS 调控基因halI/halR 的相对表达量显著下调,下调率分别为77.40%和34.30%,并且其AHLs 的分泌量明显降低,与本研究结果一致。
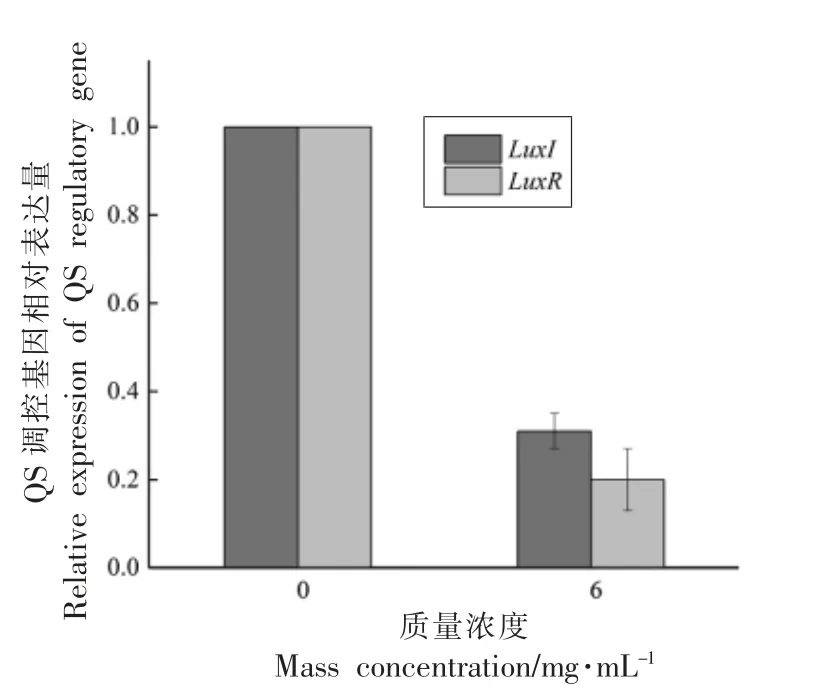
图7 YF-8 粗提物对温和气单胞菌QS 调控基因的影响Fig.7 Effects of YF-8 crude extract on the expression of QS-related genes in A.sobria
3 结论
本文主要研究了戊糖片球菌YF-8 粗提物对温和气单胞菌几种毒力因子及生物膜的影响。结果表明,3 个sub-MICs (2.0,4.0 mg/mL 和6.0 mg/mL)下YF-8 粗提物对温和气单胞菌的蛋白酶、胞外多糖、嗜铁素、溶血性、运动能力等几种毒力因子和生物膜形成具有明显的抑制作用,且抑制作用具有显著的剂量依赖性。此外,温和气单胞菌QS 调控基因LuxI 和LuxR 的转录水平明显受到YF-8 粗提物的干扰。因此,戊糖片球菌YF-8 可作为淬灭温和气单胞菌QS 的出发菌株,为控制由温和气单胞菌导致的水产品腐败及病害提供一种新的思路。
