MTGase点修饰改性提高小麦醇溶蛋白的乳化稳定性
2020-01-15冯凤琴
邹 琳 杨 盛 李 阳 张 希 冯凤琴
(浙江大学生物系统工程与食品科学学院 农业部农产品采后处理重点实验室浙江省农产品加工技术研究重点实验室 杭州 310058)
小麦醇溶蛋白是分子质量为30~70 ku的单体蛋白质[1],是谷朊粉的主要组分,能赋予面团一定的延展性[2-3]。由于分子结构中大量存在的亮氨酸、脯氨酸等非极性氨基酸残基和不可解离的极性谷氨酰胺残基,小麦醇溶蛋白在中性条件下主要以大的聚集体而非以单个分子存在[4],溶解性较差,极大地限制了其在食品工业领域的应用。对小麦醇溶蛋白进行改性,增加其溶解性,提高乳化性、黏合性、热稳定性等功能性质,拓宽小麦醇溶蛋白的应用,已成为当前研究的热点。目前,主要采用物理法、化学法、酶法和基因工程法等对小麦醇溶蛋白进行改性[5]。物理法作用有限且不可控;化学法虽可有效提高小麦醇溶蛋白的性能,但可能会带来毒副作用,如谷朊粉用碱处理后,其蛋白质分子中的氨基酸发生消旋,导致必需氨基酸的L-对映体减少且消化率降低,并产生有毒的D-氨基酸,从而大大降低谷朊粉的营养价值[6];基因工程法周期长,见效慢,目前应用并不多。相比之下,酶法改性条件温和,具有可控性、高效性、低能耗等优点。
微生物谷氨酰胺转氨酶(Microbial transglutaminase,MTGase)是一种通过微生物发酵、分离纯化而制得的高效生物催化剂,具有成本低,作用温度稳定,pH值范围广,且不依赖钙离子等优势[7-8]。其催化机理是以肽链中的谷氨酰胺残基γ-甲酰胺基为酰基供体,与酰基受体发生交联反应[9-10],改善蛋白质的热稳定性、乳化性、凝胶性和持水性等功能性质[11]。小麦醇溶蛋白分子中富含MTGase作用的良好底物谷氨酰胺[12],这使得利用MTGase点修饰改性小麦醇溶蛋白具有可行性。Gerrard等[13]用SE-HPLC分析对比MTGase点修饰前、后面筋蛋白的变化,结果发现面团中醇溶蛋白的含量明显增加,而麦谷蛋白的变化并不明显。倪新华等[14]应用MTGase对面粉进行品质改良研究,结果表明,MTGase可以增加面团的形成时间、稳定时间、断裂时间,降低面团的弱化度,从而明显改善面团的粉质特性。由于小麦醇溶蛋白水溶性极差,因此在进行MTGase点修饰反应前需要进行一定的预处理打断或展开其蛋白结构,以暴露更多的反应位点[15]。Wróblewska 等[16]在进行 MTGase酶催化乳清蛋白点修饰反应前,先应用碱性蛋白酶对乳清蛋白进行水解,结果发现水解后的乳清蛋白更易于发生点修饰反应。
本研究以小麦醇溶蛋白的胃蛋白酶水解产物为底物,利用MTGase进行点修饰,以点修饰产物的乳化稳定性为指标,探究3种外源氨基供体——甘氨酸乙酯(Ethylglycinate,Gly-O-Et)、6-氨基己酸(6-epsilon-aminocaproic acid,EACA)和乙醇胺(Monoethanolamine,MEA)对点修饰的调控作用,最后通过分析点修饰产物的熔融温度、粒径、电位和三相接触角等理化性质进一步确认点修饰改性对小麦醇溶蛋白底物乳化稳定性的改善作用。
1 材料与方法
1.1 材料与试剂
谷朊粉,河南莲花味精股份有限公司,蛋白质含量76.02%。
甘氨酸乙酯盐酸盐(Gly-O-Et·HCl)、6-氨基己酸(EACA)、乙醇胺(MEA)和猪源胃蛋白酶,上海阿拉丁生化科技股份有限公司;MTGase,泰兴市东圣食品科技有限公司;4-二甲氨基偶氮苯磺酰氯(Dabsyl-Cl,CAS:56512-49-3),上海百灵威科技有限公司;其它试剂均为国产分析纯级。
1.2 仪器与设备
超声波破碎仪,上海生析超声仪器有限公司;自动凯氏定氮仪,瑞典福斯公司;反相高效液相色谱(RP-HPLC),美国安捷伦科技有限公司;差示扫描热量仪,瑞士梅特勒-托利多公司;接触角测量仪,德国Dataphysics公司;真空冷冻干燥机,北京松源华兴科技发展有限公司;粒径分析仪,英国马尔文公司。
1.3 试验方法
1.3.1 小麦醇溶蛋白的提取 将100mL乙醇柠檬酸缓冲溶液放入60℃水浴锅预热2min后,启动磁力搅拌,缓慢加入50 g/L的谷朊粉,保温搅拌30min后,20 kHz,150W 超声处理 30min。处理后的悬浊液在2 000 r/min,12℃条件下离心10 min。取上清液4℃保存。
将上清液缓慢加到水中,制备得到体积分数12.5%蛋白乙醇水悬液。减压旋蒸后,采用凯氏定氮法测定小麦醇溶蛋白粗提物(Wheat gliadin crude extracts,EXTs)的蛋白得率。
1.3.2 MTGase点修饰反应 将EXTs和0.01 mol/L HCl溶液按照体积比1∶4混匀,得到终质量浓度为6.4 g/L EXTs悬浊体系。40℃恒温搅拌下,以酶底物质量比为1∶64添加胃蛋白酶进行水解。将水解0,0.5,1 h的粗提物100℃灭酶10min后,以相同浓度分别添加4 g/L甘氨酸乙酯盐酸盐,3.8 g/L 6-氨基己酸和0.17%(体积分数)乙醇胺,调节pH值至7.5。55℃恒温搅拌下,以酶底物质量比为1∶64添加 MTGase,分别在反应 1,2,4 h时取样,85~100℃灭酶10min。
1.3.3 利用RP-HPLC测定氨基供体反应量点修饰产物过0.22μm有机滤膜后用蒸馏水稀释10倍,取0.2mL稀释过滤液与0.2mL碳酸钠缓冲液(pH 9,0.05 mol/L Na2CO3∶0.1 mol/L NaHCO3=1∶9)混合均匀,再加入0.8mL 15mmol/L 4-二甲氨基偶氮苯磺酰氯乙腈反应液,混匀,在72℃水浴条件下反应15min,再加入1.2mL pH值为6.5的终止液(40mmol/L磷酸缓冲液∶无水乙醇=1∶1),置于10 000 r/min条件下离心10min,取上清液过0.22μm有机膜后用于检测。
取滤液10μL进行检测:C18柱温维持40℃,波长 436 nm,流动相 A(乙腈)与流动相 B(0.2%HAC水溶液)的比例维持7∶3,流速0.6 mL/min,持续15min。计算公式如下:
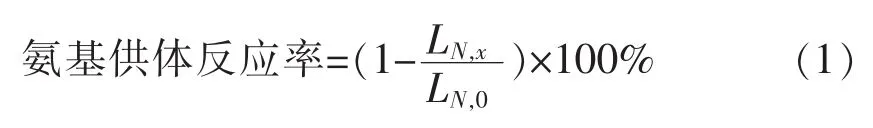
式中,LN,x——反应x h后氨基供体残留量,g;LN,0——反应前氨基供体添加量,g。
1.3.4 点修饰产物乳化稳定性分析 取3mL点修饰产物在4℃下10 000 r/min离心5min,去掉上清后加入3mL的5mmo/L柠檬酸缓冲液(pH 4)重悬沉淀,再加入 3mL大豆油,混匀,20 kHz,150W超声乳化1min,得到底物质量浓度为3.2 g/L的乳化体系。将制备的乳液静置36 h记录析出水层高度。乳液稳定系数计算公式如下:
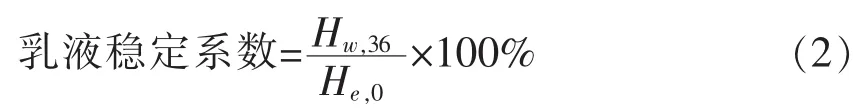
式中,Hw,36——静置36 h时乳层高度,cm;He,0——静置0 h时乳层高度,cm。
1.3.5 小麦醇溶蛋白点修饰产物特征分析 将灭酶后的点修饰产物均分成3份,10 000 r/min离心5min,取沉淀分别添加到等体积的pH 6.99纯净水、5mmo/L pH 3.30柠檬酸缓冲液和5mmo/L pH 8.01碳酸钠缓冲液中,20 kHz,150W超声破碎、分散沉淀1min,最后将复分散的悬浊体系冷冻干燥,用于后续分析。空白组为添加已灭活的MTGase的小麦醇溶蛋白微粒悬浊体系。
1.3.5.1 差示扫描量热仪(DSC)分析 取点修饰产物及其对应空白组的冻干样品分别置于40μL铝坩埚中,冲压封闭,线性升温速率10℃/min,温度从25℃升至250℃,氮气流速50mL/min。
1.3.5.2 粒径、电位分析 向点修饰产物及其对应空白组的冻干样品加入19倍体积而pH值不同(为3.31,4.31,5.34,6.01,6.38,6.96和8.01)的5mmo/L缓冲液中,然后测定其粒径及电位,连续相黏度为0.8872mPa·s,折射系数为1.450,室温下测定。
1.3.5.3 三相接触角分析 将点修饰产物及其对应空白样品溶解于60%乙醇水溶液中,滴一滴在载玻片上,待其风干后测定,每次滴加1μL水相,拍照观察。
1.4 数据分析
采用IBM SPSS statistics 22和Origin Pro 9.2软件进行相关性和线性回归处理分析。
2 结果分析
2.1 响应面优化小麦醇溶蛋白提取工艺
在评价乙醇体积分数、柠檬酸缓冲液浓度和超声时间3个单因素的基础上,设计3因素3水平CCD响应面,考察各因素之间的交互作用对小麦醇溶蛋白提取的影响,试验设计及结果见表1、表2。

表1 响应面试验因素及其水平Table1 Factors and levels used in response surface analysis

表2 响应面试验设计及结果Table2 Response surface design with experimental results
对试验结果进行多元回归拟合,得到EXTs蛋白得率(Y)关于乙醇含量(A)、柠檬酸缓冲液浓度(B)、超声时间(C)的二次回归方程为:
Y=81.08+1.21A-1.37B-0.96C-1.14AB-0.26AC+0.06BC-13.81A2-3.57B2-6.23C2+13.6AB2
表3模型方差分析结果表明,该模型极显著(P<0.001),失拟项不显著(P=0.5613>0.05),说明该模型拟合度好。同时,可以得到各因素对EXTs蛋白得率影响强弱顺序为B(柠檬酸缓冲液浓度)、C(超声时间)、A(乙醇体积分数)。

表3 EXTs蛋白得率的响应面二次模型方差分析Table3 Analysis of variance of regression equation of EXTs rate
通过EXTs蛋白得率的二次多项数学模型解逆矩阵,得出在乙醇体积分数为60%,柠檬酸缓冲液浓度为5mmo/L,超声时间为29.67min的工艺条件下,EXTs蛋白最大得率为81.0476%。
2.2 MTGase点修饰反应对EXTs乳化稳定性的影响
2.2.1 MTGase点修饰反应对氨基供体反应量的影响 小麦醇溶蛋白的复合改性可弥补单种改性方法改善功能性质受到限制的缺点。在进行MTGase点修饰改性前,利用胃蛋白酶催化小麦醇溶蛋白内肽键断裂成小分子多肽,增加蛋白质的水溶性[17],暴露出更多点修饰反应的位点,提高点修饰反应的效率。胃蛋白酶水解时间和MTGase点修饰反应时间对不同氨基供体反应量的影响见图1。
随着点修饰反应时间的延长,不同水解时间的EXTs与Gly-O-Et的反应量不断升高,由图1a可知,反应至4 h后,水解 0,30,60min的EXTs分别与(57.39±8.68)%,(41.79±0.78)%和(64.06±8.74)%的Gly-O-Et反应,说明未水解和水解60 min的粗提物均比水解30min的粗提物更契合MTGase的反应位点。这可能是因为MTGase催化水解30min的粗提物中暴露的残基之间产生了点修饰,进而减少了能够与Gly-O-Et结合的位点。
由图1b可知,不同水解时间的粗提物与EACA的反应量随着点修饰时间的延长而不断升高,其中,水解60min的粗提物与EACA反应的速度最快,其次是水解30min的粗提物和未水解的粗提物,这可能是因为水解时间越长,粗提物中暴露的反应位点越多。反应至4 h时,水解60min的粗提物与 EACA的反应量最高,为(42.18±1.42)%,其次是水解30 min和未水解的粗提物,分别为(16.09±3.62)%、(20.09±2.80)%。

图1 点修饰时间对氨基供体反应量的影响Fig.1 Influence of cross-linking time towards the reacting amount of exogenous amino donors
由图1c可知,水解30min的粗提物更易与MEA发生点修饰反应,这可能与MEA具有亲水性的小分子结构有关,能够优先进入MTGase的催化活性部位[18],迅速与水解30min的底物进行反应,然而随着点修饰反应的深入并达到4 h时,未水解、水解30min和水解60min粗提物点修饰的MEA反应量相当,分别达到(25.03±2.49)%、(24.19±4.15)%和(23.48±5.82)%。
2.2.2 MTGase点修饰反应对产物乳化稳定性的影响 MTGase能够催化蛋白质分子内和分子间、蛋白质和氨基酸之间发生点修饰反应[19],而不同程度的点修饰作用得到的乳浊液的乳化稳定性不同。胃蛋白酶水解时间和MTGase点修饰反应时间对产物乳化稳定性的影响见图2。
胃蛋白酶水解程度不同的粗提物在进行以Gly-O-Et为氨基供体的点修饰后,产物的乳化稳定性变化趋势不同。由图2a可知,MTGase点修饰反应能够提高未水解产物的乳化稳定性,其中,点修饰反应2 h时有显著的提高,可能是低程度的点修饰作用得到的乳浊液容易发生脂肪球的聚集合并,而高程度的点修饰反应的乳浊液由于连续相的黏度增大或者是吸附层发生的变化弱化了聚集作用[20],具有较高的稳定性。然而这种提高是有限的,将产物放置36 h后,未水解且进行点修饰2 h的试验组乳化稳定系数为(91.93±0.11)%,相比未水解且未进行点修饰的空白组乳液稳定性(90.24±0.23%)而言仅仅提高了1.69%。而对于水解30min和水解60min粗提物的点修饰产物,其乳化稳定性不再提高甚至出现明显的抑制作用。这种现象出现的原因是小麦醇溶蛋白粗提物经过胃蛋白酶酶解后,在水相界面上产生较多的多肽[21],使得后续点修饰反应过快地进行,而阻碍了规则的蛋白结构的形成[22],同时MTGase点修饰后的粗提物,其蛋白的二级结构和三级结构被打开,多肽链变得舒展,导致分子内部诸多疏水区域暴露在水溶液中,最终因疏水作用而凝集发生沉降[23],从而降低了产物的乳化稳定性。
由图2b可知,与水解30min和水解60min粗提物的点修饰产物相比,未水解的粗提物与EACA进行点修饰反应后产物的乳化稳定性最好,且点修饰2 h和4 h与点修饰0 h相比显著提高。然而,点修饰反应对乳化稳定性的提升有限,放置36 h后,点修饰4 h的试验组乳液稳定系数是(99.19±0.16)%,相比未进行点修饰的空白组乳液稳定性(96.94±0.80)%而言仅提高了2.25%。同时,对水解60 min粗提物进行点修饰明显降低了产物的乳化稳定性。
由图2c可知,MEA点修饰反应1 h和2 h时,对未水解粗提物乳化稳定性的提高最明显,而点修饰4 h时降低了乳化稳定性。同时,水解30 min和水解60min的粗提物随着点修饰反应时间的延长,产物的乳化稳定性逐渐增强。
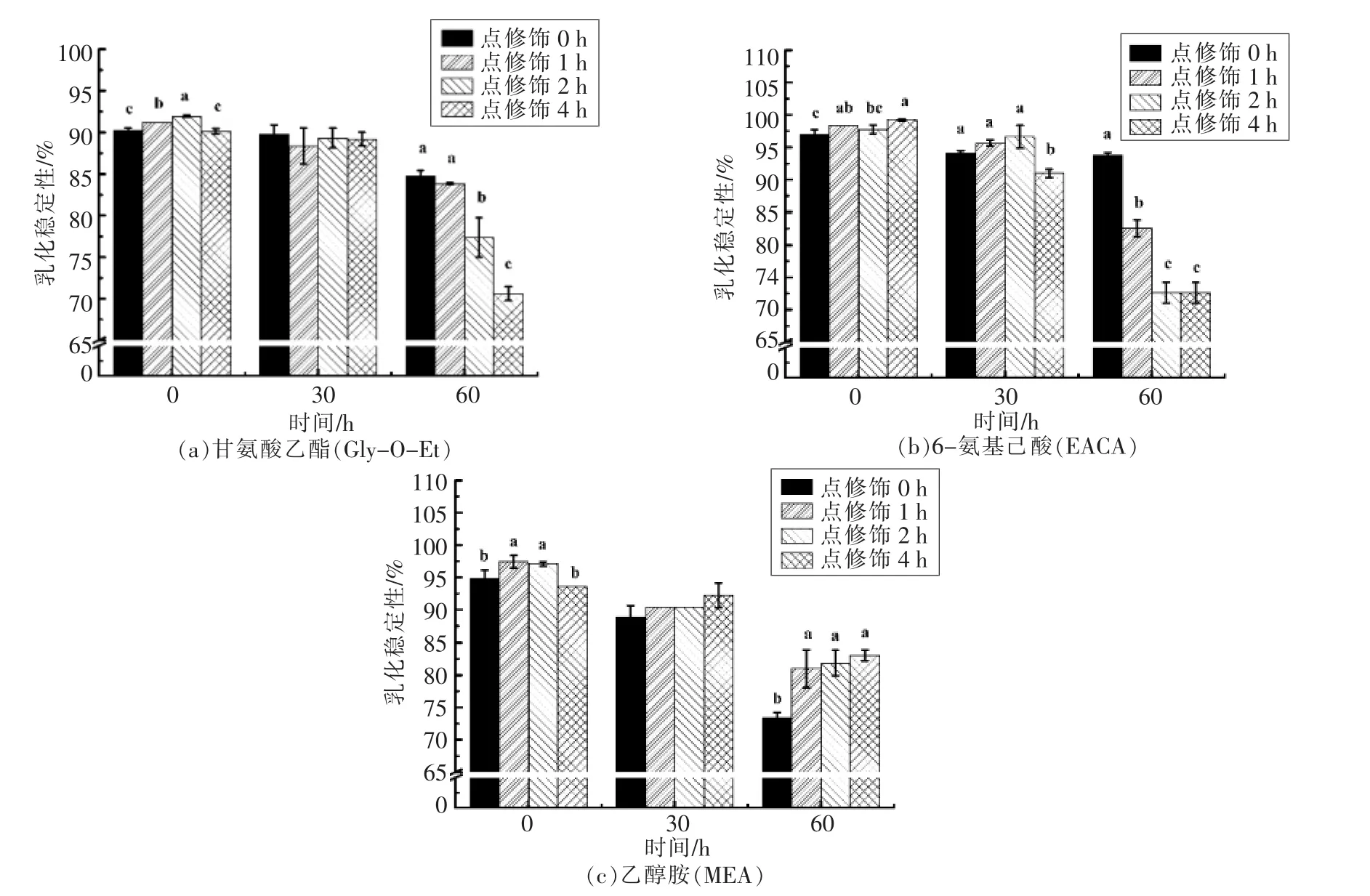
图2 水解时间对点修饰产物乳化稳定性的影响Fig.2 Influence of hydrolyzing time towards the emulsion stability of cross-linking products
2.3 小麦醇溶蛋白点修饰产物特征分析
2.3.1 DSC分析 由表4可知,Gly-O-Et点修饰(133.74±1.50)℃对粗提物熔融温度(135.3±3.97)℃影响不显著,EACA点修饰后产物的熔融温度上升了15.85℃,而MEA点修饰降低了产物的熔融温度(97.51±2.87)℃。此外,Gly-O-Et和MEA点修饰产物的焓变显著高于EXTs与EACA点修饰产物,这表明MEA点修饰降低了产物熔融变化及伸展蛋白结构所消耗的能量,使得它最易分散从而获得胶体特性,其次是Gly-O-Et点修饰产物,而EACA点修饰产物最难实现蛋白结构的展开。Ramirez-Suarez等[24]用差示扫描量热仪对面团进行分析,结果发现,因为MTGase使面筋网络结构更稳定,进而增加了面筋蛋白的转变焓,故蛋白质在热变形过程中断开共价交联所需要的热量而增加。
2.3.2 粒径、电位分析 蛋白微粒会随着pH值的变化而变化,最终在其等电点pI处聚集沉淀,破坏了此前的均匀分散体系,导致不能测定其粒径(d,nm)和分散系数(Particle dispersion index,PDI)。因此,本试验设定不同pH值(从酸到碱)来探究不同氨基供体点修饰后对EXTs粒径、PDI和电位的影响。
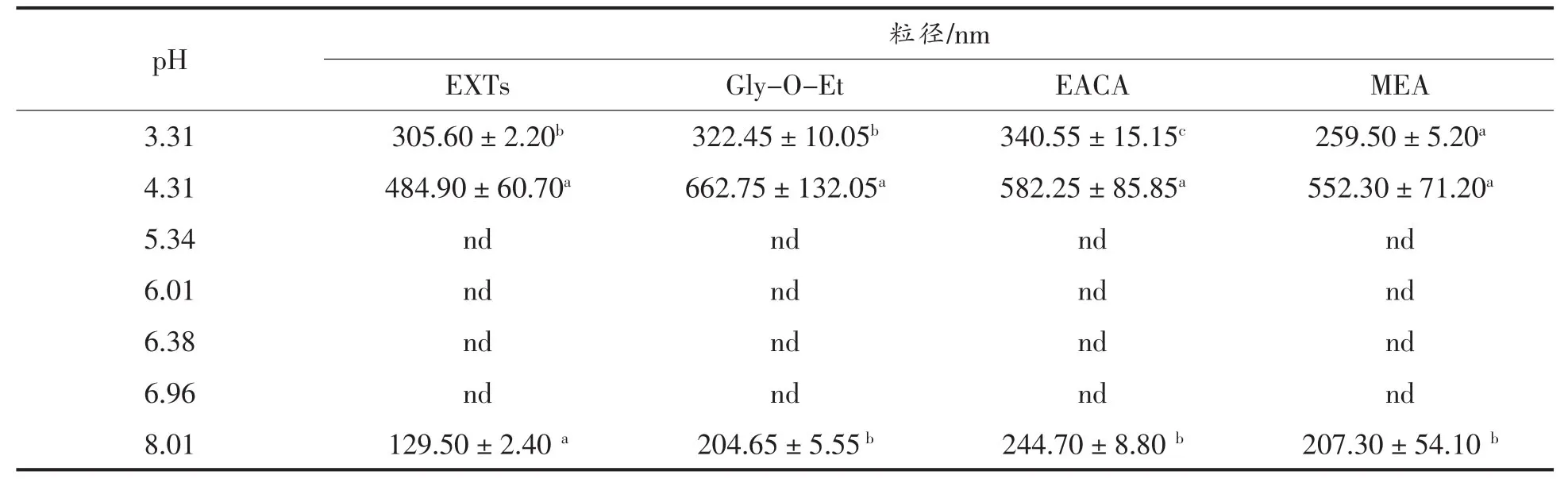
表5 点修饰对粒径的影响Table5 Effect of cross-linking on micro particle radius
由表5可知,空白组及其点修饰产物的粒径在 pH 5.34~6.96时均不可测。当 pH=3.31时,EACA点修饰产物的粒径最大,而MEA点修饰产物的粒径最小。当pH值提高至8.01时,3种氨基供体点修饰后均显著增大了EXTs的粒径,其中EACA点修饰产物粒径最大,而3组点修饰产物间无显著差异。这表明小麦醇溶蛋白粗提物在与MEA发生点修饰反应后,其微粒粒径由碱性条件下最小转变为在酸性条件下最小。
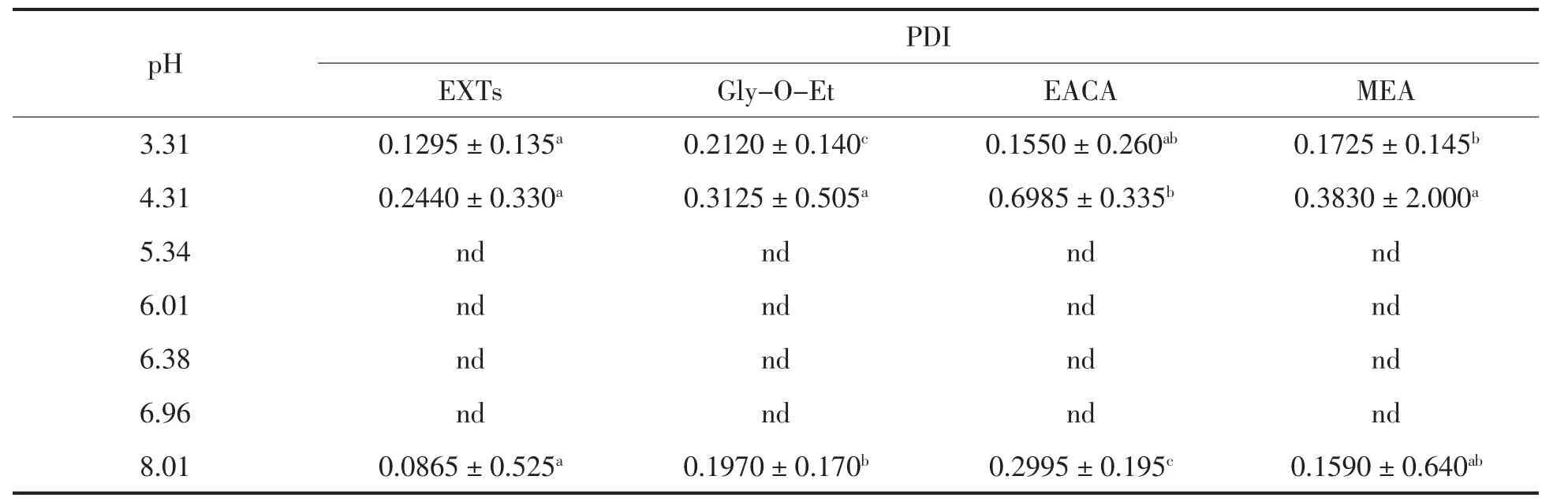
表6 点修饰对PDI的影响Table6 Effect of cross-linking on PDI
由表6可知,当pH 4.31时,EACA点修饰产物的PDI迅速增大,且远高于Gly-O-Et、MEA点修饰产物及空白组。随着溶液体系变为弱碱性(pH 8.01)时,EACA点修饰产物的PDI依然显著高于其它3组。这表明,EACA点修饰显著扩大了EXTs的pI范围。
由表7可知,在pH=3.31和pH=8.01时,EACA点修饰产物的电位均显著小于Gly-O-Et、MEA点修饰产物以及空白组,这表明EACA点修饰后会削弱底物的静电排斥作用,影响其pI,从而降低产物的乳化稳定性。在相应的酸性条件下,MEA点修饰产物电位显著小于空白组,而在碱性条件下,其电位与空白组无显著差异,这说明引入羧基可能并不会增加,甚至可能减弱了底物的静电相互作用。
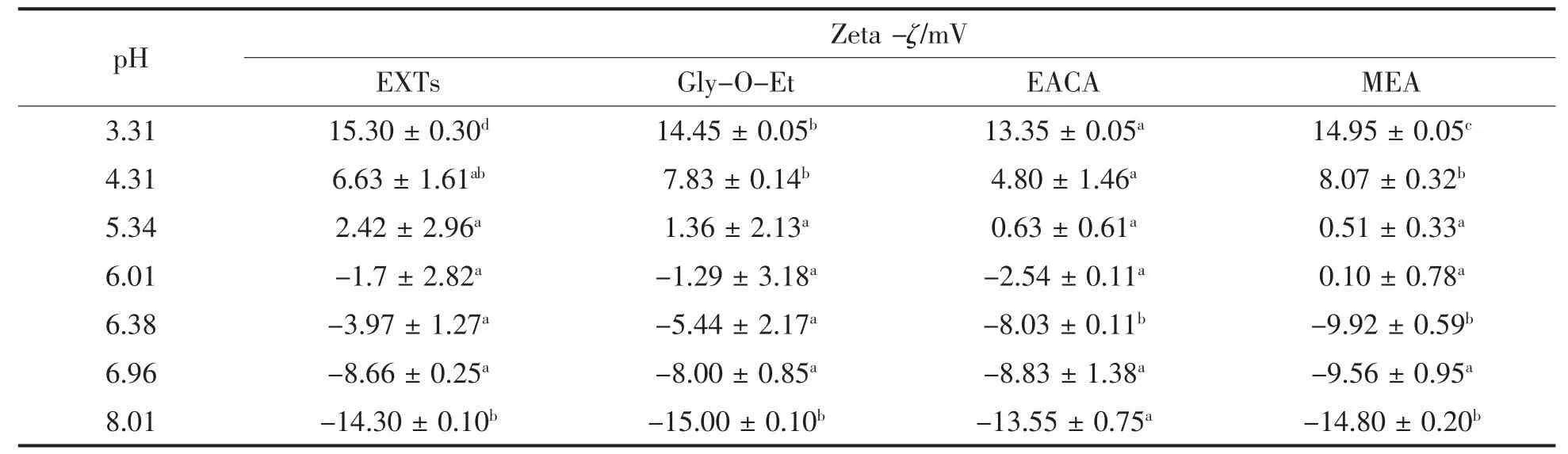
表7 点修饰对电位的影响Table7 Effect of cross-linking on Zeta-ζ,Zeta-ζrefers to Zeta-potential
2.3.3 接触角测定 三相接触角(θ)是衡量颗粒表面润湿性的直观数据,是制备Pickering乳液固体微粒的重要指标。当θ≈90°时,颗粒吸附能最大,对应Pickering乳液最稳定[25-26]。由图3可知,3种氨基供体点修饰后,产物的接触角均显著增大,且EACA点修饰产物的接触角最大,高达(91.77±1.42)°,其次是MEA、Gly-O-Et。这表明与 Gly-OEt和MEA相比,EACA点修饰反应有效改善了小麦醇溶蛋白粗提物颗粒的表面润湿性,这种差异出现的原因可能是EACA在MTGase催化的点修饰反应过程中随机地或有选择性地与一些亲水或疏水性蛋白片段位点结合,从而直接影响了产物的亲水或疏水性。
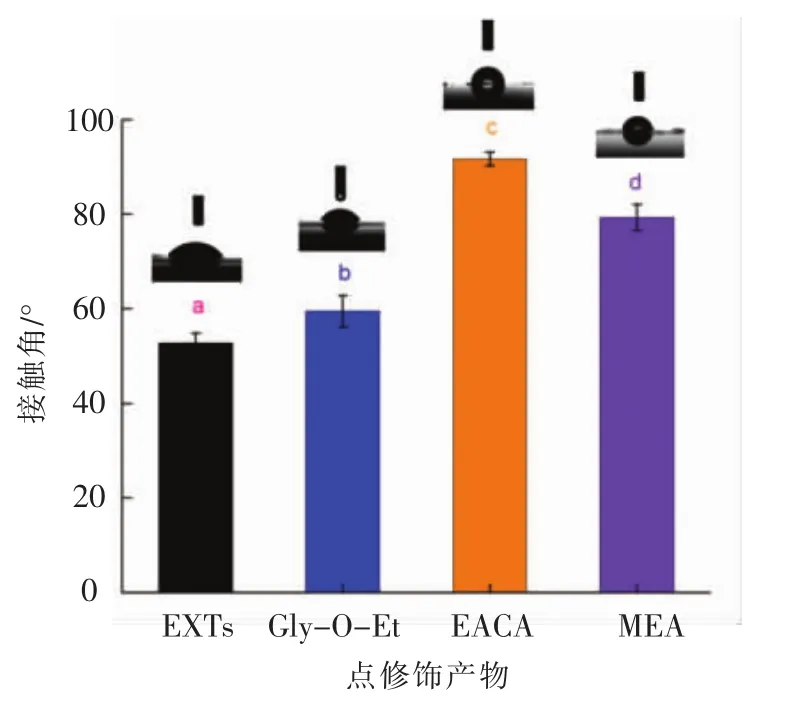
图3 点修饰对接触角的影响Fig.3 Effect of cross-linking on contact angles
3 结论
通过乙醇提取法和等电点沉淀法相结合并辅以超声处理的方法,得到小麦醇溶蛋白最优的提取结果:添加60%乙醇和5mmol/L柠檬酸缓冲液,并超声29.67min。以提取获得的小麦醇溶蛋白粗提物为底物,利用胃蛋白酶进行水解,以水解不同时间的粗提物为底物,进行MTGase点修饰反应,结果发现Gly-O-Et与未水解EXTs微粒悬浊体系点修饰反应2 h时,对应产物的乳化稳定性显著提高;EACA与未水解产物点修饰4 h时,对应乳化稳定性相对较高;MEA与未水解产物交联2 h时的产物其乳化稳定性最好。
受水解时间、氨基供体和点修饰时间的影响,点修饰对水解粗提物的乳化稳定性影响较为复杂。然而,点修饰对粗提物乳化稳定性的影响小于水解时间的影响。同时,受酰基供体基团的不同,点修饰反应前、后粗提物的热稳定性不同,对粗提物的粒径和电位造成的影响有限,而基于吸附能和三相接触角的关系,EACA点修饰产物对应的乳液符合制备Pickering固体微粒的要求。
本研究以小麦醇溶蛋白粗提物及其酶解产物为底物,利用3种不同氨基供体调控MTGase进行点修饰改性来提高其乳化稳定性,并从多角度探究点修饰对EXTs物理化学特性的影响,为扩大小麦醇溶蛋白在食品工业领域中的应用提供一定的论据。
