桑黄原生质体的制备与再生*
2020-01-15孙婷婷王世新王旭彤刘增才马伊莎
孙婷婷,王世新,王旭彤,刘增才,马伊莎,邹 莉**
(1.哈尔滨学院 食品工程学院,黑龙江 哈尔滨 150086;2.东北林业大学 林学院,黑龙江 哈尔滨 150040)
桑黄(Phellinus igniarius)是一种珍稀的药用真菌,含有多种活性成分,如多糖、三萜、黄酮等[1-5],在抗肿瘤、保肝护肝、降血糖、治疗炎症、抗衰老及增强机体免疫力等方面具有很高的药用价值[6-11]。目前在生物抗癌领域中,桑黄已被公认为防癌、抗癌效果最好的高等真菌之一。在韩国和日本的医药行业中,已广泛使用桑黄治疗及预防各类癌症的发生。
桑黄属于多年生真菌,生长周期长,生物学特性复杂[12],加之其人工栽培尚不成规模,因此导致市售桑黄子实体的价格昂贵、供不应求。此外,液体发酵生产桑黄菌丝过程中仍存在产量和质量不稳定、菌种易退化等问题,因此选育出性状优良、高产的桑黄菌株对其进一步开发利用具有重要意义[13]。桑黄的杂交育种工作由于缺少稳定遗传的分子标记且遗传背景复杂而进展缓慢。目前,作者所在课题组完成了桑黄的转录组测序,并对其进行了深入分析,为桑黄的分子遗传学和功能基因组研究提供数据支持[14]。
制备优质高产的原生质体不仅是分子遗传学研究的关键步骤,同时也是菌株诱变、融合育种、基因转化等操作的基础和前提,因此建立稳定高产的原生质体制备技术尤为重要[15]。近年来,桑黄原生质体制备和再生优化体系的建立鲜有报道。本研究采用桑黄菌株DL101 作为试验材料,详细、系统地探讨了桑黄原生质体的制备与再生条件,优化各试验因素,尽可能获得更多的优良原生质体,旨在为桑黄后续的分子遗传转化、基因编辑及菌种改良打下基础。
1 材料与方法
1.1 供试菌株及试剂
供试菌株桑黄DL101 保存于东北林业大学林学院森林保护试验室。溶壁酶购自广东微生物研究所;崩溃酶购自Sigma 公司;葡萄糖、甘露醇、无水硫酸镁、氯化钠、琼脂等均为国产分析纯。
1.2 培养基
1.2.1 基础培养基
PD 培养基:每升培养基中含有马铃薯(去皮)200 g、葡萄糖20 g。
PDA 培养基: 每升培养基中含有马铃薯(去皮)200 g、葡萄糖20 g、琼脂粉15 g~18 g。
1.2.2 再生培养基
PDA+甘露醇再生培养基:在上述基础培养基PDA 中加入甘露醇109.30 g·L-1。
PDA+硫酸镁再生培养基:在上述基础培养基PDA 中加入无水硫酸镁72.22 g·L-1。
PDA+氯化钠再生培养基:在上述基础培养基PDA 中加入氯化钠35.06 g·L-1。
1.3 菌丝培养
将培养8 d 的桑黄菌丝PDA 平板,用打孔器打出菌饼后接种于200 mL PD 培养基中,25℃、180 r·min-1振荡培养5 d,用无菌纱布过滤,并用无菌水冲洗2 次~3 次,收集菌丝,置于新鲜PD 培养基中,4℃冰箱保存备用。
1.4 原生质体的制备
称取上述适量湿菌丝于2 mL 离心管中,4 000 r·min-1离心5 min,弃去上清液,再用0.6 mol·L-1甘露醇渗透压稳定剂溶液洗涤、离心2 次,条件同上,获得干净的菌丝0.1 g,然后加入 1 mL 酶液,26℃~34℃水浴酶解2.0 h ~4.0 h,每隔0.5 h 对酶解液颠倒混匀数次。吸取10 μL 酶解液,血球计数板计数,镜检破壁情况。
1.4.1 单因素试验
按照上述方法, 首先分别考察不同的酶浓度(1.0%溶壁酶、1.5%溶壁酶、2.0%溶壁酶、2.5%溶壁酶、3%溶壁酶)、不同的酶系统(0.5%崩溃酶+溶壁酶、1.0%崩溃酶+溶壁酶)对原生质体得率的影响。然后在确定酶系统的基础上再分别考察不同的酶解温度(26℃、28℃、30℃、32℃、34℃)、不同的酶解时间(2.0 h、2.5 h、3.0 h、3.5 h、4.0 h)对原生质体得率的影响。
1.4.2 响应面优化试验
采用响应面法对桑黄原生质体的制备条件进行优化。根据单因素试验结果, 利用Box-Behnken 设计试验,自变量选取酶解温度(A),分别设为28℃、30℃、32℃;酶解时间(B),分别设为2.5 h、3.0 h、3.5 h;溶壁酶的浓度(C),分别设为1.5%、2.0%、2.5%,因变量即响应值选取原生质体的得率(Y)建立回归方程,Box-Behnken 设计方案及原生质体的产量结果,见表1,试验点共计 17 个,其中分析点12 个,零点5 个。
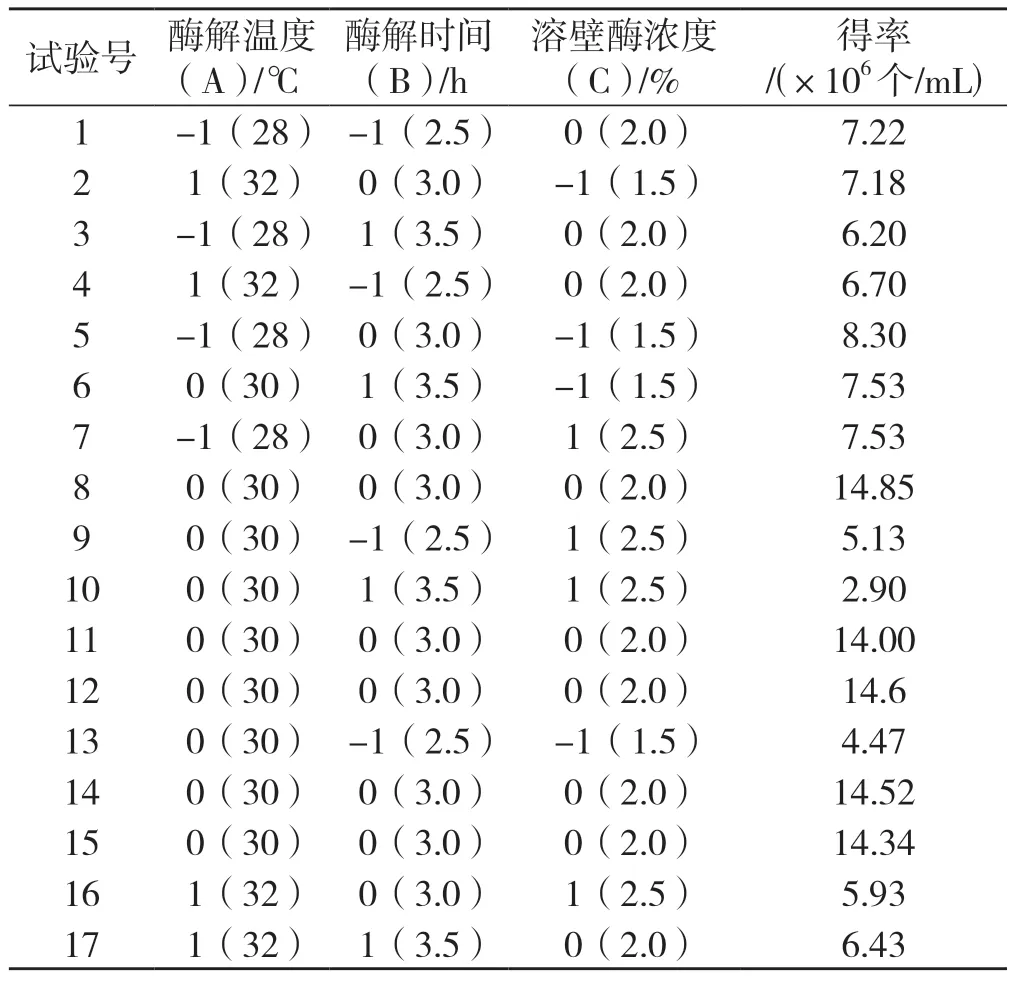
表1 Box-Behnken 设计方案及结果Tab.1 The design matrix and results of Box-Behnken experiment
1.5 原生质体的再生
将酶解液用无菌的G3 砂芯漏斗过滤,除去残留菌丝,4 000 r·min-1离心10 min,去上清液,用渗透压稳定剂洗涤2 次,将原生质体用渗透压稳定剂制成悬浮液,在显微镜下用血球计数板计数。然后将得到的原生质体悬浮液稀释至105个/mL,取100 μL 分别涂布于PDA+甘露醇再生培养基、PDA+硫酸镁再生培养基、PDA+氯化钠再生培养基和PDA 培养基(对照),置于25℃条件下再生培养,菌落计数。
再生率的计算:将制备的原生质体分α 组、β组进行再生对比试验,α 组用渗透压稳定剂配制再生培养基,β 组用纯水配制再生培养基进行再生,每组设3 次重复, 待菌落长出后分别计数, 取平均值,按下述方法计算再生率。再生率(P,%)公式为:
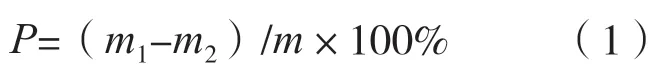
式中:m1表示α 组再生菌落数;m2表示β 组再菌落数;m表示原生质体总数。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶浓度及酶系统对桑黄原生质体制备的影响
溶壁酶作用于菌丝体的细胞壁,将致密、完整的细胞壁结构瓦解,释放出一个个球状的原生质体,如图1 所示。不同浓度的溶壁酶作用效果不同,见图2。
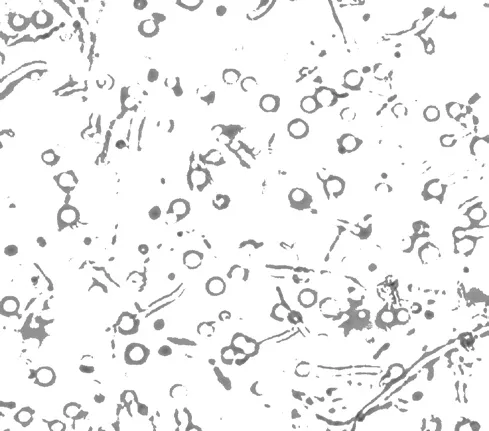
图1 桑黄原生质体(10×40)Fig.1 Protoplast of Phellinus igniarius(10×40)
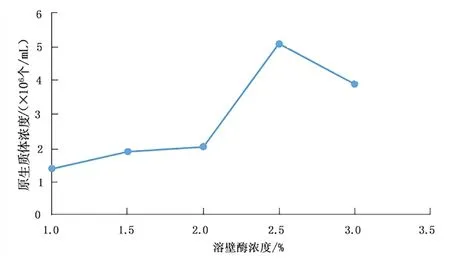
图2 溶壁酶浓度对桑黄原生质体制备的影响Fig.2 Effects of lywallzyme concentration on protoplast preparation of Phellinus igniarius
由图1、图2 可以看出,在一定范围内,溶壁酶的浓度越高,释放出的原生质体越多,超过一定范围,溶壁酶的浓度增加,原生质体的数目减少。原因可能是溶壁酶对于原生质体有一定的伤害作用,当溶壁酶的浓度在2.5%以内时,随着浓度增加,原生质体释放的速率大于原生质体被破坏的速率,故原生质体浓度不断增加,超过这个范围,原生质体被破坏的速率大于原生质体释放的速率,故原生质体浓度降低。当溶壁酶浓度为2.5%时,原生质体得率最高,为5.1×106个/mL。
许多研究表明制备原生质体时,使用复合酶液的效果大于单一酶液。本试验采用不同浓度的崩溃酶和溶壁酶的组合,研究其对桑黄原生质体制备的影响,结果如图3 所示。

图 3 不同浓度的崩溃酶和溶壁酶的组合对桑黄原生质体制备的影响Fig.3 Effects of different combinations of driselase and lywallzyme on protoplast preparation of Phellinus igniarius
结合图2,由图3 可以发现崩溃酶与溶壁酶的复合酶液的作用效果确实优于单一的溶壁酶,使用复合酶液,桑黄原生质体得率最高可达到107个/mL,远大于单独使用溶壁酶的作用效果。从图3 中可以发现,1.0%崩溃酶与低浓度的溶壁酶组合的效果优于0.5%崩溃酶与低浓度的溶壁酶组合的效果,而在高浓度的溶壁酶区域,0.5%崩溃酶的辅助效果优于1.0%崩溃酶的辅助效果。在复合酶液中,0.5%崩溃酶和2.0%溶壁酶的组合最好,原生质体得率最高可达1.49×107个/mL。
2.1.2 酶解温度对桑黄原生质体制备的影响
温度不同,酶活性不同,温度是影响酶活的重要因素。温度也会影响菌丝体的生理状况。不同真菌的最适酶解温度不同。在上述选定的酶系统和酶浓度的条件下,研究不同的酶解温度对桑黄原生质体制备的影响, 结果如图4 所示。
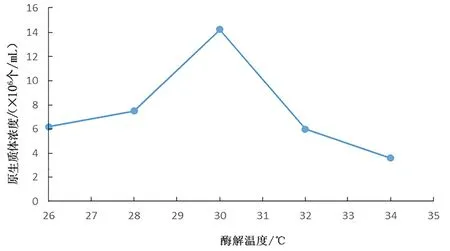
图 4 酶解温度对桑黄原生质体制备的影响Fig.4 Effects of enzymolysis temperature on protoplast preparation of Phellinus igniarius
从图4 中可以看出,酶解温度对桑黄原生质体的制备有较大影响。在一定程度上,酶解温度的升高导致桑黄原生质体得率不断增加,当酶解温度为30℃时,桑黄原生质体得率为1.43×107个/mL,达到最高;当酶解温度超过30℃,桑黄原生质体得率不断降低。
2.1.3 酶解时间对桑黄原生质体制备的影响
在上述选定的酶系统、酶浓度和酶解温度的条件下,研究不同的酶解时间对桑黄原生质体制备的影响,见图5。

图5 酶解时间对桑黄原生质体制备的影响Fig.5 Effects of enzymolysis time on protoplast preparation ofPhellinus igniarius
由图5 可知,原生质体得率随酶解时间的增加先增大后降低。当酶解3.0 h 时,原生质体浓度最高。分析原因可能是酶解时间过短(小于3.0 h),桑黄菌丝酶解不够充分;酶解时间过长(大于3.0 h),则可导致原生质体因酶解过度而破裂,原生质体被破坏的速率大于原生质体释放的速率,故原生质体浓度下降。
2.2 响应面优化试验结果
对表1 中的数据,采用了 Design Expert 8.0.6 软件进行多元回归拟合,以期进一步考察各因素及其交互作用对桑黄原生质体制备的影响,得出桑黄原生质体浓度(Y)对酶解温度(A)、酶解时间(B)、酶系统中溶壁酶浓度(C)的二次多项回归模型方程为:
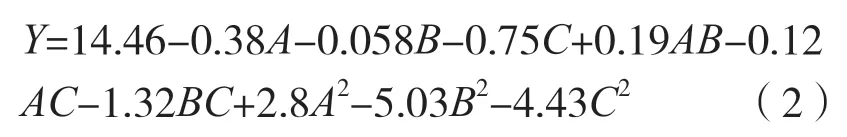
回归方程显著性检验见表2。
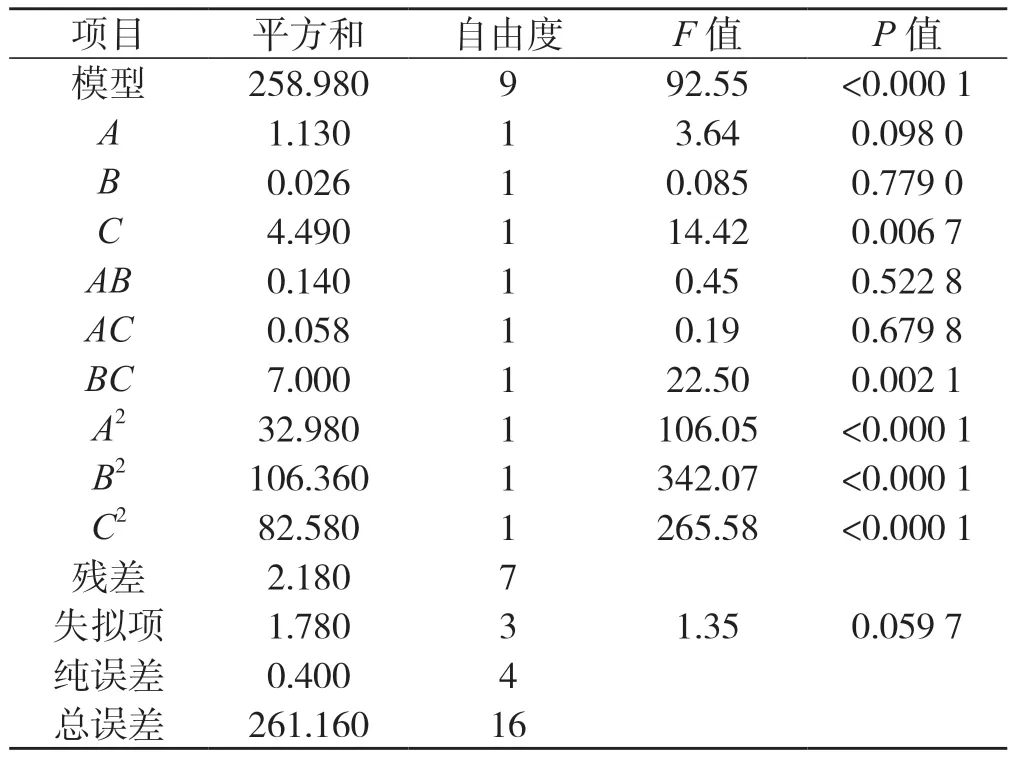
表2 回归方程显著性检验Tab.2 Test of the significance of the regression equation
从表2 可以看出,模型的F=92.55、P<0.000 1,表明模型对桑黄原生质体制备的影响显著。R2=0.991 7,RSD=6.44,R2adj=0.981 0,可知模拟程度和模型相关度良好,且误差较小。通常采用F检验来判定各变量对响应值影响的显著性,如P值越小,则表示变量的显著性越高。由表2 可知,方程中C、BC、A2、B2、C2影响较为显著,结果表明试验因子的交互作用对响应值的影响相对较小,不是简单的线性关系,二次项对响应值也有较大的影响,这和模型回归中的平方项影响显著相对应。
采用 RSM 研究各因子对桑黄原生质体制备的影响,并结合 Box-Behnken 做响应面图,以考察溶壁酶的浓度、酶解温度与酶解时间的交互作用对桑黄原生质体制备的影响,进而优化桑黄原生质体的制备条件。不同因素间交互作用的 3D 响应曲面见图 6~图8 所示。

图6 酶解温度与酶解时间的交互作用对桑黄原生质体制备的影响Fig.6 Effects of interaction between enzymolysis temperature and enzymolysis time on protoplast preparation of Phellinus igniarius
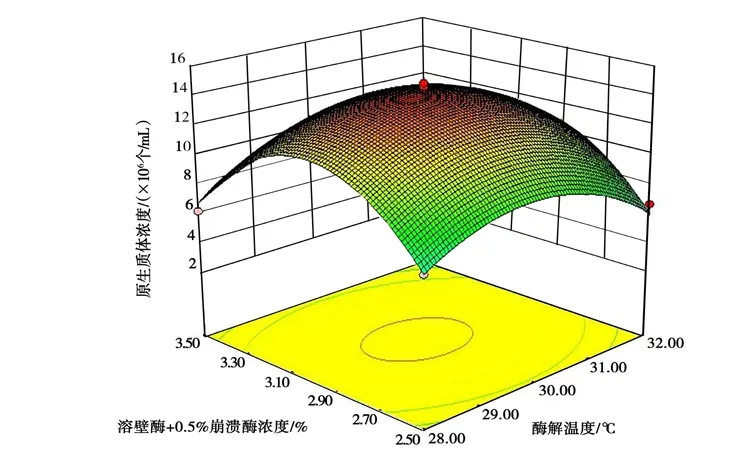
图 7 溶壁酶浓度与酶解温度的交互作用对桑黄原生质体制备的影响Fig.7 Effects of interaction between lywallzyme concentration and enzymolysis temperature on protoplast preparation ofPhellinus igniarius
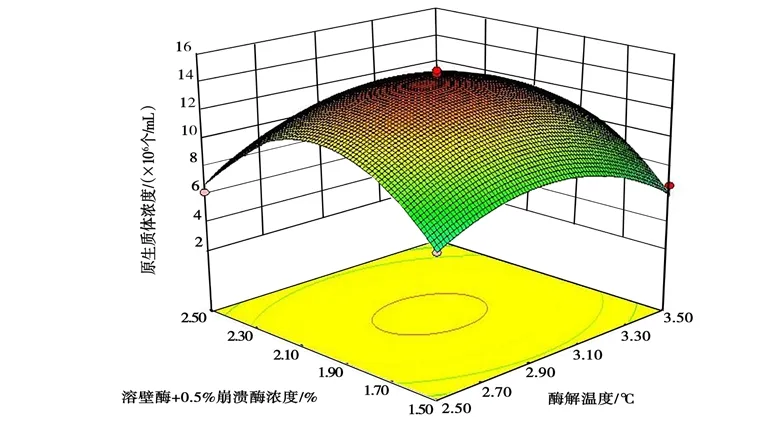
图8 溶壁酶浓度与酶解时间的交互作用对桑黄原生质体制备的影响Fig.8 Effects of interaction between lywallzyme concentration and enzymolysis time on protoplast preparation of Phellinus igniarius
从图6~图8 中可以清楚地看出,有关各因子之间交互作用的3D 图。结果表明,试验范围内存在极值,不仅作为响应面的最高点,也是等值线最小椭圆的中心点。其中B、C的交互作用较强,当B和C的编码值增大,响应值(Y)却呈减小的趋势(图8),分析原因可能是溶壁酶浓度过大、酶解时间过长,对原生质体造成伤害;溶壁酶浓度过小、酶解时间过短,不能充分酶解菌丝得到原生质体。从图6 中可以看出,A与B的交互作用不强,B(编码值为0 以上)在A一定范围内均可获得较大的响应值,这与ANOVA 分析的结果吻合。图7 中表明,A、C的交互作用也表现出和图6 类似的现象。由SAS 分析得到最大响应值(Y) 时A、B、C对应的编码值分别为29.87℃、3.0 h、2.0%。与其相对应的桑黄原生质体制备的最佳条件为酶解温度29.87℃,酶解时间3.0 h,溶壁酶浓度1.96%,理论最佳原生质体得率为1.45×107个/mL。为检验响应面法的可行性,以最佳制备条件进行桑黄原生质体制备的验证试验,考虑到操作的便利性,以酶解温度30℃、酶解时间3.0 h、溶壁酶浓度2.0%为最佳。最终根据3 次平行试验,获得了实际的桑黄原生质体平均得率为1.43×107个/mL,与理论值相差1.38%。因此,响应面法对桑黄原生质体制备的优化是可行的,得到的桑黄原生质体制备条件具有实际应用价值。
2.3 桑黄原生质体的再生
本试验研究了硫酸镁、甘露醇、氯化钠等3 种渗透压稳定剂对桑黄原生质体再生的影响,按照1.5中的计算方法统计再生结果,再生率分别为0.67%、0.17%和0,桑黄原生质体的再生菌落情况,见图9。
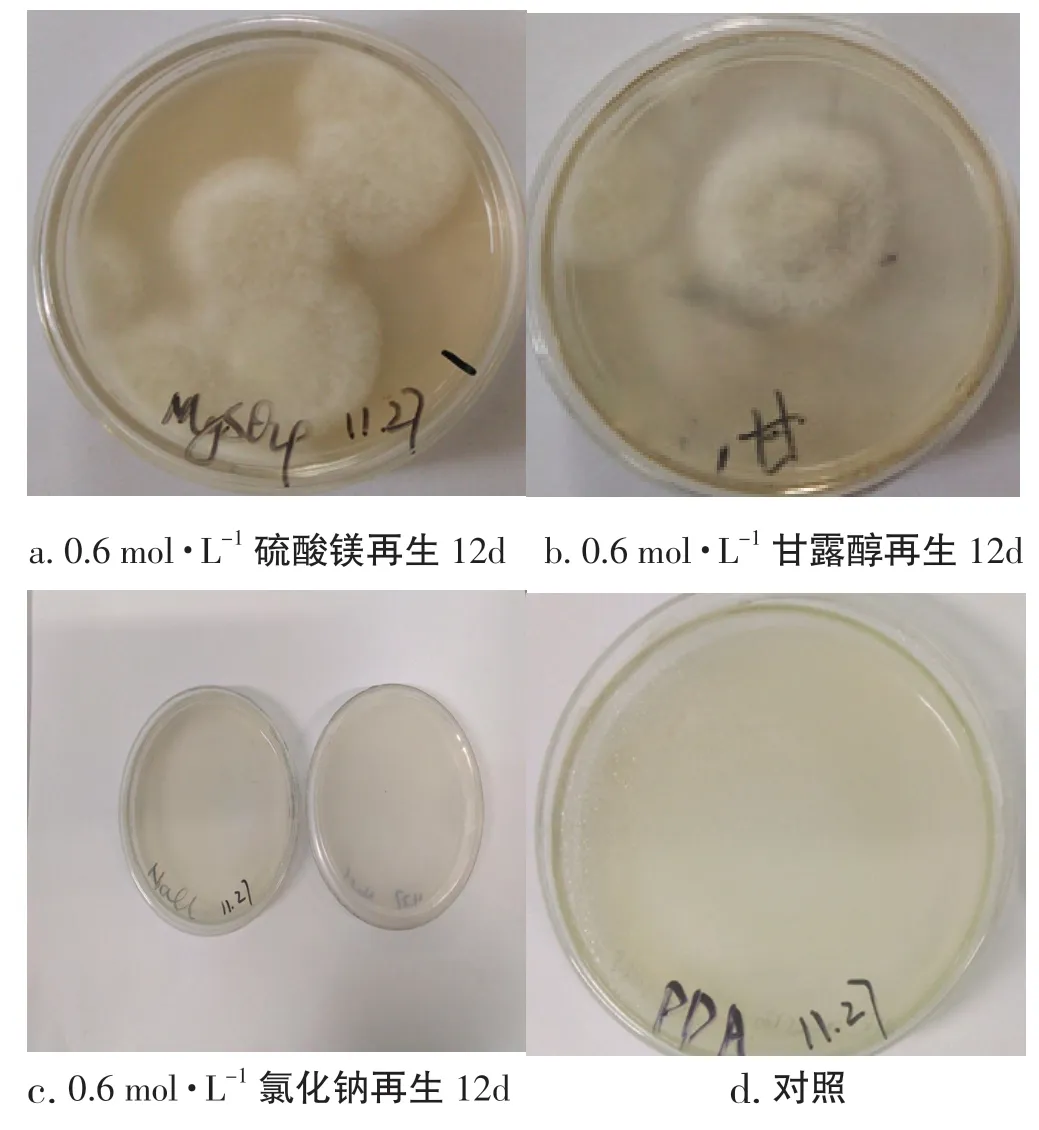
图9 不同渗透压稳定剂对桑黄原生质体再生的影响Fig.9 Effects of different osmotic stabilizer on protoplast regeneration of Phellinus igniarius
从图9 试验结果可以看出,在3 种再生培养基中,添加了硫酸镁的PDA 再生培养基较适于桑黄原生质体的再生,在平板上长出的菌落较多,且长势较强;最差的是添加了氯化钠的PDA 再生培养基,鲜见再生菌落,由此可知,在上述3 种渗透压稳定剂中添加了硫酸镁的PDA 再生培养基较适合桑黄原生质体的再生。
3 讨论
随着桑黄的各种药理活性功能不断被报道,人们对桑黄的需求与日俱增,然而受自身生理生化及环境条件的制约,野生桑黄资源稀缺,且有效药用成分的含量较低,这迫使人们需要通过现代育种技术选育出高产活性成分的桑黄菌株。
原生质体育种是大型真菌改良育种中一种很重要的方法,目前应用较广。因此,获得高质量的原生质体对后期遗传转化尤为重要。自1972 年,裂褶菌原生质体的成功分离后,大型真菌原生质体的制备研究拉开序幕[16]。相关学者的研究表明,原生质体得率的影响因素主要包括酶解温度、酶解时间、酶种类、渗透压稳定剂等[17],其中使用复合酶的效果要好于单一酶[18-22]。
本研究在桑黄原生质体的制备过程中,对酶及酶解条件等因素进行了详细研究,结果表明,使用溶壁酶与崩溃酶的混合酶系进行酶解的原生质体得率高于使用单一的溶壁酶。单因素试验结果展示了各个因素的单独作用对桑黄原生质体制备的影响。低浓度的酶液得到较小的原生质体得率,随着浓度的升高,原生质体得率增加,但过高浓度的酶液会破坏原生质体,使得原生质体被破坏的速率大于原生质体释放的速率,故酶液浓度高时,原生质体得率下降。研究酶解温度、酶解时间时也发现同样的现象。此外,从响应面试验结果分析中可以看出溶壁酶浓度、酶解温度、酶解时间3 个因素对桑黄原生质体制备的影响大小,其中溶壁酶浓度的影响最为显著,其次是酶解温度,最后是酶解时间。
原生质体的制备与再生是2 个相互联系且独立的过程。在桑黄原生质体的制备中,使用了甘露醇作为渗透压稳定剂,而在再生试验中筛选到的最适渗透压稳定剂是硫酸镁,故再生渗透压稳定剂不一定是制备原生质体时的渗透压稳定剂。试验中还发现添加了硫酸镁的PDA 再生培养基在硫酸镁浓度较高(0.6 mol·L-1)时琼脂不易充分溶解,静置后有大量沉淀,造成冷却后培养基不会凝固或者凝固后仍有较大流动性的现象,严重妨碍试验的进行,这点和李刚等[20]的研究一致,但在硫酸镁浓度较低(0.3 mol·L-1)时琼脂可以充分溶解,溶液表现均匀一致,冷却后的培养基也可以很好地凝固。我们在发现琼脂的这一特性后尝试先在1 L 的培养基中溶解琼脂,再加入0.6 mol·L-1硫酸镁,结果发现培养基均匀一致,也可以很好地凝固,解决了李刚等人在使用硫酸镁作为再生渗透压稳定剂时所遇到的培养基不能凝固的问题。
最后,本研究发现桑黄原生质体的再生周期较长,在7 d 以后才能肉眼观察到再生菌落,原因可能是再生培养基的营养不够充分。对于如何加强再生培养基的营养,使桑黄原生质体的再生更加迅速,长出的的菌丝更加健壮,还需要进一步详细研究。
