甜瓜蔓枯病菌原生质体制备及再生体系研究
2021-05-31毛建才王豪杰李俊华翟文强
毛建才,王豪杰,李俊华,翟文强
(新疆农业科学院哈密瓜研究中心,新疆 乌鲁木齐 830091)
0 引言
【研究意义】甜瓜蔓枯病是由子囊菌瓜类黑腐小球壳菌(Didymella bryoniae)引起的是一种土传真菌性病害,是为害甜瓜的主要病害之一,在病害流行时,瓜田减产可达30%以上[1],有报道称甜瓜蔓枯病的危害远大于甜瓜枯萎病等世界性病害[2]。该病可以自然侵染甜瓜、西瓜和黄瓜等葫芦科作物,化学药剂防治难度较大,目前在全国各个甜瓜产区均有分布[3]。由于甜瓜蔓枯病受湿度影响较大,且病原菌寄主范围广、传播途径多样、存活时间长,加之缺乏优良的抗病育种材料,所以该病的防治一直是生产上的难题。在病原菌与寄主植物互作中,病原物会不断进化出强毒力的致病基因来克服寄主的防卫反应,同样寄主植物也会产生相应的手段来抵御病原物的入侵。因此,从分子生物学角度研究甜瓜与蔓枯病菌的互作对开发新的防治方法具有重要意义。高效的遗传转化方法是分子生物学研究的基础[2],为进一步明确甜瓜蔓枯病菌的致病机理,需要建立高效的甜瓜蔓枯病菌遗传转化体系,目前大多数丝状真菌的遗传转化均利用分生孢子作为材料,但甜瓜蔓枯病菌A型菌株在常规培养条件下不产生分生孢子,且研究参与病原菌细胞壁合成的相关功能基因需要利用原生质体细胞壁再生进行鉴定[4],因此研究甜瓜蔓枯病菌原生质体的制备及再生体系对上述工作具有重要意义。【前人研究进展】原生质体是一种有组织且具有细胞全能性的生活物质,它可以在人工操作下进行各种分子生物学操作,如细胞融合、细胞壁及完整的植株再生、高分子和病毒的提取等。CaC12/聚乙二醇(PEG)介导的原生质体转化技术是一种常用的基因功能研究方法,该方法是通过细胞壁降解酶的消化作用去除细胞壁获得原生质体,并通过聚乙二醇(PEG)的作用将外源DNA转化整合到原生质体的过程。自PEG遗传转化法在构巢曲霉(Aspergillus nidulans)中建立以来[5],禾谷镰刀 菌 (Fusarium graminearum)、 刺 盘 孢 菌(Colletotrichum fructicola)[6]、杨 树 腐 烂 病 菌(Cytospora chrysosperma)[7]、 大 丽 轮 枝 菌(Verticillium dahliae)[8]和尖孢镰刀菌(Fusarium oxysporum)等在甘蓝、西瓜、香蕉专化型[9−11]等多种真菌中建立了转化体系。【本研究切入点】尽管CaC12/PEG介导的原生质体遗传转化技术以其操作简便、无需特殊设备等优点已成为丝状真菌和植物中常用的转化方法之一,但原生质体的产量及再生率仍是制约转化是否高效的关键因素之一[6]。影响原生质体制备的条件有很多,如菌丝的菌龄、酶组合、渗透压稳定剂、酶解温度和时间等,但不同物种细胞壁的组分不同,因此不同微生物制备原生质体所需要的条件也不尽相同[12]。【拟解决的关键问题】本研究选用2种不同的酶组合,分别在不同菌龄、不同酶解时间、不同稳定剂及pH条件下进行原生质体的制备和再生体系研究,以期建立高效的甜瓜蔓枯病菌原生质体制备和再生体系。
1 材料与方法
1.1 试验材料
1.1.1 菌株 甜瓜蔓枯病菌A型菌株在新疆农业科学院 哈密瓜研究中心试验地采集并分离、鉴定保存。
1.1.2 主要试剂、培养基 甜瓜蔓枯病病原菌生长培养基为PDA(200 g马铃薯煮沸20 min后,4层纱布过滤,2%葡萄糖,1.5%~2%琼脂,补水至1 000 mL,121 ℃高温高压灭菌20 min),菌丝摇培培养基为CM液体培养基(0.6% 酵母提取物,0.3% 干酪素水解物,0.3% 酸水解酪蛋白,1% 蔗糖),再生培养基为TB3培养基(0.3% 酵母提取物,0.3% 酪蛋氨基酸,20% 蔗糖,0.7% 琼脂)和SR培养基(0.1% 酵母提取物,0.1% 酶水解酪蛋白,1 mol·L−1蔗糖,1.5%琼脂),STC(1.2 mol·L−1山梨醇,10 mmol·L−1Tris-HCl,pH=7.5,50 mmol·L−1氯 化 钙)。Driselase和Lysing enzymes购自Sigma 公司,Miracloth滤布购自美国C albiochem公司。
1.2 试验方法
1.2.1 原生质体制备 将保存的菌株在PDA培养基上活化,26 ℃黑暗培养5 d。用灭菌的接种针从培养基上刮取活化好的蔓枯病菌菌丝,接种到50 mL带有5颗玻璃珠的CM液体培养基中,26 ℃、180 r·min−1条件下培养24~42 h[9],每6 h取样1次。然后,用灭菌的Miracloth滤布收集菌丝体,收集到的菌丝体先用无菌水冲洗3次,然后用渗透压稳定剂再冲洗2次。称取0.5 g冲洗好的菌丝置于50 mL灭菌的三角瓶中(设置3个重复),加入10 mL酶解液(酶解液为20 g·L−1Driselase+8 g·L−1Lysing enzymes,溶剂为0.7 mol·L−1的NaCl,4 ℃,2 000 r·min−1离心10 min后,用0.22 μm微孔滤器除菌),在26~34 ℃、80~200 r·min−1条 件 下 酶 解2~6 h[9,12,13],之 后 继 续 用Miracloth滤布过滤收集原生质体,利用血球计数板计 算原生质体个数,每个处理设置3个重复。
1.2.2 原生质体再生 采用双层覆盖法再生原生质体[9],将收集的原生质体离心浓缩,条件为4 ℃、2 000 r·min−1离心10 min,之后用稳渗液将原生质体含量调至1×106个·mL−1,取0.1 mL上述原生质体溶液分别均匀涂抹在SR、PDA和TB3固体培养基上[8,9,11],上层覆盖55 ℃、0.4%~0.9%琼脂培养基,摇匀覆盖,每个处理设置3个重复;同时,按上述方法取0.1 mL上述含量的原生质体溶液并加入1 mL无菌水,室温静置30 min后分别均匀涂布到SR、PDA和TB3固体培养基上作为对照。将上述平板倒置,在28 ℃恒温条件下培养3~5 d,至平板表面长出小菌落为止。1.2.3 原生质体的保存 用STC溶液纯化收集的原生质体,将其含量调整为2×108个·mL−1,之后加入1/10体积的PEG溶液和1/100体积的DMSO,用移液枪轻轻混匀,分装于100 μL离心管中,−80 ℃冰箱中保存。

2 结果与分析
2.1 原生质体制备
2.1.1 菌丝菌龄对原生质体产量的影响 将菌丝在CM液体培养基中分别培养24、30、36、42、48 h后收集菌丝制备原生质体,结果如图1所示,用于制备原生质体的甜瓜蔓枯病菌菌丝最佳培养时间为36 h左右,此段时间获得的原生质体数量最多,可达6.04×107个·mL−1,培养时间继续延长或缩短,原生 质体产量均有所下降。
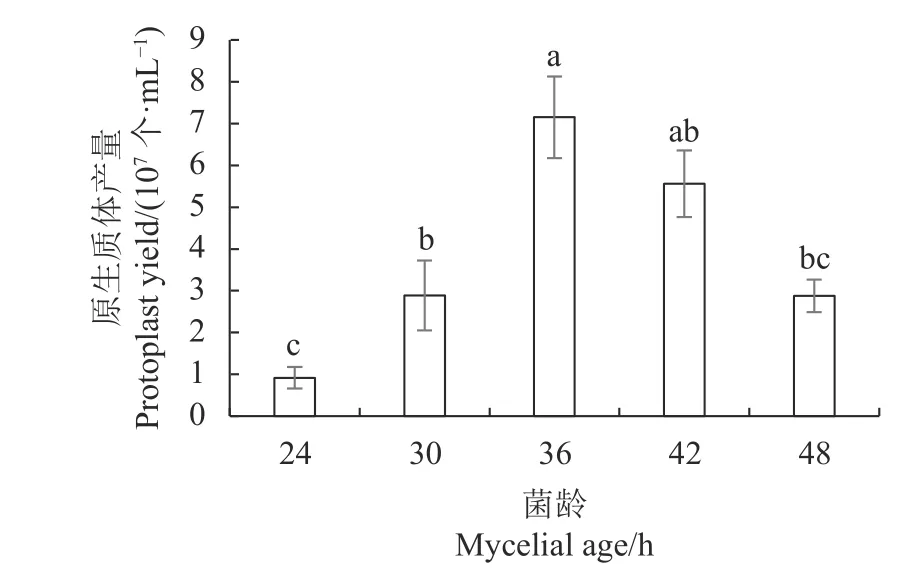
图 1 菌丝菌龄对原生质体产量的影响Fig. 1 Effect of mycelium age on protoplast release by lysis
2.1.2 酶解时间对原生质体产量的影响 在菌丝菌龄统一为36 h的情况下,计算酶解2、3、4、5、6 h原生质体的产量,明确反应时间对原生质体制备的影响。从图2-A可知,酶解4 h之后,原生质体的产量最高,可达8.22×107个·mL−1,酶解时间过长或过短,原生质体的产量均有所下降。但酶促反应的时间在3~5 h,原生质体的产量波动不大,当酶解时间低于2 h或高于5 h,原生质体的产量明显降低,因此 ,甜瓜蔓枯病菌原生质体的最佳酶解时间为4 h。
2.1.3 酶解温度对原生质体产量的影响 酶解温度是影响酶促反应结果的关键因素之一,不同的酶具有不同的最适温度,但是混合酶的最适温度需要测定。在上述确定的最优条件下,设置24、26、28、30、32、34 ℃为酶解温度,探讨温度对原生质体制备的影响。图2-B显示,随着温度的升高,原生质体的产量逐渐增加,温度到达30 ℃时,原生质体的产量最大,为9.65×107个·mL−1,继续提高温度到32 ℃,原生质体的产量略有下降,之后继续提高反应温度,原生质体产量下降明显。因此,该结果说明该酶促反应的最适温度为30 ℃。

图 2 酶解时间和酶解温度对原生质体产量的影响Fig. 2 Effects of enzymatic digestion time and temperature on protoplast release by lysis
2.1.4 不同渗透压稳定剂对原生质体产量的影响 渗透压稳定剂在酶促反应中的作用主要是维持原生质体细胞内外压力平衡和影响裂解酶的活性,从而最终影响原生质体的数量。在酶浓度、酶解时间和温度统一的标准下,采用0.7 mol·L−1的NaCl、KCl、山梨醇和蔗糖分别作为稳渗液[12,14],统计甜瓜蔓枯病菌原生质体的产量。结果如图3-A所示,利用NaCl作为该酶促反应的渗透压稳定剂原生质体的数量最多,可达9.16×107个·mL−1,其次是KCl溶液。
将NaCl的浓度依次设置为0.5、0.6、0.7、0.8、0.9 mol·L−1,明确不同浓度的NaCl渗透压稳定剂对甜瓜蔓枯病菌原生质体制备的影响。由图3-B可知,利用0.7 mol·L−1的NaCl溶液作为渗透压稳定剂,原生质体的产量最多,为8.86×107个·mL−1,浓度过大或过小,均不利于原生质体的释放。上述结果说明0.7 mol·L−1的NaCl溶液可以作为甜瓜蔓枯病菌 原生质体制备过程中适宜的渗透压稳定剂。

图 3 渗透压稳定剂对原生质体产量的影响Fig. 3 Effect of osmotic stabilizer on protoplast release by lysis
2.1.5 pH对原生质体产量的影响 渗透压稳定剂环境的pH值是影响酶活的一个主要因素。在上述最优条件下,将渗透压稳定剂的pH设置为4、5、6、7、8、9[7],比较不同pH条件下甜瓜蔓枯病菌原生质体的释放情况,结果如图4-A,当pH值为7时,原生质体的产量最高,可达8.58×107个·mL−1,pH值增加或者减小,原生质体的数量都会下降,由此结果可知,pH值为7时,是甜瓜蔓枯病菌制备原生质体过 程中的最佳pH。
2.1.6 转速对原生质体产量的影响 酶解过程中匀速震荡酶解液是为了使裂解酶与菌丝体充分接触,有利于加快酶促反应的进程,保持其他最优条件不变,分别设定转速为80、100、120、140、160、200 r·min−1,计算转速与原生质体的数量关系。图4-B显示,随着摇培转速的增加,原生质体的释放速率也在加快,转速为140 r·min−1时,原生质体的产量到达峰值,为9.60×107个·mL−1,转速在120~140 r·min−1时,原生质体的生成速率波动不大。当转速超过160 r·min−1时,原生质体的产量下降且破碎的原生质体增多,因此确定原生质体制备摇培过程中最佳转速 为120~140 r·min−1。

图 4 p H和转速对原生质体产量的影响Fig. 4 Effects of p H and rotational speed on protoplast yield in lysis
2.2 原生质体再生
2.2.1 不同再生培养基对原生质体再生率的影响 原生质体的再生能力是衡量获得的原生质体质量最关键的指标,是评价原生质体是否有利用价值并进行下一步遗传转化的基础。分别以PDA、SR和TB3这3种固体培养基作为甜瓜蔓枯病菌原生质体的再生培养基,评价在该体系中制备的原生质体的再生率。图5-A显示,蔓枯病菌原生质体在SR、PDA和TB3再生培养基生的再生率分别是22.53%、14.78%和22.38%,由此得知,SR和TB3培养基二者差异不显著,在试验中均可用来高效再生蔓枯病菌原生质体。
以SR培养基作为再生培养基,明确上层覆盖培养基的琼脂含量对原生质体再生率的影响。在试验中发现,当琼脂含量低于0.5%时,培养基不易凝固,覆盖后影响原生质体的再生率,覆盖培养基琼脂含量在0.5%~0.6%时,原生质体的再生率较高,分别是19.00%和19.67%,二者差异不显著;琼脂含量高于0.6%时,再生率下降(图5-B)。从上述结果可知,双层覆盖法中上层覆盖培养基的琼脂含量对甜瓜蔓枯病菌原生质体再生具有明显影响,覆盖培养基的琼脂含量为0.5%~0.6%时,原生质体再生率最高。

图 5 不同再生培养基对原生质体再生率的影响Fig. 5 Effects of medium and agar concentration on protoplast regeneration rate
2.2.2 酶解时间对原生质体再生的影响 在甜瓜蔓枯病菌原生质体制备过程中,酶解时间的长短直接影响原生质体的产量(图2-A),酶解时间过短细胞壁不能被完全酶解,酶解时间过长又会破坏原生质体的完整性。为了明确酶解时间是否也影响原生质体的再生率,在上述确定的条件下再生原生质体,结果如图6-A所示,酶解时间不同,原生质体的再生率也不同,酶解4 h,原生质体的再生率最高,可达19.30%,酶解时间超过4 h后,再生率逐渐下降。因此,酶解时间的长短会影响原生质体的再生率,综合原生质体的释放和再生率,甜瓜蔓枯病菌原生质 体的最佳酶解时间是4 h。

图 6 酶解时间和存放时间对原生质体再生率的影响Fig. 6 Effects of enzymatic digestion time and storage time on protoplast regeneration rate
2.2.3 原生质体的保存时间与再生率的关系 将制备的原生质体分别保存在−80 ℃冰箱中2、4、6、8、10、12、14 h,之后取出解冻利用SR培养基再生,明确保存时间对再生率的影响。由图6-B可知,随着存放时间的延长原生质体的再生率下降明显,并且表现为初期下降较为明显,存放10 h之后,下降趋 势逐渐平缓,最终维持在10%左右。
3 讨论与结论
优化和完善原生质体的制备和再生体系,是建立甜瓜蔓枯病菌高效遗传转化系统的必要条件之一。从本质上讲,原生质体的制备过程是一个酶促反应,影响酶促反应的因素主要有酶浓度、酶解时间、温度和酶解体系的环境等,本研究探讨甜瓜蔓枯病菌原生质体制备和再生的适宜条件,为进一步开展甜瓜蔓枯病菌功能基因研究提供技术支持。
菌龄不同的细胞,其细胞壁的薄厚程度和结构也不尽相同。菌丝培养时间过短,细胞壁比较幼嫩,形成的原生质体大小不一,释放后更容易被破坏;菌丝培养时间过长,组织老化,产生对降解酶耐受的结构,不容易被降解,原生质体的产量反而下降[14],因此,要选择合适菌龄的菌丝体才能制备出高效的原生质体。张婷[15]研究发现,黑曲霉(Aspergillus niger)在培养4 d时收集菌丝制备的原生质体数量最多;大丽轮枝菌的分生孢子在YPED培养基中摇培18 h产生的菌丝最适宜制备高效的原生质体[8],而马铃薯晚疫病菌的最佳菌龄是18 d[16]。不同病原真菌的最佳菌龄各不相同,本研究明确了甜瓜蔓枯病菌制备原生质体的最佳菌龄是36 h。
不同病原真菌细胞壁的组分与结构不尽相同,因此所需的裂解酶也不同。陈孝仁等[17]研究发现使用Driselase和Lysing enzyme两种混合酶可产生较多的原生质体,杨树腐烂病菌的原生质体制备过程中,利用这两种混合酶也能产生较多的原生质体[7],本研究中利用20 g·L−1Driselase和8 g·L−1Lysing enzymes两种混合酶也能起到较好的酶解作用。影响酶促反应的另一个关键因素就是温度和时间,温度过高或过低,均不利于酶促反应,一般单一的裂解酶其最适工作温度都是固定的,但是混合酶的最适温度就需要测定,本试验中,这两种混合酶的最适酶解温度是30 ℃。酶解时间的长短也直接影响原生质体的数量和质量,由于菌丝的菌龄不可能完全一致,在酶解过程中,幼嫩的菌丝首先被酶解释放出原生质体,随后较老的菌丝才开始产生原生质体,所以随着酶解时间的延长,原生质体的产量不断增加,但时间超过达到4 h后,甜瓜蔓枯病菌原生质体的数量开始下降。这可能是由于先释放出的原生质体长时间暴露在酶液中,酶液中蛋白酶对原生质体膜造成损害而导致原生质体破裂[7−8]。
渗透压稳定剂不仅是维持原生质体活力的重要因素,也是发挥酶活性的重要场所,常用的渗透压稳定剂主要是有机类化合物和无机盐溶液,赵小强[8]的研究发现大丽轮枝菌制备原生质体的最佳渗透压稳定剂是1.2 mol·L−1的KCl溶液,根据姚婷婷[18]的研究,利用山梨醇作为渗透压稳定剂黑曲霉(Aspergillus niger)原生质体的产量最高,伏建国[14]研究认为0.7 mol·L−1的NaCl溶液是链格孢菌(Alternaria alternata)的最佳渗透压稳定剂,本研究选用0.7 mol·L−1的NaCl作为渗透压稳定剂,原生质体的产量最高。
原生质体的再生能力是衡量获得的原生质体质量最关键的指标,而选择合适的再生培养基可以有效提高原生质体的再生率。在甘蓝枯萎病菌中,利用SR培养基再生原生质体再生率可达21.13%[9],大丽轮枝菌中SR培养基比PDA更有利于原生质体的再生[8]。本研究通过对甜瓜蔓枯病菌原生质的再生发现,SR和TB3培养基对原生质体的再生率为22.53%和22.38%,均能作为甜瓜蔓枯病菌原生质的再生培养基。
