磷脂酶D的纯化及催化制备磷脂酰丝氨酸研究
2020-01-14夏禹,张涛,江波
夏 禹,张 涛,江 波
(江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122)
磷脂酰丝氨酸作为一种新资源食品,具有改善阿尔茨海默病、治疗抑郁症和缓解精神压力等作用[1-9],市场前景十分广阔。随着人们生活节奏的加快,生活压力加大,再加上我国逐渐步入老龄化社会,未来人们对磷脂酰丝氨酸的需求也会越来越大,实现其大规模工业化生产也变得更加重要。
目前市售的磷脂酰丝氨酸产品大多是从豆类或动物肝脏组织中提取的,成本较高,安全性也存在问题[10-11]。利用磷脂酶D酶法制备磷脂酰丝氨酸具有条件温和、产品得率高和生产成本低等优点[12],具有重要的研究和生产价值。酶法合成磷脂酰丝氨酸主要取决于起催化作用的磷脂酶D,但目前市售的磷脂酶D主要是从植物中提取,种类少、转酯活力低、价格高,限制了磷脂酶D的应用。
本文通过对广岛链霉菌所产磷脂酶D进行纯化,并将其用于制备磷脂酰丝氨酸,以期为磷脂酶D和磷酯酰丝氨酸的工业化生产打下基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株与试剂
广岛链霉菌SK43.001-11,由本实验室诱变筛选获得;L-丝氨酸、蛋黄卵磷脂、乙醚、乙酸乙酯、石油醚、三氯甲烷、二氯甲烷、环己烷等,购自国药化学试剂有限公司;磷脂酰胆碱(PC)、磷脂酰丝氨酸(PS)标准品,购自西格玛奥德里奇贸易有限公司;甲醇、异丙醇、正己烷、三乙胺均为色谱纯。
1.1.2 仪器与设备
HYL-B型恒温摇床,AKTA avant 25、AKTA purifier 10蛋白纯化系统,Waters1525型高效液相色谱仪,ELSD3300蒸发光散射检测器。
1.1.3 培养基
斜面培养基:葡萄糖15 g/L,麦芽糖10 g/L,酵母提取物2 g/L,琼脂20 g/L,pH 7.0~7.4,115℃灭菌30 min。
种子培养基:葡萄糖10 g/L,酵母提取物20 g/L,蛋白胨5 g/L,K2HPO4·3H2O 2 g/L,MgSO4·7H2O 0.5 g/L,pH 7.0~7.4,115℃灭菌30 min。
发酵培养基:葡萄糖10 g/L,牛肉浸膏5 g/L,蛋白胨5 g/L,K2HPO4·3H2O 2 g/L,MgSO4·7H2O 0.5 g/L,pH 7.0~7.4,115℃灭菌30 min。
1.2 实验方法
1.2.1 粗酶液制备
(1)斜面制备:将广岛链霉菌SK43.001-11接种于试管斜面,28℃培养7 d。
(2)种子液制备:从斜面上用接种环挑取1环单菌落接入种子培养基中,装液量50 mL/250 mL,在28℃、200 r/min的摇床中培养1.5 d。
(3)发酵培养:按4%的接种量将种子液接种于发酵培养基中,装液量50 mL/250 mL,在28℃、200 r/min的摇床中发酵培养7 d。
(4)粗酶液制备:将发酵液于4℃、6 000 r/min离心20 min,弃去沉淀,取上清液经0.45 μm滤膜过滤,滤液即为粗酶液。
1.2.2 粗酶液的纯化
向粗酶液中加入硫酸铵至体系饱和度为40%,4℃静置2 h后,离心除去沉淀,再向上清中加入硫酸铵至体系饱和度达到60%,4℃静置2 h后,离心收集沉淀,复溶于柠檬酸-柠檬酸钠缓冲液(50 mmol/L,pH 5.0)中,4℃透析脱盐。将透析液上样于Hitrap SP HP阳离子交换柱,用含1 mol/L NaCl的同种缓冲液进行梯度洗脱,测定各洗脱峰的酶活,收集有磷脂酶D活力的洗脱峰,用超滤离心管浓缩。再将浓缩液上样于Superdex 200 10/300 GL凝胶层析柱,用含0.5 mol/L NaCl的柠檬酸-柠檬酸钠缓冲液(50 mmol/L,pH 5.0)洗脱,测定各洗脱峰的酶活,收集有磷脂酶D活力的洗脱峰。
1.2.3 酶活测定
取0.5 g蛋黄卵磷脂溶于1 mL乙醚中,加入10 mL去离子水振荡形成乳液。依次向离心管中加入100 μL乳液、100 μL柠檬酸缓冲液(0.1 mol/L,pH 6.0)、150 μL 7.5%曲拉通X-100、50 μL 0.1 mol/L CaCl2和100 μL酶液,充分混匀后,37℃水浴10 min。加入200 μL含有50 mol/L EDTA的Tris-HCl缓冲液(0.1 mol/L,pH 8.0),沸水浴5 min终止反应[13-14]。室温冷却后,加入2 mL由Tris-HCl缓冲液(0.1 mol/L,pH 8.0)配制的显色剂(含2 mg/mL 4-氨基安替比林、0.5 mg/mL苯酚和10 mg/mL曲拉通X-100),再加入20 μL 100 U/mL胆碱氧化酶和10 μL 200 U/mL过氧化酶,混匀后置于37℃水浴中反应20 min,于500 nm处测定吸光度。空白组采用去离子水代替酶液,同样操作下测定。酶活定义:将37℃、1 min内生成1 μmol胆碱所需要的酶量定义为1个酶活力单位(U)。
1.2.4 蛋白含量的测定
按Lorry法对酶液的蛋白含量进行检测。
1.2.5 PS的初始制备反应体系
20 mg磷脂酰胆碱溶于10 mL乙醚中,0.35 gL-丝氨酸溶于4 mL乙酸-乙酸钠缓冲液中(20 mmol/L,pH 5.5),加入1 mL酶液(4 U),混合后置于具塞锥形瓶中,28℃恒温振荡反应2 h后停止反应。
1.2.6 磷脂酰胆碱和PS的检测
取0.5 mL 1.2.5反应结束后有机相,通风橱室温挥发,用同等体积甲醇-三氯甲烷(体积比2∶1)复溶后,经0.22 μm有机系滤膜过滤,用高效液相-蒸发光散射检测器检测磷脂酰胆碱和PS的含量。
色谱分析条件:Sepax HP-Silica色谱柱(5 μm,250 mm×4.6 mm),流动相A为甲醇-水-醋酸-三乙胺(体积比85∶15∶0.5∶0.05),流动相B为异丙醇-流动相A-正己烷(体积比20∶32∶48)。色谱柱温40℃,流速1.0 mL/min,检测器漂移管温度70℃,气体流速1.5 mL/min,进样量10 μL,洗脱程序如表1所示。
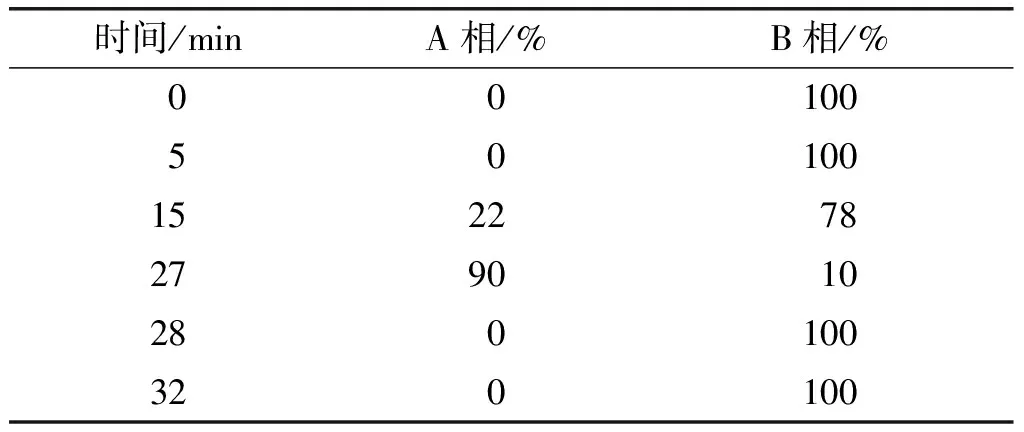
表1 HPLC-ELSD梯度洗脱程序
1.2.7 PS生成率的计算
PS生成率=PS产量/磷脂酰胆碱初始添加量×100%
2 结果与讨论
2.1 磷脂酶D的纯化
磷脂酶D的分步纯化结果如表2所示。
由表2可知:粗酶液经硫酸铵分级沉淀初步纯化后,比酶活提高到2.58 U/mg,被纯化了2.84倍;Hitrap SP HP阳离子交换层析除去了溶液中的大量杂蛋白,比酶活达到40.67 U/mg,将磷脂酶D纯化了44.69倍;最后经Superdex 200 10/300 GL凝胶层析纯化后,得到了纯化倍数为54.37、回收率为32.31%、比酶活为49.48 U/mg的电泳纯的磷脂酶D。

表2 广岛链霉菌产磷脂酶D的纯化结果
2.2 PS的酶法合成工艺
2.2.1 有机溶剂的影响
由于磷脂酶D是亲水性的,而其作用的磷脂底物却是亲油性的,因此这类反应大多在由水相和有机相组成的双液相体系中进行。在这样的反应体系中,有机溶剂不可避免会对磷脂酶D的催化反应有所影响。有机溶剂对酶的催化反应的影响体现在以下几个方面:①由于极性的差异,有机溶剂会影响两相中底物和产物的分配和扩散,使反应的平衡常数和速率常数发生变化;②有机溶剂直接与酶必需的水化层发生作用,间接影响酶的活力;③有机溶剂直接作用于酶分子,改变维持蛋白质构型的氢键和疏水作用等,导致酶活性的降低甚至失活[15]。
为了找出有利于转酯反应的有机相,仅改变有机溶剂的种类,其他条件见1.2.5,考察有机溶剂对PS生成率的影响,结果如图1所示,各有机溶剂的极性如表3所示。
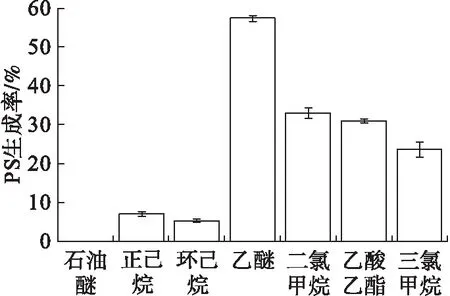
图1 不同有机溶剂对PS生成率的影响

表3 不同有机溶剂的极性
由图1可看出,有机相为石油醚时,基本无PS生成,正己烷和环己烷为有机相时,PS生成率在6%左右,二氯甲烷、三氯甲烷和乙酸乙酯为有机相时,PS生成率在30%左右,乙醚为有机相时,PS生成率最高,达57.2%。结合表3可以看出,PS的生成率随着有机相溶剂的极性增大呈现出先升高后降低的趋势,因此选择乙醚作为后续实验的有机相,这与张忆雪[16]的选择一致。
2.2.2 pH的影响
酶的催化反应需要一定的pH条件,否则导致反应不发生或有副反应发生,不利于目的反应进行。每种酶都有其最适pH,偏离最适pH时,酶分子的极性基团发生不同程度的解离,酶活性降低。当pH偏离较大时,酶的三级结构也会发生变化,引起酶的变性。为探究pH对PS生成率的影响,调节缓冲液pH分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5和8.0,其他条件见1.2.5,结果如图2所示。

图2 pH对PS生成率的影响
从图2可以看出,随着pH的增大,PS生成率先升高后降低,反应适宜在偏酸性条件下进行。pH低于5.5时,PS生成率随pH变化明显,pH高于7.5时,PS生成率随pH升高而出现下降趋势,在pH 5.5~7.5范围内,pH对PS生成率的影响不大,PS生成率在55%左右,pH 6.5时PS生成率最高,达58.1%。因此,选择pH 6.5进行后续反应优化。
2.2.3 反应温度的影响
反应温度对酶催化反应的影响比较复杂,反应温度既可以影响酶的催化反应速率,也对酶蛋白的稳定性有所影响。随着反应温度的升高,反应物的能量被提高,底物与酶的碰撞加剧,反应速度加快。当反应温度高于酶催化反应最适温度后,部分酶蛋白会发生变性,降低了酶催化反应效率。不仅如此,随着反应温度的升高,酶的活性中心结构会发生一定变化,影响底物和酶的结合,从而影响酶催化反应速度及选择性。
由于选用乙醚作为有机相,考虑到乙醚的沸点(35℃)较低,实验选择了5个不同的反应温度进行PS生成率考察。调节缓冲液pH为6.5,其他条件见1.2.5,结果如图3所示。
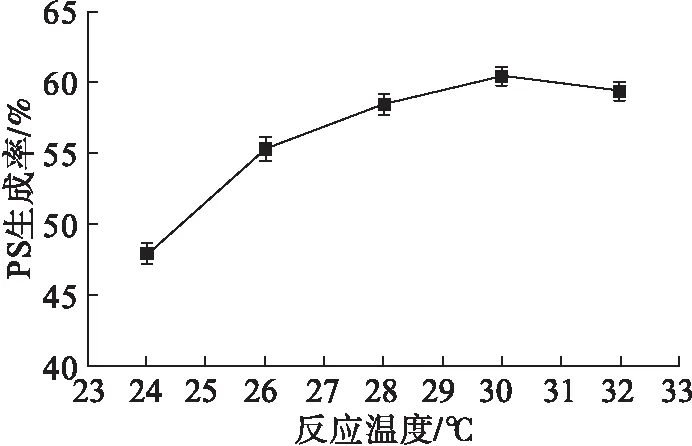
图3 反应温度对PS生成率的影响
从图3可以看出,随着反应温度的升高,PS生成率增大,当反应温度为30℃时,PS生成率最高,当反应温度继续升高后,PS生成率则出现下降趋势。由此可以判定,30℃为此体系催化合成PS的最适反应温度。
2.2.4 底物质量比的影响
有机相选用乙醚,缓冲液pH为6.5,反应温度为30℃,固定有机相中磷脂酰胆碱的浓度,改变水相中L-丝氨酸用量,其他条件见1.2.5,底物质量比对PS生成率的影响如图4所示。
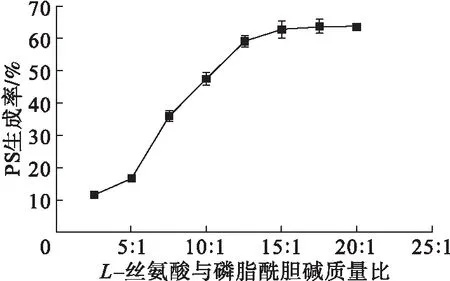
图4 底物质量比对PS生成率的影响
从图4可以看出,当L-丝氨酸与磷脂酰胆碱质量比较低时,PS生成率较低,随着质量比的增大,PS生成率增大,这是由于L-丝氨酸作为反应的底物之一,其用量增大,可促进PS的生成。继续提高底物质量比,PS生成率变化不大。考虑原料成本,控制反应体系中L-丝氨酸与磷脂酰胆碱质量比为15∶1。
2.2.5 有机相与水相体积比的影响
有机相选用乙醚,缓冲液pH为6.5,反应温度为30℃,L-丝氨酸添加量为0.3 g,仅改变有机相的体积,其他条件见1.2.5,有机相与水相体积比对PS生成率的影响如图5所示。
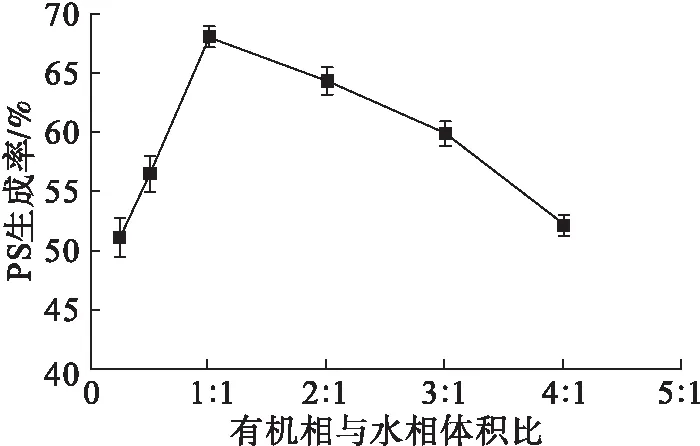
图5 有机相与水相体积比对PS生成率的影响
从图5可以看出,当有机相与水相体积比小于1∶1时,PS生成率随两相体积比的增大而增大,这是因为随着两相体积比的增大,两相界面面积增大,水相中的酶与有机相中底物的接触概率增大,从而提高了PS生成率。两相体积比继续增大时,虽然底物和磷脂酶D的接触概率提高,但酶更容易与有机溶剂接触,酶的活性降低,因此PS生成率逐渐下降。所以调整反应体系中有机相与水相体积比为1∶1。
2.2.6 PS的合成反应进程
对双液相体系酶法制备PS工艺进行优化后,得到最优反应条件:有机相为乙醚,pH 6.5,反应温度30℃,L-丝氨酸与磷脂酰胆碱质量比15∶1,有机相与水相体积比1∶1。在最优条件下进行PS合成,定时取样检测各磷脂组分含量,结果如图6所示。
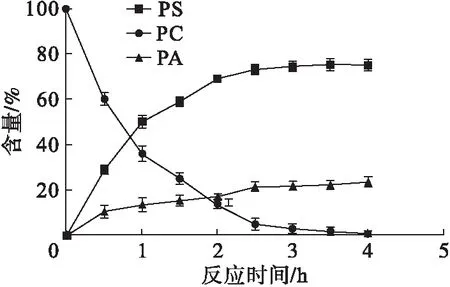
图6 磷脂酰丝氨酸合成反应进程
由图6可以看出:底物在2.5 h后几乎被完全消耗;在合成PS的过程中,有副产物磷脂酸(PA)产生,这表明转酯反应过程中有水解反应发生;产物PS含量在反应2.5 h后变化不大,即最佳反应时间为2.5 h,此时PS生成率为74.8%。本实验广岛链霉菌所产磷脂酶D的PS生成率略低于严明等[17]的固定化磷脂酶D 78.6%的生成率,但与张忆雪[16]、Hosokawa[18]等相比,PS生成率提高了约40%,高于已报道的大多数磷脂酶D[19-21],说明可以应用于PS的酶法合成。
3 结 论
胞外粗酶液通过硫酸铵沉淀、Hitrap SP HP阳离子交换层析和Superdex 200 10/300 GL凝胶层析纯化后,磷脂酶D比酶活由0.91 U/mg提高到49.48 U/mg,是粗酶液的54.37倍,回收率为32.31%。双液相体系酶法制备磷脂酰丝氨酸工艺研究表明,在以乙醚为有机相、pH 6.5、反应温度30℃、L-丝氨酸与磷脂酰胆碱质量比15∶1、有机相与水相体积比1∶1条件下反应2.5 h,底物基本被消耗完,此时磷脂酰丝氨酸生成率达到74.8%。
