曲妥珠单抗联合多西他赛治疗乳腺癌的疗效及安全性评价
2020-01-10陈魏威权广前王金津
陈魏威 权广前 王金津
近年来,乳腺癌的发病率呈逐年上升趋势,是由乳腺上皮细胞受多种致癌因子作用下,发生基因突变,细胞增殖失控,进而发生转移导致[1]。以往乳腺癌的治疗原则是根除肿瘤细胞[2],乳房往往需要完全切除,但是随着社会的发展,人们对形体外貌和生活质量要求越来越高,保乳治疗成为近年来研究的热点。随着分子生物学和小分子靶向药物的研究不断深入,乳腺癌的发生、发展机制逐渐清晰,乳腺癌患者中表皮生长因子受体2(HER-2)阳性占30%左右,HER-2阻断剂、基因和单抗治疗成为研究热点[3]。曲妥珠单抗是一种人源化的单克隆抗体,能够特异性结合HER-2,抑制信号转导功能,发挥杀伤肿瘤细胞的作用[4]。为评价曲妥珠单抗联合多西他赛对HER-2阳性乳腺癌患者的临床疗效及安全性,本文选取120例HER-2阳性乳腺癌患者为研究对象,取得了良好的临床效果。
1.资料与方法
1.1 一般资料 选取我院自2015年3月至2019年7月收治的120例HER-2阳性、Ⅲ期乳腺癌患者,按照随机数字表法分为对照组和观察组,每组60例。其中对照组年龄52~71岁,平均年龄(57.4±3.6)岁;病程3~14个月,平均病程(8.2±1.9)个月;浸润性小叶癌25例,浸润性导管癌20例,单纯癌15例;病情严重程度:重度18例,中度36例,轻度16例。观察组患者年龄51~73岁,平均年龄(57.1±3.4)岁;病程3~13个月,平均病程(8.0±1.8)个月;浸润性小叶癌23例,浸润性导管癌21例,单纯癌16例;病情严重程度:重度17例,中度34例,轻度19例。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 纳入及排除标准
1.2.1 纳入标准:①经临床及病理确诊为HER-2阳性Ⅲ期乳腺癌;②Karnofsky评分>70分;③所有患者均为单发性病灶且无转移;④心肝肾等主要脏器功能正常;⑤治疗前均未接受过其他化疗、放疗等治疗;⑥告知患者及家属本研究的具体内容,且签订知情同意书者。
1.2.2 排除标准:①由其他癌症转移而来或遗传性患者;②Ⅰ期、Ⅱ期乳腺癌患者;③未完成治疗计划者;④对本研究所用药物过敏或存在过敏体质者;⑤哺乳或妊娠期患者;⑥临床资料不全者。
1.3 治疗方法
1.3.1 对照组:盐酸表柔比星用法:药品剂量按患者体表面积90mg/m2计算,用500ml 5%葡萄糖注射液稀释,静脉滴注,1次/周。环磷酰胺用法:药品剂量按患者体表面积600mg/m2计算,加入30ml生理盐水稀释,静脉滴注,第一天,3周为1个疗程。
1.3.2 观察组:注射用曲妥珠单抗用法:首次疗程负荷量按照8mg/kg计算,静脉滴注30min,以后每疗程按维持剂量6mg/kg计算。多西他赛用法:药品剂量按患者体表面积75mg/m2计算,用500ml 5%葡萄糖注射液稀释,静脉滴注1h,第一天,3周为1个疗程。
1.4 观察指标
1.4.1 不良反应:统计两组患者脱发、胃肠道反应、腹泻、骨髓抑制和肝功能损害的发生人数,并计算不良反应发生率。
1.4.2 临床疗效:判定标准:根据实体瘤疗效的判定标准,临床疗效分为肿瘤物进展(PD):出现新肿物或肿物体积增加>25%;病情稳定(SD):无新肿物出现,25%<肿物体积减小<50%;部分缓解(PR):肿物体积减小>50%且维持四周以上;完全缓解(CR):肿物完全消失且维持四周以上。总有效率=完全缓解率+部分缓解率。
1.4.3 TK1检测:治疗前后1天清晨饭前抽取3ml静脉血,加入肝素抗凝静置后备用,采用双抗体ELASA法(酶联免疫吸附法),选用FX-6MG酶联免疫光谱仪进行检测分析,检测方法严格按照试剂盒、仪器操作说明进行操作和质控。
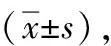
2.结果
2.1 两组患者治疗后不良反应发生情况 经治疗后,观察组患者总不良反应发生率仅为18.3%,显著低于对照组的48.3%,差异具有统计学意义(P<0.05),结果见表1。

表1 两组患者治疗后不良反应发生情况比较[例(%)]
2.2 两组患者临床疗效情况比较 经治疗后,对照组总有效率为58.3%,显著低于观察组的81.7%,差异具有统计学意义(P<0.05),结果见表2。

表2 两组患者临床疗效情况比较[例(%)]
2.3 两组患者治疗前后血清中CRP含量情况比较 治疗后两组患者血清中TK1含量均较治疗前显著降低(P<0.05),差异具有统计学意义;观察组患者血清中TK1含量显著低于对照组(P<0.05),差异具有统计学意义,结果见表3。

表3两组患者治疗前后血清中TK1含量情况比较(mmol/L)
注:组内与治疗前相比,*P<0.05;与对照组相比,#P<0.05。
3.讨论
乳腺癌在女性患者中发病率逐年升高,且早期乳腺癌基本没有疼痛感,难以发现,因此乳腺癌发病确诊时往往错过了最佳治疗时间[5]。多种致癌因子作用于乳腺上皮细胞致使基因发生突变,造成细胞增殖失控,发生无限制增殖,并演变、进展为肿瘤。肿瘤细胞大量堆积在正常细胞周围,并对其造成挤压、侵蚀,正常组织受到破坏。正常乳腺细胞生物学特性丧失后,细胞间连接程度降低,容易发生脱离并随血液转移至其他部位,若扩散至脏器,严重者危及生命。Ⅲ期乳腺癌主要表现为乳腺外上部乳内肿块,形态差异较大且不规则,质地硬边缘不清晰,侵犯皮肤或内部筋膜;肿块一般不可推动,疼痛感明显,疼痛多为隐痛或阵发性刺痛;乳头有病理性溢液和乳房弧形等症状发生[6]。目前,临床治疗乳腺癌多采用手术切除肿瘤病灶为主,辅助放疗或化疗。但随着分子生物学研究的不断进步,肿瘤分子诊断不断应用到临床治疗中,靶向治疗应运而生,效果显著,完美解决了当代社会女性对外貌及精神文明的诉求[7]。本次研究中,针对HER-2阳性Ⅲ期乳腺癌患者给予两组不同治疗方式,对照组给予常规的盐酸表柔比星联合环磷酰胺治疗,观察组则给予曲妥珠单抗联合多西他赛治疗,效果显著。
表皮生长因子受体2(HER-2)是一种促癌基因,隶属于表皮生长因子受体(EGFR)家族。研究发现[8,9],发生恶性或侵袭乳腺癌患者中HER-2表达呈阳性,可影响放疗和化疗效果,严重影响预后。乳腺癌细胞中HER-2过表达会造成HER-2异二聚体含量大幅增加,可通过特异的信号通路诱导肿瘤细胞进展[10]。因此,HER-2已经成为评价乳腺癌病变程度、治疗、术后恢复及预后的重要指标。曲妥珠单抗是一种IgGl型重组DNA 衍生的人源化单克隆抗体,在人的框架基础上可与人HER-2的细胞外部位特异性结合,抑制肿瘤细胞的增殖、分化[11]。此外,曲妥珠单抗能通过刺激机体免疫细胞祛除癌细胞,同样能下调HER-2基因,抑制HER-2家族的促生长作用[12]。因此,曲妥珠单抗对HER-2阳性乳腺癌患者针对性和靶向性较高。但是,单纯地使用曲妥珠单抗难以达到满意效果,且多数患者会出现皮疹、胃肠道反应和骨髓抑制等不良反应[13]。因此,对于寻找新型、高效的Ⅲ期HER-2阳性乳腺癌患者的治疗方式尤为重要。有研究发现[14],多西他赛是一种新型的人工半合成的紫杉类抗肿瘤药物,其作用机制是通过微管蛋白系统,加强微管蛋白的自身聚合作用,抑制微管的解聚,造成维管束的功能发生紊乱,最终抑制肿瘤细胞的有丝分裂,阻滞在G2M期,达到治疗的目的。多西他赛是乳腺癌二线治疗中疗效最后的药物,且不与紫杉醇、顺铂或5-Fu尿嘧啶发生耐药的细胞株发生交叉耐药[15]。此外,多西他赛的临床不良反应发生较低,整体有效性高。本研究显示,曲妥珠单抗联合多西他赛的治疗方法疗效更高,观察组患者的脱发、胃肠道反应、骨髓抑制和肝功能损害的发生人数明显低于对照组,且总不良反应发生率更低(P<0.05),说明曲妥珠单抗联合多西他赛能有效改善患者临床症状和疗效,多西他赛能抑制肿瘤细胞的增殖与分化,抑制患者胃管解聚,且联用曲妥珠单抗可降低药物的毒副反应,达到高疗效、高安全性的临床目的。
综上所述,HER-2阳性乳腺癌患者给予曲妥珠单抗联合多西他赛治疗,临床疗效显著,可有效降低患者不良反应发生风险,提高患者健康状况及生活质量。
