超声微泡靶向递送MaFGF改善糖尿病心肌病大鼠左心室收缩功能的初步实验研究
2020-01-10迟婷婷滕银燕孙玮明林海霞郑磊田新桥
迟婷婷 滕银燕 孙玮明 林海霞 郑磊 田新桥
糖尿病心肌病(diabetic cardiomyopathy,DCM)作为糖尿病(diabetes mellitus,DM)患者严重且常见的并发症之一,伴随DM患者数量的增长而迅速增多,已成为DM患者发生心力衰竭的重要原因。因此,DCM的防治研究成为近些年医学领域亟待解决的问题。有学者基于酸性成纤维细胞生长因子(acidic fibroblast growth factor,aFGF)特点[1-2],构建了aFGF的突变体,即改构型酸性成纤维细胞生长因子(modified acidic fibroblast growth factor,MaFGF),经实验证实MaFGF在改善心功能障碍方面极具前景[3-4],但因其稳定性差[5-6],易失活,且目前缺乏高效的靶器官速递技术,使药效得不到充分发挥,限制其临床应用与开发。超声靶向微泡击破技术(ultrasound-targeted microbubble destruction,UTMD) 恰是超声医学领域新兴靶向传输技术,是利用超声波空化效应与声孔效应增加血管内皮通透性,增加外源性物质到达靶位的数量,从而发挥更强生物学作用,在心血管疾病防治方面发挥越来越大的价值[7-9]。因此,本研究拟应用UTMD技术将MaFGF靶向递送到DCM大鼠的左心室,再应用超声心动图、速度向量成像(velocity vector imaging,VVI)及病理学检查等多种方法评价其对DCM大鼠左心室收缩功能的改善价值。旨在为DCM的防治研究提供更多的实验数据与方法,现报道如下。
1 材料和方法
1.1 材料 健康雄性SPF级Sprague-Dawley大鼠75只,鼠龄 40~50d,体重(210±25)g,由温州医科大学实验动物中心提供[许可证号:SCXK(浙)2019-0001];MaFGF冻干粉由温州医科大学生物与天然药物开发中心有限公司提供;微泡对比剂采用SonoVue(Bracco公司,产品批号:18A022A)。实验采用Acuson Sequoia 512C彩色多普勒超声诊断仪(Siemens公司),线阵探头(15L8w-S),频率12 ~14 MHz。TUNEL试剂盒购自罗氏公司(批号:11684817910),链脲佐菌素(STZ,批号:WXBC6558V)、天狼星红染色试剂(批号:29384K)购自美国Sigma公司。
1.2 方法
1.2.1 制备MaFGF的超声微泡混悬液 50μg MaFGF冻干粉与5ml 0.5%氯化钠溶液混合,轻度振摇充分溶解后形成单纯MaFGF溶液。再将5 ml单纯MaFGF溶液注入SonoVue瓶中,形成MaFGF-SonoVue混悬液,临用前持续振荡摇匀。结合既往研究使用的MaFGFSonoVue混悬液中含MaFGF的浓度为10μg/ml[3]。
1.2.2 动物模型建立、分组和干预 75只大鼠在通风恒温的SPF级动物房内适应性饲养1周(室温约20~24℃,平均湿度约50%~60%,人工控制开关模拟昼夜变化,饲养过程中无菌水自由供给),禁食不禁水12h。采用随机数字表法挑选15只作为N组,不做干预,余60只经腹腔一次性注射70mg/kg的STZ(使用前用pH为4.5的柠檬酸缓冲液稀释为1%溶液)诱导建立DM模型,分别于注射后第1天、第3天、第7天尾静脉取血测空腹血糖浓度,血糖浓度持续稳定在16.7mmol/L以上,且出现多饮、多食、多尿现象后,继续高糖、高脂饮食饲养8周,研究发现DM大鼠8周后就出现心功能异常,即认为形成DCM模型[10]。将造模成功52只大鼠(剔除8只造模未成功)采用随机数字表法分为4组,分别为DCM 组 、MaFGF 组 、MaFGF-SonoVue 组 、MaFGFSonoVue+UTMD组,每组13只。
N组及DCM组不做干预处理,MaFGF组及MaFGFSonoVue组大鼠由10%水合氯醛腹腔注射麻醉(3ml/kg)后分别经尾静脉一次性缓慢推注MaFGF溶液及(MaFGF-SonoVue)混悬液,1min内完成注射。MaFGFSonoVue+UTMD组大鼠麻醉后,剃掉心前区鼠毛,将超声仪探头置于心前区皮肤,取乳头肌水平左室短轴切面,聚焦深度为 3.5~4.0 cm,经尾静脉一次性缓慢推注MaFGF-SonoVue混悬液,1min内完成,当心肌内见大量微泡充盈时即用机器自带的MBD功能反复多次爆破微泡(机械指数MI=1.9),直至微泡完全消失。实验大鼠给药剂量为15μg/kg。每周干预2次,连续4周。
1.2.3 图像及数据采集 干预4周后,所有大鼠逐个称重、记录数据,麻醉后连接心电图,行常规超声心动图检查,测量各组大鼠的左心室舒张末期内径(LVIDd)、左心室收缩末期内径(LVIDs)、左心室射血分数(LVEF)及左心室短轴缩短率(LVFS)。随后启动VVI成像模式,于乳头肌水平左心室短轴观采集连续3个心动周期的二维灰阶动态图像,存入MO光盘,然后导入Siemens Sygno US Workplace 3.01分析软件进行分析,测定左心室6个室壁节段的收缩期平均峰值速度(Vs)、径向应变(Sr)及径向应变率(SRr)。
1.2.4 心肌细胞凋亡指数(AI)检测 处死大鼠,打开心包,剔出左心室,取乳头肌水平左心室心肌,置于10%的甲醛溶液中固定24h,石蜡包埋,连续约5μm切片,按照试剂盒指示进行TUNEL染色,光学显微镜下进行观察。每组取12张切片,每张切片随机取20个400倍视野,计数该视野细胞中染色阳性的细胞数,AI(%)=视野内的阳性细胞数/视野内总的细胞数×100%。
1.2.5 血管周围胶原面积与血管腔面积之比(PVCA/LA)检测 取每组大鼠心肌组织切片,按照试剂盒说明书进行天狼星红染色。封片后置于光学显微镜下观察,随后应用IPP6.0软件分析计算PVCA/LA,每组取12张切片,每张切片随机取20个400倍视野。
1.3 统计学处理 采用SPSS 19.0统计软件。数据进行正态性检验,计量资料以表示,多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(ANOVA)。方差齐性者两两比较采用LSD-t检验;方差不齐者采用Dunnett's T3法。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般情况 实验结束,N组无死亡,DCM组死亡4只,MaFGF组及MaFGF-SonoVue组各死亡3只,MaFGF-SonoVue+UTMD组死亡2只。
2.2 各组大鼠常规超声心动图及VVI指标比较 见表1。
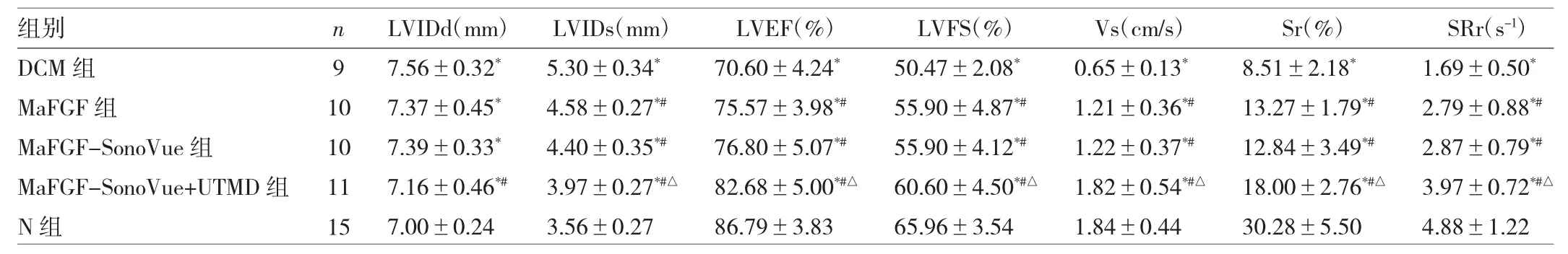
表1 超声心动图比较及VVI指标比较
由表1可见,干预4周后,DCM组LVIDd及LVIDs均较 N 组增加(均 P<0.05),而 LVEF、LVFS、Vs、Sr及SRr却明显下降(均 P<0.05);MaFGF 组和 MaFGFSonoVue 组 LVEF、LVFS、Vs、Sr及 SRr较 DCM 组上升(均 P<0.05),LVIDs 却减低(均 P<0.05),但两组间无明显差异;MaFGF-SonoVue+UTMD组LVIDd及LVIDs均较 DCM 组降低(均 P<0.05),且 LVEF、LVFS、Vs、Sr、SRr较MaFGF组及MaFGF-SonoVue组均明显升高(均 P<0.05)。
2.3 病理学检查结果 TUNEL染色示凋亡细胞核呈棕黄色,正常细胞核呈蓝色,干预4周后,N组心肌仅有极少数细胞发生凋亡(插页图1a);DCM组细胞凋亡增多(插页图1b);MaFGF组及MaFGF-SonoVue组凋亡细胞数目相近,但较DCM组减少(插页图1c、d)。MaFGFSonoVue+UTMD组凋亡细胞数较其他治疗组减少(插页图 1e)。
天狼星红染色显示DCM组血管周围纤维化情况较N组明显增多(插页图2a、b),MaFGF组及 MaFGFSonoVue组均较DCM组略好转(插页图2c、d);MaFGFSonoVue+UTMD组较其他治疗组好转(插页图2e)。
2.4 各组大鼠AI及PVCA/LA比较 见表2。

表2 各组大鼠AI及PVCA/LA比较
由表2可见,DCM组AI及PVCA/LA均较N组明显升高(均 P<0.05);MaFGF 组及 MaFGF-SonoVue组间AI及PVCA/LA均无统计学差异,但较DCM组均略下降 (均 P<0.05);MaFGF-SonoVue+UTMD 组 AI及PVCA/LA较其他治疗组均明显下降(均P<0.05)。
3 讨论
DCM的概念是Hamby于1974年首次提出[11],是指独立于DM基础心肌组织发生结构与功能的损伤,逐渐进展将导致充血性心力衰竭、心律失常及心源性休克,已成为DM患者死亡的重要原因之一。目前DCM确切发病机制尚不明确,但普遍认可针对抗氧化应激损伤、诱导心肌血管生成、改善心肌微循环状态、抗心肌细胞凋亡及纤维化治疗等是DCM防治的重要策略[12]。因此具有抗氧化损伤、扩张血管、营养神经及保护心脏等功能的aFGF成为具有治疗DCM潜力的药物,但aFGF同时兼具诱发肿瘤风险,限制其应用,于是我们使用具有aFGF同等心脏保护作用的突变体,即MaFGF。研究发现,在冠心病大鼠模型心肌组织中注射MaFGF可显著减少心肌细胞凋亡并改善心功能[5],另有研究表明MaFGF可能通过抗氧化应激来抑制DM诱导的心功能障碍[6]。然而MaFGF是一种稳定性较差的生物大分子药物,在体外极易失活,全身给药不良反应大,目前缺乏安全、速效、可控的靶向给药手段,以至MaFGF无法得到开发与推广。
UTMD恰是超声医学领域发展较快的靶向递药技术,具有靶向性强、侵袭性低、免疫原性低、毒性低、组织特异性及可重复性等优点[13]。田新桥等[14]利用UTMD递送aFGF有效改善DCM大鼠的左心室收缩功能。张明等[15-16]利用UTMD技术将分别包载bFGF、aFGF的纳米粒靶向递送到DM诱导的心肌组织中,结果明显延缓DCM进程,改善心脏功能,减轻心肌细胞纤维化和凋亡现象,提升心肌组织微血管密度。可见UTMD技术为MaFGF靶向治疗DCM实验研究提供了一种全新的方法。
我们利用UTMD技术将MaFGF送达DCM大鼠心肌组织后及时爆破,观察该靶向给药系统下DCM大鼠的左心室收缩功能变化。实验末,应用常规超声及VVI检测发现:DCM组LVIDd及LVIDs均较N组增加,而LVEF、LVFS、Vs、Sr及 SRr明显减低,说明 DCM 大鼠左心室功能明显受损;经TUNEL染色及天狼星红染色后显示:AI及PVCA/LA较N组明显增高,说明DCM组大鼠出现明显细胞凋亡及血管周围纤维化现象。而经过MaFGF及MaFGF-SonoVue治疗后较DCM组 LVEF、LVFS、Vs、Sr及 SRr增高,LVIDs、AI及 PVCA/LA 降低,说明大鼠左心室收缩功能、细胞凋亡及间质纤维化现象得到改善,但两种方法疗效没有差异性。MaFGFSonoVue+UTMD 组大鼠 LVEF、LVFS、Vs、Sr及 SRr较其他治疗组明显增高,说明UTMD技术可提高药物对左心室收缩功能疗效,AI及PVCA/LA明显降低,可见MaFGF保护心肌的机制可能是从抗细胞凋亡、抗间质纤维化方面发挥作用。总之,UTMD靶向递药系统为DCM防治提供了一种全新的靶向输药手段,在临床应用上极具前景,MaFGF有望成为治疗DCM的研究方向。
本研究尚存在一些不足,治疗组之间LVIDd无明显改善,可能是因为给药时间短或者样本数量较小,超声微泡作为药物或者基因的载体,载药量较低,稳定性较差,局部维持时间较短,有待进一步优化。
