高分辨率CT肺纯磨玻璃结节影像征象对其侵袭性的预测价值
2020-01-09薛昌辉黄洪磊吴志涛阙瑞华陈晓燕
李 凤,薛昌辉,黄洪磊,吴志涛,阙瑞华,陈晓燕,李 琦
福建省南平市第一医院影像中心,福建 南平 353000
随着低剂量高分辨率CT(high resolution CT,HRCT)被广泛应用于肺癌筛查,肺纯磨玻璃结节(pure ground-glass nodule,pGGN)病变的检出率逐年增高[1],大多学者认为pGGN多为浸润前病变[2-3]。依据2011年国际多学科肺腺癌分类标准,pGGN既可以是浸润前病变,也可以是微浸润腺癌和浸润性腺癌[4]。但大多数学者仅研究了pGGN的癌性病变与非癌性病变之间的特征,如何区分其癌性病变的病理学亚型鲜见报道,笔者回顾性分析pGGN的HRCT影像学征象,研究HRCT征象对pGGN侵袭性的诊断价值。
1 资料和方法
1.1 研究对象
收集2013年1月—2017年3月于福建省南平市第一医院经手术及病理学检查证实的pGGN患者90例,共98个病灶(其中8例有2个病灶),男性27例,女性63例,年龄33~79岁,平均年龄(55.8±10.1)岁。依据2011年国际多学科肺腺癌分类标准[4],病灶分为非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸润腺癌(minimally invasive adenocarcinoma,MIA)及浸润性腺癌。将98个病灶分为3组,分别为浸润前病变组(AAH和AIS病灶50个)、微浸润病变组(MIA病灶22个)、浸润性病变组(浸润性腺癌26个)。
1.2 检查方法
所有患者术前至少进行1次CT检查,检查设备为德国Siemens公司的Somatom Definition双源CT及Somatom Definition AS 64层CT。常规扫描层厚5~8 mm,层间隔4~6 mm,管电压80~120 kV,管电流200~280 mA,矩阵512×512;扫描后均行1.0 mm薄层重建,如采用多平面重建、曲面重建、最大密度投影、最小密度投影等后处理技术,以全面多方位观察和分析各种CT征象。观察窗设定:窗宽1 450~1 500 HU,窗位-450~-500 HU。均在吸气末闭气后扫描。
1.3 图像分析
病灶的部位、大小(测量pGGN在薄层CT图像上的最大截面积直径)、病灶边缘(分叶、毛刺)、空泡征、空气支气管征、血管改变、胸膜凹陷征、瘤肺界面,由2名10年以上影像诊断工作经验的医师采用双盲法阅片,如遇分歧,共同商讨决定,仍然无法确定者,请正高职称医师会诊确定。
1.4 统计学处理
采用SPSS 22.0软件进行分析。计量资料采用独立样本t检验;计数资料采用χ2检验。如果理论数<1或所得概率接近检验水平,用Fisher精确概率法检验;以α=0.05作为检验水准;绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析鉴别微浸润病变组和浸润性病变组的最佳阈值,P<0.05为差异有统计学意义。
2 结 果
本研究中,分叶征在浸润前病变组、微浸润病变组和浸润性病变组的发生率分别为24.0%(12/50)、30.0%(15/50)、48.0%(24/50),差异有统计学意义(χ2=34.939,P<0.01)。病灶空泡、空气支气管、血管改变、瘤肺界面在3组pGGN间差异均有统计学意义(χ2值分别为10.355、6.503、11.911;P均<0.05),但病变部位、毛刺、胸膜凹陷征在3组间差异无统计学意义(χ2值分别为5.230、3.413、3.211;P>0.05;表1)。
本组资料中浸润性病变组p G G N最大径[(1 7.8±8.9)m m]大于微浸润病变组[(1 1.5±5.5)m m]和浸润前病变组[(9.4±3.4)m m]。浸润性病变组病灶大小与浸润前病变组、微浸润病变组比较,差异均有统计学意义(P<0.01),而后两组之间差异无统计学意义(P=0.172)。对微浸润病变组与浸润性病变组进行ROC曲线分析,病变直径的最佳阈值为1.38 cm,曲线下面积为0.762,诊断的灵敏度、特异度分别为80.8%、81.8%(图1~2)。

表1 不同病理分型pGGN病变CT影像表现
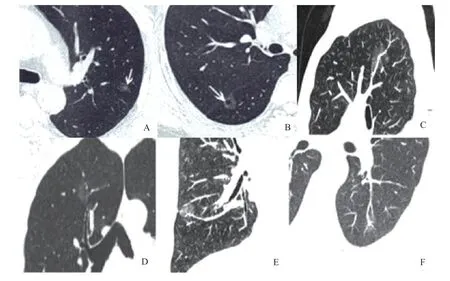
图1 典型病例CT图像

图2 微浸润组与浸润性组ROC曲线图
3 讨 论
pGGN在HRCT中表现为不掩盖支气管结构或者肺血管的局限性淡薄阴影[5]。HRCT上检测到的pGGN,部分被证实为早期的腺癌或癌前病变[6],Lim等[7]和Noguchi等[8]报道浸润性腺癌也可以表现为pGGN结节。相关研究[9-10]报道腺癌的预后取决于pGGN的恶性程度。因此,对pGGN作出准确的CT评估至关重要。
病灶大小为诊断恶性病灶的独立因素之一,病灶越大其恶性程度越高。以往有研究[8]表明,pGGN直径≥10 mm可以区分浸润性病变与浸润前病变,16.4 mm为区分M I A 与浸润性腺癌的最佳阈值。另一项研究[11]表明,大部分直径<5 mm的pGGN是AAH。本组资料也显示浸润性病变组的直径明显大于浸润前病变组及微浸润病变组,差异有统计学意义(P<0.01),而浸润前病变组和微浸润病变组之间差异无统计学意义(P=0.291),此结果与Fan等[12]研究相似。ROC分析显示,区分浸润性与微浸润性病灶的病变直径最佳阈值为1.38 cm,灵敏度为80.8%,特异度为81.8%(图1)。
在9 8 个结节中,浸润前病变组、微浸润病变组和浸润性病变组之间的位置比较差异无统计学意义(表1)。相关研究[13-14]表明,类圆形或者椭圆形的pGGN结节多为恶性,而不规则形多见于良性pGGN。Kim[6]报道pGGN的形态与其病理学亚型差异无统计学意义,这与本研究结果相一致。
相关研究[10,15]表明,空气支气管征、空泡征或分叶征、毛刺征的出现提示浸润性腺癌。本组资料显示,分叶与pGGN病理学亚型差异有统计学意义,而毛刺与其病理学亚型间差异无统计学意义(P=0.182)。其原因可能与病灶周围纤维组织增生,牵拉周围小叶间隔有关[16]。此外,Jin等[17]对94例pGGN研究后发现,毛刺征在浸润前腺癌中发生率为52.38%,在MIA中为51.43%,在浸润性腺癌中为47.37%,在这3组之间差异无统计学意义。
陈天忠等[18]推测空气支气管征的发生机制可能是肿瘤组织对支气管的浸润以及纤维化反应的牵拉作用,导致局部支气管扩张、扭曲。空泡征是指病灶内<5 mm小泡状低密度影,主要是未闭小支气管或被肿瘤组织溶解破坏的肺泡腔。空气支气管征在CT图像上表现为长条状的含气影。其病理学基础是肿瘤细胞沿着肺泡壁生长,未完全破坏侵蚀支气管,小气道未完全闭塞,甚至扩张,形成残留的含气支气管[19]。Hattori[20]等认为,空气支气管征的出现代表了肿瘤的微小侵袭能力。本研究显示,在不同病理学类型中空气支气管征和空泡征的数量差异有统计学意义(P=0.006),且两者均在浸润性病变组中出现的概率较高(85.4%,37.5%)。
随着病变浸润程度加深,病变内血管扭曲、扩张、僵直等形态异常改变的发生率随之增高,这与部分学者[13,21]报道的结果相一致。本研究中发现3组pGGN的血管改变差异有统计学意义,可能与恶性肺磨玻璃结节中的纤维化有关,当肿瘤向周围组织浸润生长或刺激增生的纤维成分牵拉周围结构时,均可致局部小血管走行僵直、扭曲或聚集。另外,肿瘤组织的生长代谢较正常组织高,可致供血血管增粗。浸润前病变包括AAH和AIS。早期时,血管多走形自然,清晰穿过;随着进一步发展,血管可出现扭曲、增粗或截断等征象,因此浸润前腺癌多无血管改变。有研究[22]表明,进入或穿过瘤体的血管在瘤体内扭曲、增粗或聚集作为肺癌的一个恶性征象亦可见于部分肺磨玻璃结节中,而这种血管走形改变对良恶性pGGN或者浸润前与浸润性病变的鉴别是有意义的。
胸膜凹陷征是由于病变纤维化收缩牵拉邻近脏层胸膜形成凹陷所致,既可见于浸润性病变,也可见于浸润前病变,故在本研究中不同腺癌病理学改变与其胸膜凹陷未见显著差异。相关研究[23]表明,恶性肿瘤一般都具有清晰的边界。也有研究[22]指出,清晰的瘤肺界面更多地提示浸润性病变,其病理学表现为,随着病变进一步发展,肺泡壁(包括肿瘤细胞)和纤维基质变得越来越厚,肿瘤边缘越清晰。本组资料显示,不同病理学改变的pGGN瘤肺界面清楚与否差异有统计学意义,表明瘤肺界面清楚可高度提示浸润性病变(P=0.003)。
总之,结合病灶大小和CT形态学特点综合评价pGGN,有助于鉴别肺腺癌侵袭程度,从而指导临床医师作出正确诊断并制订合适的手术治疗方案。
