表观扩散系数直方图在新辅助化疗前预测luminal型乳腺癌疗效的价值
2020-01-09耿小川庄治国张科蓓
耿小川,华 佳,庄治国,陈 洁,张科蓓,张 庆,成 芳
1.上海交通大学医学院附属仁济医院放射科,上海 200127;
2.上海交通大学医学院附属仁济医院南院放射科,上海 201112
在可手术的乳腺癌患者中,新辅助化疗(neoadjuvant chemotherapy,NAC)可以提高患者的保乳手术率[1],同时也适用于局部晚期乳腺癌患者的治疗。通过NAC后的手术治疗,患者的无病生存率和总体生存率得到提高[2-3]。luminal型乳腺癌NAC难以达到病理学完全缓解,但与其他亚型相比,其5年生存率更高[4-5]。因此,准确预测luminal型乳腺癌患者的NAC疗效有助于制定最合适的手术及术后治疗方案。表观扩散系数(apparent diffusion coefficient,ADC)值有助于在NAC早期预测乳腺癌患者的疗效[6]。然而,ADC值能否在NAC之前预测患者疗效,目前还存在争议[7-10],原因之一可能是肿瘤组织的成分混杂而干扰了均值[11]。近几年有作者提出通过直方图分析感兴趣区内的ADC值,从而克服仅计算均值而忽略肿瘤内部不均质特点的局限性[12]。目前,直方图分析ADC值已被证实能够在NAC早期预测乳腺癌的疗效,但在NAC之前能够预测疗效目前仍然存在争议[13-16]。此外,针对luminal型乳腺癌患者,目前还不清楚直方图分析ADC值能否在NAC前预测疗效。因此,本研究旨在通过直方图分析luminal型乳腺癌的ADC值,探讨其在NAC之前预测疗效的可行性及效能。
1 资料和方法
1.1 一般资料
本研究为回顾性研究,获得上海交通大学医学院附属仁济医院伦理委员会批准。所有患者数据均通过搜索2014年1月—2018年12月上海交通大学医学院附属仁济医院病史系统获得。入选标准:① 患者在NAC前经细针抽吸活组织检查(f ine needle aspiration biopsy,FNAB),病理及免疫组织化学检查证实为luminal型乳腺癌;②患者手术前接受NAC;③ 患者有完善的乳房磁共振成像(magnetic resonance imaging,MRI)检查结果,包括扩散加权成像(diffusion-weighted imaging,DWI)序列;④ 患者完成NAC后接受保乳手术或根治手术;⑤ 患者DWI图像通过后处理软件能够测量ADC值。排除标准:① 图像质量差;② 图像无法测量;③ 男性患者;④ 肿瘤内包含大范围的坏死或囊变区。最终入组57例患者,所有患者均为女性,年龄为26~72岁,平均年龄(49±12)岁。
1.2 仪器与方法
所有患者使用荷兰Philips公司Achieva型3.0T磁共振扫描仪完善乳腺MRI检查,采取俯卧位,使用四通道乳房阵列线圈。扫描序列为:轴位DWI序列,矢状位脂肪抑制T2加权序列,轴位T1加权序列。注射造影剂为钆喷酸葡胺注射液,注射剂量为0.1 mmol/kg,注射前后均行轴位三维T1加权快速扰相梯度回波序列扫描。DWI成像采用单次激发自旋回波-回波平面序列:重复时间(repetition time,TR)/回波时间(echo time,TE)为2 681/82 ms;视野(field of view,FOV)为230 mm×240 mm;矩阵224×224;层厚为3 mm;层间距0 mm;扫描层数为40;激励次数3;b值为0和800 s/mm2。
NAC有效定义为术后标本中无乳腺癌细胞或仅见导管原位癌。将NAC前FNAB取得的标本进行免疫组织化学分析来评估雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER2)表达状态及Ki-67增值指数。ER,PR和Ki-67表示为百分比(%)。HER2表达中,-及+表示为阴性,+++表示为阳性,当为++时,进行荧光原位杂交(fluorescent in situ hybridization,FISH)以确定HER2表达状态。luminal型乳腺癌定义为ER和(或)PR受体染色的细胞核占比大于10%[17]。
1.3 图像分析
两名放射科医师均在不了解患者病理学检查结果及NAC疗效的情况下各自绘制感兴趣区,并在2个月后重复测量1次。使用MATLAB软件包进行DWI图像的后处理,使用单指数模型公式ADC=(1nS0-1nSb)/b生成ADC图,S0和Sb分别表示b值为0和800 s/mm2时的DWI信号强度。将高b值DWI和动态对比增强MRI图像上的高信号表现的病灶作为参考,在ADC图上手动绘制感兴趣区,并且小心地避开坏死囊变和出血部位。在病灶最大层面绘制感兴趣区,将所有病变包含在内(图1)。然后使用软件计算ADC值的直方图,从直方图分析得到以下参数:平均值、最小值、标准差、最大值、10%、25%、50%、75%及90%百分位数、偏度和峰度。偏度用来测量直方图的不对称性,峰度用来测量直方图分布的峰值[18]。肿瘤的早期强化率(early enhanced rate of tumor,Ee)使用公式Ee=(SIsecond-SIpre)/SIpre×100%计算,SIpre表示增强前的信号强度,SIsecond表示增强后第二期的信号强度[19]。此外还测量了肿瘤的最大径以及获得肿瘤的时间-信号强度曲线(time-intensity curve,TIC)。
1.4 统计学处理
采用SPSS 21.0软件进行统计学分析,并使用Medcalc 15.2.2计算受试者工作特征(receiver operating characteristic,ROC)曲线。使用组内相关系数(intraclass correlation coefficient,ICC)分析观察者间和观察者内一致性(小于0.4表示一致性较差,大于0.75表示一致性较好)。符合正态分布的连续型变量以(x±s)表示,有效组和无效组间比较采用两独立样本t检验;不符合正态分布表示为中位数和四分位间距,两组间比较采用Mann-Whitney U检验。分类变量表示为频数,两组间比较采用χ2检验。经过正态分布检验后,ADC值的直方图参数以(x±s)表示。有效组和无效组间ADC值的直方图参数比较采用两独立样本t检验。ROC曲线用来评估直方图参数预测NAC疗效的效能,直方图参数间ROC比较采用DeLong法[20]。P值<0.05为差异有统计学意义。

图1 典型病例1(女性,40岁,luminal型浸润性乳腺癌,NAC评估为有效)影像图
2 结 果
2.1 患者临床资料
在57名患者中,17名患者归入有效组,40名患者归入无效组。有效组ER表达程度明显低于无效组(P=0.001),而Ki-67增值指数明显高于无效组(P=0.012)。HER2表达水平在两组间存在显著差组(P=0.019)。患者的乳腺癌的TIC、强化方式、最大径及Ee在两组间差异均无统计学意义(表1)。
2.2 测量的一致性
对于同一直方图参数,观察者间的ICC(0.089~0.845)均低于观察者内的ICC(0.306~0.916)。不论观察者间还是观察者内的组内相关系数,偏度和峰度的一致性都较差,最小值、10%、25%及50%的ADC值的一致性都较好(表2)。
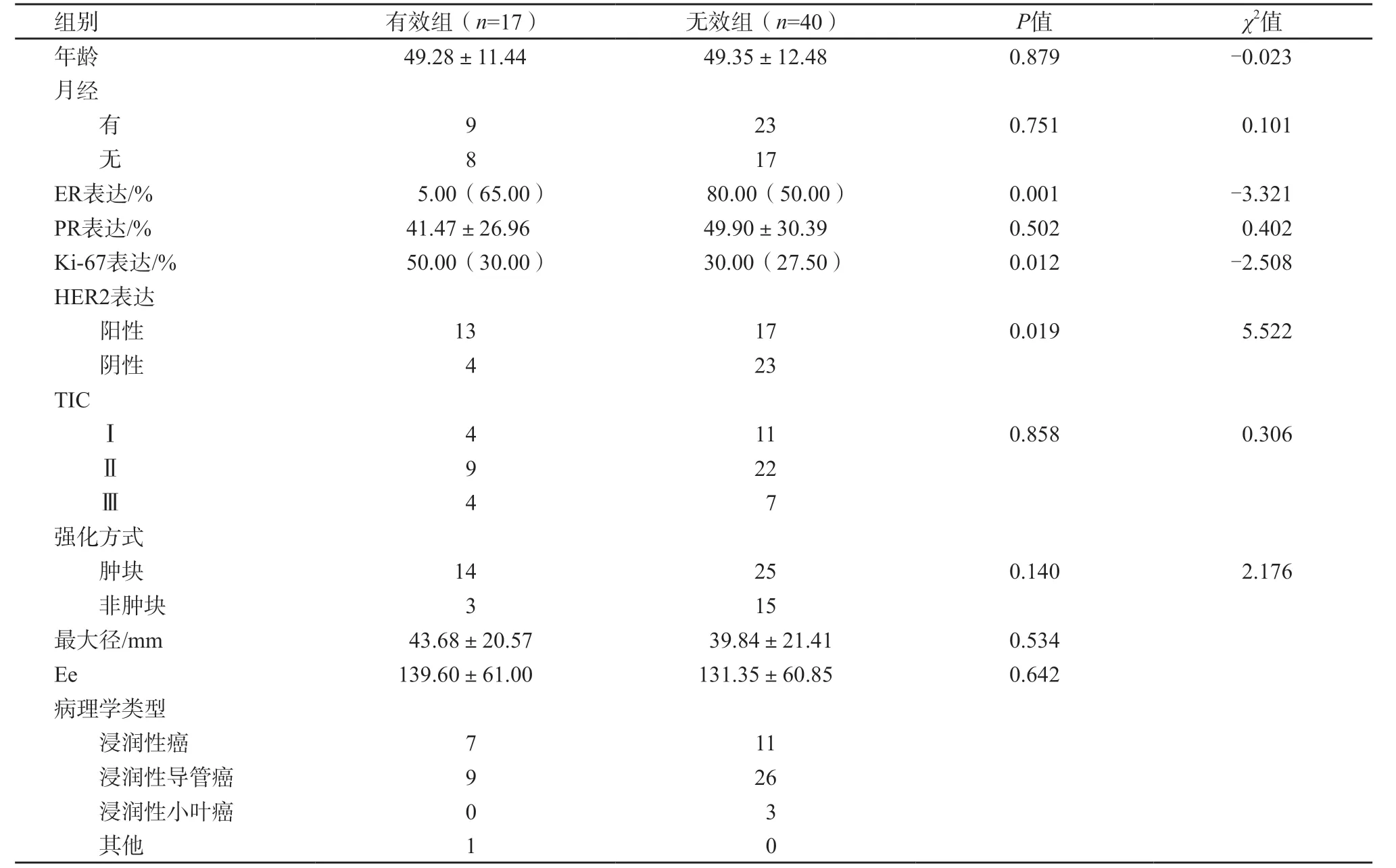
表1 患者临床资料
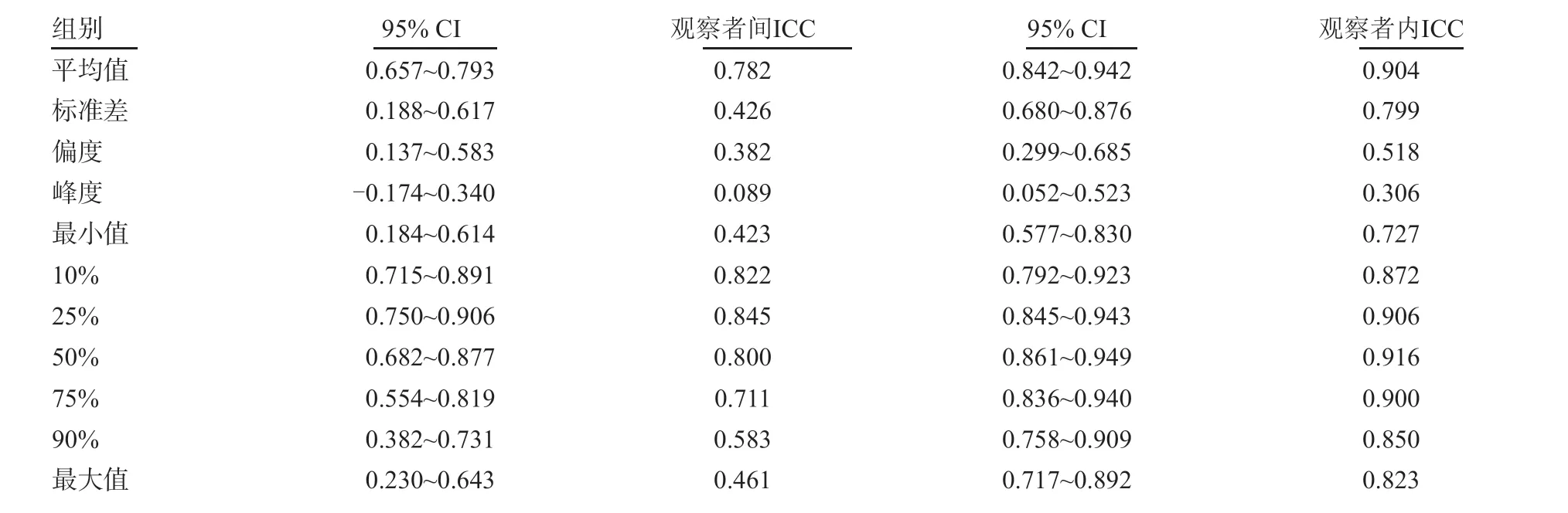
表2 一致性分析
2.3 两组间直方图参数比较及ROC曲线分析
有效组的直方图参数中,最小值、10%和25%的ADC值均明显高于无效组(P<0.05),而标准差小于无效组(P<0.05,表3)。其他大部分有效组的直方图参数有大于无效组的趋势,但差异并无统计学意义。ROC曲线的AUC范围为0.510~0.746,其中10%的ADC值AUC最大,然而其诊断效能与标准差、最小值、25%的ADC值相比,并未明显提高(通过DeLong法比较,P均>0.05)。

表3 有效组与无效组的ROC曲线分析
3 讨 论
本研究将术后病理学检查结果作为NAC疗效的参考标准,探索了ADC值的直方图参数在NAC前预测luminal型乳腺癌患者疗效的应用价值。在测量时,观察者内一致性高于观察者间的一致性。有效组的部分ADC值的直方图参数高于无效组,其中10%、25%的ADC值其AUC相对较高。
Rouzier等[21]研究发现,乳腺癌NAC和辅助化疗均可提高患者生存率,但NAC提高了患者保乳手术率和生活质量。乳腺癌分为5种分子亚型[17],其中luminal型乳腺癌约占所有乳腺癌的2/3,难以达到病理学完全缓解,但与其他亚型相比,其5年生存率更高[4-5]。因此在NAC前预测luminal型患者的疗效非常重要。相关研究[10-11,22]发现在NAC前无法预测luminal型乳腺癌患者的疗效,但这些研究仅纳入了均值,忽略了乳腺肿瘤不均质的特点。例如,乳腺浸润性导管癌不仅包含浸润性癌,还包含有其他成分如基质、肿瘤内纤维化或坏死以及导管内成分[23]。在MRI中,直方图分析是一种不需增加额外影像学检查就可能改善肿瘤异质性评估的数学计算模型[12,24]。目前ADC直方图在乳腺方面的研究成果主要集中于乳腺癌NAC疗效预测[14-16]、乳腺癌预后[25]、乳腺肿瘤病理级别[26-27]、乳腺癌分子亚型[28-29]等,未见将ADC直方图用于luminal型乳腺癌NAC前疗效预测的报道。
本研究发现luminal型乳腺癌在NAC前的ADC值直方图参数中,最小ADC值、10%,25%的ADC值在有效组中显著高于无效组。目前在探讨ADC直方图预测乳腺癌NAC疗效的研究中,有学者[14-16]研究了NAC前的ADC值,然而认为其无法预测疗效。仅Kim等[13]在2018年发表的研究中证实体素内不相干运动(intravoxel incoherent motion,IVIM)模型中平均值、50%及75%的D值能够预测,且反应良好的值高于轻微反应者。笔者认为研究结果有争议的原因,一方面可能是上述研究纳入了有限的直方图参数,如Kim等[13]研究了平均值、25%、50%、75%、峰度及偏度,而Cho等[14]研究了平均值、标准差、最小值、最大值、峰度及偏度;另一方面上述研究均未进一步探讨luminal型乳腺癌的直方图参数,忽略了不同分子亚型可能带来的偏倚。本研究中能够预测NAC疗效的直方图参数均集中在相对较小的ADC值区间。Suo等[18]认为,由于乳腺肿瘤的不均质性,最小值可能反映了肿瘤内部最具侵袭性的成分。因此,笔者认为乳腺癌内部的浸润性成分更多地通过直方图中相对较小的ADC值来反映,而浸润性成分的存在与否则是判断疗效的重要因素。
本研究发现10%的ADC值AUC最大,但与标准差、最小值、25%的ADC值相比,其诊断效能并未明显提高。Kim等[13]通过直方图分析IVIM模型的参数发现,平均值、50%及75%的D值在NAC前可以预测疗效,且仅提到75% D值的AUC为0.70。Cho等[14]通过直方图分析IVIM模型参数发现在NAC前Dp的峰度、偏态及平均值能够预测疗效,但未进一步进行ROC曲线分析。Minarikova等[15]发现,所有NAC前的直方图参数均无法预测疗效,其中AUC最大的为25%的直方图ADC值为0.673,低于本研究同样是25%的直方图ADC值的0.724。然而,这两项研究[13-14]采用的IVIM模型需多个b值,会明显增加患者扫描时间,其直方图ADC值的计算需要更复杂的后处理软件,而且可能会耗费更长的测量时间。此外,上述研究均没有讨论测量方法的一致性。本研究发现最小值、10%、25%及50%的直方图ADC值一致性均较高,而10%、25%的ADC值AUC相对较高(0.746、0.724),提示10%和25%可能是在NAC前预测疗效的较好参数。
本研究仍有缺陷,首先纳入样本量较少,其次本研究是回顾性研究。另外,本次研究采用手动勾画感兴趣区的方法而不是采用自动或半自动感勾画兴趣区。
综上所述,ADC值的直方图参数能够在NAC前预测luminal型乳腺癌患者的疗效,其中10%和25%的ADC值的预测效能相对较高,且一致性较好,这在临床上,有一定的应用价值。
