微波原位灭活联合放射性125I粒子植入术在儿童四肢骨肉瘤保肢治疗中的临床观察
2020-01-09李鼎锋
郭 钧,崔 秋,李鼎锋,周 举,刘 铖,倪 煜,江 宁
1.清华大学第一附属医院骨科,北京 100016;
2.解放军总医院第五医学中心南院区骨科,北京 100071
骨肉瘤是儿童和青少年中占首位的原发恶性骨肿瘤,好发于长骨干骺端,膝关节周围发病率最高。目前,随着新辅助化疗和保肢手术的发展,年龄不再是保肢术的禁忌证。有研究[1]报道,保肢手术对于有病理性骨折的患者同样有效,并且患者局部复发和死亡的危险性不会增加。但儿童骨肉瘤患者处于生长高峰期,骨骺未闭合,骨骼有很强的生长潜能,如何完整切除肿瘤实施保肢,同时满足骨骼生长发育的需要,是骨肿瘤外科的 一大难题。在众多的介入疗法中,放射性125I粒子植入术,即在成像设备的引导下,通过经皮穿刺技术将125I粒子直接植入肿瘤组织,达到治疗目的,因其具有瘤内剂量高、细胞外剂量低、适应度高、并发症少、患者耐受性好等优点,在临床中应用越来越广泛。热疗长期以来被应用于肿瘤切除,其中微波对骨骼等组织的治疗效果更好。微波通过使用多个天线以更快、更高的温度加热更大的肿瘤体积,是骨组织中大体积肿瘤产生热量的理想方法。
本研究采用新辅助动脉化疗后,实施微波原位灭活联合放射性粒子125I植入术治疗儿童四肢骨肉瘤,取得了一定的进展,现对治疗效果进行如下报道。
1 资料和方法
1.1 临床资料
2011年3月—2016年9月,本研究采用微波原位灭活联合放射性125I粒子植入术治疗儿童四肢关节周围骨肉瘤19例。其中男性11例,女性8例,年龄4~14岁,平均年龄8岁。股骨远端8例,胫骨近端7例,肱骨近端4例。按照Enneking肿瘤外科分期,ⅠB期3例,ⅡA期2例,ⅡB期14例。根据San-Julian等[2]儿童干骺端骨肿瘤侵袭情况分型,Ⅰ型肿瘤边缘距骺板>2 cm的患儿16例;Ⅱ型肿瘤与骺板距离<2 cm的患儿2例;Ⅲ型侵及骨骺的患儿1例。
1.2 主要设备及参数
保肢手术主要采用美国AngioDynamics公司RITA医疗系统的微波灭活仪和中国原子能科学研究院的放射性125I粒子。放射性125I粒子半衰期为59.6 d,能量2.59×107Bq,直径0.8 mm,长度4.5 mm。所有患者通过术前精确定位确定术中微波灭活天线的插入深度及灭活范围,放射性粒子的剂量通过治疗计划系统软件运算,粒子间距则根据巴黎系统原则进行设计放置。所有放射源之间均等距(13 mm)、平行、直线排列,方向相同。
1.3 方法
在手术治疗之前先行动脉化疗泵化疗,化疗泵置于同侧肱动脉或股动脉皮下。术前化疗3~5个疗程,术后化疗3次以上。手术方法:根据患者肿瘤部位选择手术体位,逐层显露瘤体。手术中需要保留瘤段骨表面完整的一薄层正常组织,严格无瘤操作。瘤区与软组织间用纱布隔开,将3~8根微波天线(数量由肿瘤体积大小而定)和测温探头插入瘤体至肿瘤边缘以外5 cm处,保证瘤体中心温度在100 ℃以上,表面在50 ℃左右,关节腔内温度不高于37 ℃,持续灭活20~30 min,同时导入冷0.9% NaCl溶液降温,以保护周围正常组织。刮除微波灭活的肿瘤组织及表面焦痂,直视下通过放射性粒子植入器将粒子植入到灭活的瘤骨表面,对于骨缺损处采取自体骨移植或骨水泥填充,同时通过钢板或髓内钉固定灭活瘤段骨。
2 结 果
在所有患儿完成3~5个疗程的术前动脉介入化疗之后,评价其化疗效果,评价指标包括临床症状、影像学分析和肿瘤组织病理坏死率。止痛效果:总有效率94.7%(18/19)。影像学分析:16例(84.2%)影像学改变良好,可更清楚地观察到肿瘤边界,部分区域液化、钙化,骨质破坏程度缩小,病理骨折部位愈合,出现假包膜等(图1~3)。病理坏死率:中重度以上化疗反应17例(89%),术后标本显示不同程度的变性、坏死、纤维化,难以见到典型的肿瘤细胞(图4)。
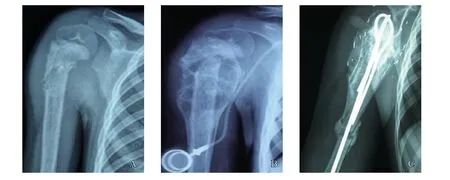
图1 典型病例1(女性,5岁,右肱骨上段骨肉瘤)影像表现
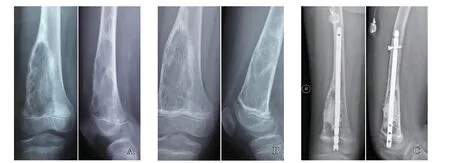
图2 典型病例2(男性,12岁,右股骨远端骨肉瘤)影像表现
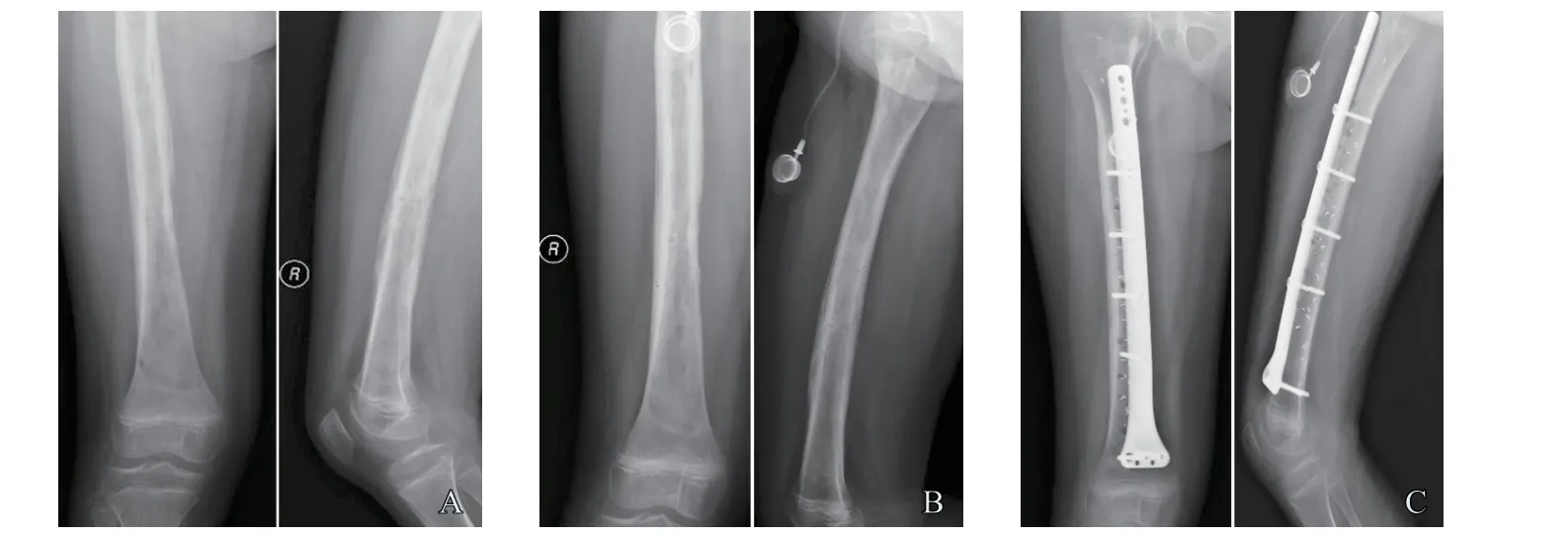
图3 典型病例3(男性,9岁,右股骨长段骨肉瘤)影像表现

图4 骨肉瘤化疗前后病理学改变(H-E染色,×10)
16例(84.2%)肿瘤边缘距骨骺生长板>2 cm的患儿采取了保留骨骺的微波灭活联合放射性粒子植入术(图1~3),术后随访36~96个月,平均47个月。随访期间,患肢平均短缩1.5 cm,对患儿的步态和脊柱发育无明显影响。所有患儿均未见肿瘤局部复发,其中1例术后14个月因肺转移死亡,术后患肢均未发生感染、皮肤坏死、灭活瘤段骨折、内固定物松动及断裂等情况,未见到血管、神经的放射性损伤。术后关节功能评价根据Enneking骨骼肌肉肿瘤术后功能评定标准进行,关节功能恢复至70%以上为优,60%~70%为良,50%~60%为中,50%以下、截肢或死亡为差。本研究中受试者的平均功能评分为86.7%(26分/30分),其中优15例,良2例,中1例,差1例,优良率达到89.5%。
3 讨 论
3.1 儿童骨肉瘤保肢手术的治疗现状
骨肉瘤是儿童、青少年最常见的原发恶性骨肿瘤,好发于干骺端,极大地影响儿童的生长发育。临床中通常需要切除相应的关节和骺板以达到完整切除肿瘤的效果,但这也导致患肢生长受限,造成术后肢体不等长,成为临床有待解决的难题之一[3]。儿童骨肉瘤保肢特点:① 处于生长期,骨骺未闭合;② 距骨骺生长板2 cm(保骺绝对适应证),距骨骺生长板<2 cm(保骺相对适应证),侵及骨骺(不能保骨骺),保肢数年后会出现肢体不等长;③ 软组织条件较成年人差,应用人工关节置换手术并发症较多。儿童骨肉瘤保肢原则:在不增加危险的情况下,遵循个体化原则,根据患者的年龄、预期寿命、肢体功能、肢体等长、外观等因素进行综合判定,使患肢功能最优化,而不是单纯进行保肢术。骨骺牵开保骺术是一种治疗儿童恶性骨肿瘤的方法,但存在移植骨吸收、排斥、延迟愈合、牵引针孔感染,以及血管、神经损伤等并发症[4]。在肿瘤切除后骨缺损的重建方法上,灭活再植[5]、异体骨移植、人工关节假体置换等都有引起局部复发的可能,而假体可使用的年限为10~15年,其在使用过程中其更换与修复,会造成周围正常的骨质大量流失,更有甚者可致截肢[6-7]。
3.2 肿瘤化疗的重要性
无论选择何种保肢手术,规范化疗是提高生存期的关键。自新辅助化疗概念形成及应用以来,骨肉瘤的治疗取得了突破性进展,5年生存率提高到60%以上,保肢率从10%~20%提高到80%~90%。化疗是治疗骨肉瘤原发灶和转移病变的有效手段,同时对改善手术预后作用显著[8]。相关研究[9]表明,手术切除范围足够而化疗反应差的患者,比手术切除范围不足而化疗反应好的患者局部复发率高。我们所采用的动脉新辅助化疗效果与国内外文献报道相近,可保证儿童骨肉瘤保肢术的实施。
3.3 微波原位灭活保肢术治疗儿童骨肉瘤
目前人工关节假体置换已成为骨肿瘤保肢治疗的主流和发展趋势,但并非所有患者都适用,尤其是患儿的骨骼仍处于发育过程中,给膝关节的假体置换术带来了诸多问题[10]。国内李嘉等[11]采用微波原位灭活技术治疗恶性、侵袭性骨肿瘤,患者生存率的提高、复发率的降低以及关节功能的保留均取得了较满意的效果。在骨肉瘤的保肢治疗中,微波因其特有的物理学特性,达到了极好的穿透性。有证据显示微波的灭活效应能使瘤体中心温度达到108 ℃,而其边界温度维持在65 ℃[12]。与人工关节置换术相比,在功能、关节稳定、早期功能锻炼、感染率等方面具有明显的优势,引起临床医师重视并被广泛应用[13-14]。在术中灭活残留的瘤细胞,作为一种持续较久的内置抗原,对肿瘤的控制有着积极的意义[15]。同时,肿瘤微波原位灭活能够保留更多的骨质,对远期行翻修手术十分有利。虽然微波高温灭活易形成死骨,但研究发现,灭活骨于6~12个月可在原位再血管化并出现骨修复再生,成为永久性的再生自体活骨支架,对骨骼发育影响较小[16]。在本次手术中,严格“无瘤”操作,充分暴露肿瘤以及使关节解剖结构最大程度保持完整,术后早期行关节功能康复锻炼,Enneking肢体功能评分优良率达到89.5%。对其中16例(84.2%)患儿采取了保留骨骺的瘤段微波灭活,术后随访期间均出现不同程度的肢体短缩,平均短缩1.5 cm,对患儿的步态和脊柱发育无明显影响,可能与术中微波灭活时骺板受损及内固定材料影响骨骺生长等有关,需要进一步探讨和解决。
3.4 放射性粒子配合保肢术预防恶性肿瘤局部复发
至今,多数研究者认为,化疗的敏感性及手术范围是影响肿瘤复发的重要因素,且患者预后与局部复发具有相关性。因此,控制肿瘤的局部复发非常重要,尤其是处于局部复发的高危患者,如ⅡB期、有病理性骨折的骨肉瘤患者,需要进一步采取治疗措施如放射性粒子植入。国外于1999年用放射性粒子治疗复发性软组织肉瘤取得良好效果后[17],更多的放射性粒子也被应用于骨与软组织肿瘤的治疗[18]。本课题组所在科室于2004年采用将放射性粒子与各种保肢术配合的方法预防恶性肿瘤局部复发,取得了一定的效果[19]。究其原因,放射性125I粒子是近距离放疗的一种手段,避免了传统放疗的缺点,具有低能、持续累积剂量杀肿瘤细胞,靶区剂量分布均匀、安全及易防护等优点。本研究采用微波原位灭活联合放射性粒子植入的方法,可明显地降低儿童四肢骨肉瘤保肢术后的局部复发率。
综上所述,儿童骨肉瘤的保肢治疗具有其特殊性,在有效的新辅助化疗前提下,微波原位灭活联合放射性125I粒子植入术具有操作简便、临床疗效好、并发症少和术后复发率低等特点。能为患儿保留更多骨量及软组织覆盖,为患儿骨骼成熟后假体置换等处置提供更多选择,是一种可行的手术方式,远期效果有待进一步观察。
