ARID1A、E-cadherin和EphA2在胃癌及癌前病变中的表达及临床意义
2020-01-08
人ARID1A基因,即AT丰富结合域1A,属于酵母交换型转换/蔗糖不发酵(SWI/SNF)复合物的非催化亚基,其功能障碍可引起染色质重塑异常,导致基因表达调节紊乱,进而引发多种疾病。人源性E-钙黏蛋白(E-cadherin)由CDH1基因编码,主要分布于上皮细胞表面,可促进细胞间的连接,与细胞的黏附功能密切相关,而该功能对于多种组织中不同细胞的细胞间隙及细胞相互作用的稳态至关重要[1]。EphA2基因,即促红细胞生成素产生肝细胞A2受体,是首个被筛选出来的 Eph 受体酪氨酸亚家族成员,其在细胞膜上有磷酸化和非磷酸化两种状态,在正常上皮细胞中,EphA2受体与其配体结合,构象发生改变,导致自身磷酸化而被降解;而肿瘤细胞的EphA2受体主要以非磷酸化状态存在,并且表达增高。本文探究了三者在胃黏膜癌变过程中的作用、三者之间的相互关系及临床意义,为胃癌的早期诊断及治疗提供参考。
1 对象和方法
1.1 研究对象
收集2017年6月至2018年12月在内蒙古医科大学第三附属医院消化内科内窥镜中心行胃镜检查,且同时行活组织检查的150例患者的组织石蜡标本,分为慢性非萎缩性胃炎组、慢性萎缩性胃炎伴肠化组、低级别上皮内瘤变组、高级别上皮内瘤变组和胃癌组,每组各30例。所有标本均由两位内镜专家及两位病理学专家根据内镜形态学和病理组织学特征确认。入组标准:(1)签署入组知情同意书;(2)胃癌患者检查前未接受化学治疗或放射治疗;(3)近4周内未服用质子泵抑制剂、糖皮质激素类药物、非甾体类抗炎药(NSAID);(4)近4周内无饮酒史。排除标准:(1)存在胃镜检查禁忌证;(2)身体其他部位存在肿瘤;(3)存在严重的肝肾功能不全、肝硬化、糖尿病及凝血功能异常。
1.2 实验分组情况
慢性非萎缩性胃炎组30例,其中男性17例,女性13例,平均年龄(38.47±11.90)岁;慢性萎缩性胃炎伴肠化组30例,其中男性15例,女性15例,平均年龄(38.80±11.84)岁;低级别上皮内瘤变组30例,其中男性20例,女性10例,平均年龄(41.83±9.83)岁;高级别上皮内瘤变组30例,其中男性20例,女性10例,平均年龄(41.50±8.38)岁;胃癌组30例,其中男性22例,女性8例,平均年龄(43.10±9.72)岁。各组患者的性别及年龄相比较,差异无统计学意义(P>0.05),具有可比性。
1.3 主要材料和试剂
ARID1A兔抗人多克隆抗体、E-cadherin兔抗人多克隆抗体、EphA2兔抗人多克隆抗体均购自武汉博士德生物工程有限公司。即用型免疫组织化学超敏SP检测试剂盒、DAB显色试剂盒、PBS磷酸盐缓冲液(粉剂)、柠檬酸盐抗原修复液均购自福州迈新生物技术公司。
1.4 实验方法
将标本组织进行固定、脱水、浸蜡、包埋和切片处理后,按5 μm厚度切取3张切片,分别进行ARID1A、E-cadherin、EphA2的免疫组织化学染色。实验步骤:将选择好的组织石蜡切片进行常规脱蜡、脱水→高压锅中进行抗原热修复→加入内源性过氧化物酶→加入非免疫性动物血清封闭液→分别滴加1∶100的一抗稀释液盖住组织,4 ℃过夜→加入生物素标记的二抗→加入链霉菌抗生物素蛋白-过氧化物酶→滴加DAB工作液进行显色→苏木素复染,梯度酒精中脱水、透明、封片,玻片晾干后镜下观察,随后进行图片采集及结果汇总。
1.5 染色结果
ARID1A、E-cadherin和EphA2的免疫组织化学阳性产物为棕色或棕褐色颗粒,其中ARID1A定位于细胞核中,E-cadherin定位于细胞膜和细胞质中,EphA2定位于细胞质中。Bresalier半定量公式用于判断各组的染色情况,随机选取高倍镜下的10个视野区,根据细胞染色强度对每个高倍视野区进行分级,共分为4级:阴性(-)、弱阳性(+)、强阳性(++)和强阳性(+++);细胞未着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。通过计数已着色的视野数,按照下列公式计算切片的平均染色强度:IS(intensity store)=∑{(0×F0)+(1×F1)+(2×F2)+(3×F3)},F= %×10视野。
1.6 统计学处理
采用SPSS 21.0软件进行数据分析及处理。采用Krusral-wallisH非参数检验,P<0.05为差异有统计学意义。对慢性非萎缩性胃炎组、慢性萎缩性胃炎伴肠化组、低级别上皮内瘤变组、高级别上皮内瘤变组、胃癌组间进行Bonferroni法多重比较(组间采用Mann-WhitneyU检验),以校验P*<0.005(P<0.05)为差异有统计学意义。通过Kendall′stau-b等级相关分析法分析ARID1A、E-cadherin和EphA2之间表达的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 ARID1A在各组中表达水平的比较
采用Krusral-wallisH方法检验ARID1A在各组中的表达秩均值,结果分别为105.65、95.87、79.33、53.03和43.62,表达呈逐渐递减趋势,差异具有统计学意义(χ2=49.188,P<0.01)。对各组间进行Bonferroni法多重比较,结果显示ARID1A在慢性非萎缩性胃炎组与慢性萎缩性胃炎伴肠化组中的表达水平差异无统计学意义(P>0.05),在慢性非萎缩性胃炎组、慢性萎缩性胃炎伴肠化组与低级别上皮内瘤变组中的表达水平差异具有统计学意义(P<0.05),在低级别上皮内瘤变组与高级别上皮内瘤变组、胃癌组中的表达水平差异具有统计学意义(P<0.05)。见图1。
2.2 E-cadherin在各组中表达水平的比较
采用Krusral-wallisH方法检验 E-cadherin在各组中的表达秩均值,结果分别为104.38、96.43、76.68、55.93和44.07,表达呈逐渐递减趋势,差异具有统计学意义(χ2=46.670,P<0.01)。对各组间进行Bonferroni法多重比较,结果显示E-cadherin在慢性非萎缩性胃炎组与慢性萎缩性胃炎伴肠化组中的表达水平差异无统计学意义(P>0.05),在慢性非萎缩性胃炎组、慢性萎缩性胃炎伴肠化组与低级别上皮内瘤变组中的表达水平差异具有统计学意义(P<0.05),在低级别上皮内瘤变组与高级别上皮内瘤变组、胃癌组中的表达水平差异具有统计学意义(P<0.05)。见图2。
2.3 EphA2在各组中表达水平的比较
采用Krusral-wallisH方法检验EphA2在各组中的表达秩均值,结果分别为34.35、62.32、78.05、99.37和103.42,表达呈逐渐递增趋势,差异具有统计学意义(χ2=57.488,P<0.01)。对各组间进行Bonferroni法多重比较,结果显示EphA2在慢性萎缩性胃炎伴肠化组与低级别上皮内瘤变组中的表达水平差异无统计学意义(P>0.05);在高级别上皮内瘤变组与胃癌组中的表达水平差异无统计学意义(P>0.05);在慢性萎缩性胃炎伴肠化组、低级别上皮内瘤变组中与高级别上皮内瘤变组、胃癌组中的表达水平差异具有统计学意义(P<0.05),与慢性非萎缩性胃炎组中的表达水平差异具有统计学意义(P<0.05)。见图3。

图1ARID1A在不同胃黏膜组织中的表达水平 免疫组织化学染色 ×400A慢性非萎缩性胃炎组B慢性萎缩性胃炎伴肠化组C低级别上皮内瘤变组D高级别上皮内瘤变组E胃癌组
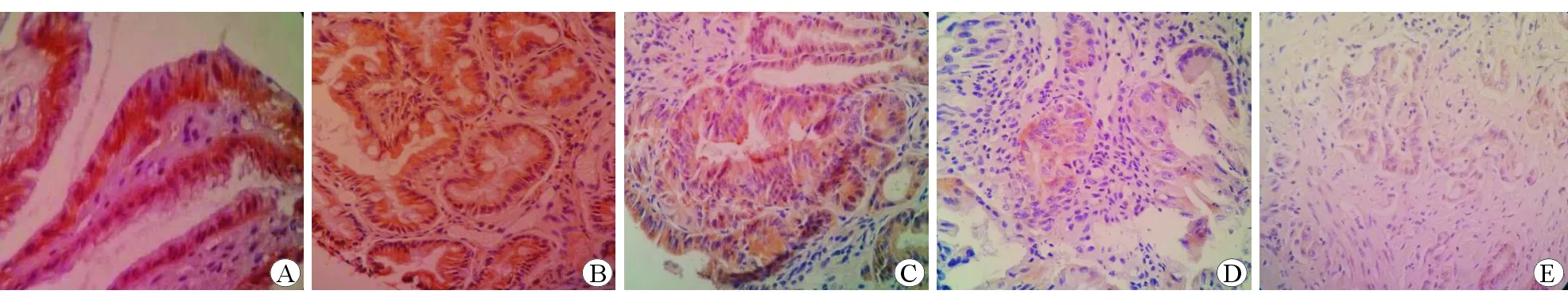
图2E-cadherin在不同胃黏膜组织中的表达水平 免疫组织化学染色 ×400A慢性非萎缩性胃炎组B慢性萎缩性胃炎伴肠化组C低级别上皮内瘤变组D高级别上皮内瘤变组E胃癌组

图3EphA2在不同胃黏膜组织中的表达水平 免疫组织化学染色 ×400A慢性非萎缩性胃炎组B慢性萎缩性胃炎伴肠化组C低级别上皮内瘤变组D高级别上皮内瘤变组E胃癌组
2.4 ARID1A、E-cadherin和EphA2在各组中相关性的比较
采用Kendall′stau-b方法检验ARID1A、E-cadherin和EphA2在各组间表达的相关性。结果显示,在慢性非萎缩性胃炎组中,ARID1A与E-cadherin表达呈显著正相关,E-cadherin与EphA2表达呈显著负相关,ARID1A与EphA2表达呈显著负相关(P均<0.05)。在慢性萎缩性胃炎伴肠化组中,ARID1A与E-cadherin表达呈显著正相关,E-cadherin与EphA2表达呈显著负相关,ARID1A与EphA2表达呈显著负相关(P均<0.05)。在低级别上皮内瘤变组中,ARID1A与E-cadherin表达呈显著正相关,E-cadherin与EphA2表达呈显著负相关,ARID1A与EphA2表达呈显著负相关(P均<0.05)。在高级别上皮内瘤变组中,ARID1A与E-cadherin表达呈显著正相关,E-cadherin与EphA2表达呈显著负相关,ARID1A与EphA2表达呈显著负相关(P均<0.05)。在胃癌组中,ARID1A与E-cadherin表达呈显著正相关,E-cadherin与EphA2表达呈显著负相关,ARID1A与EphA2表达呈显著负相关(P均<0.05)。具体见表1、2、3。

表1 各组中ARID1A与E-cadherin表达强度的相关性分析

表2 各组中EphA2与E-cadherin表达强度的相关性分析

表3 各组中EphA2与ARID1A表达强度的相关性分析
3 讨论
SWI/SNF复合物是重要的染色质重塑复合物之一,主要由核心亚单位、催化亚单位和调节单位组成,借助三磷酸腺苷(ATP)水解释放的能量更改核小体与基因启动子、增强子等区域的DNA结合位点,调控基因的转录表达。作为SWI/SNF复合物的调节亚单位之一,ARID1A可以特异性地调节该过程的基因表达[2]。近年来由于外显子测序的广泛应用,发现ARID1A在多种肿瘤中存在高频失活突变,这是许多恶性肿瘤发生的重要原因[3]。另外,ARID1A突变与EB病毒(EBV)感染、微卫星不稳定性显著相关[4]。Zhang等[5]的研究发现,ARID1A表达下调会促进胃癌细胞增殖、细胞生长及营养消耗,同时还会直接作用于PIK3CA和PDK1靶基因,激活PI3K/Akt信号通路,参与胃癌的发生、发展。本研究结果表明,ARID1A在各组中的表达呈逐渐递减趋势,推测ARID1A在胃癌癌前病变进展至胃癌的过程中存在表达缺失,其可能作为一种抑癌基因在胃癌的发展过程中发挥重要作用。此外,本研究发现ARID1A在高级别上皮内瘤变中的表达水平明显降低,虽通过多重比较发现高级别上皮内瘤变组与胃癌组间的表达差异无统计学意义(校验前P*>0.005,校验后P>0.05),但单独比较ARID1A在两组中的表达水平差异仍具有统计学意义(校验前P*<0.05),提示该基因的表达失活参与了胃癌的形成过程。因此,ARID1A可能在胃癌的靶向性预防及治疗中发挥重要作用。ARID1A的抑癌机制非常复杂,如果能进一步具体阐明其抑癌机制,将对肿瘤的形成、发展及诊治的研究提供一个新的思路。
E-cadherin是一种钙依赖性跨膜糖蛋白,主要介导同源细胞与细胞间的连接和黏附,是上皮细胞中维护细胞形态结构完整性和极性的重要黏附分子,具有抑制肿瘤细胞浸润和转移的功能。在正常组织中,E-cadherin表达下调可降低同种细胞间的黏附功能,细胞形态发生变化,导致功能障碍,不能正常发育;在肿瘤细胞中,E-cadherin表达下调可降低肿瘤细胞间的黏附作用,细胞骨架形态发生改变,有利于肿瘤细胞从原发灶脱落向远处侵袭、转移[6]。本研究结果表明,E-cadherin在各组中表达呈逐渐递减趋势,提示E-cadherin表达降低可升高胃癌的发生率。此外,本研究发现E-cadherin在高级别上皮内瘤变中的表达水平明显降低,经多重比较发现高级别上皮内瘤变组与胃癌组间的表达差异无统计学意义(校验前P*>0.005,校验后P>0.05),推测可能有以下几种原因:一方面,胃黏膜高级别上皮内瘤变实际上大部分已同时存在癌变[7],其浸润和转移的危险度明显升高[8];另一方面,由于病理科医生对早期胃癌不够重视,在诊断尺度把握上也存在差异,对于无法看到的浸润性癌变的活组织检查样本诊断保守,可能将恶性肿瘤误判为高级别上皮内瘤变。因此,E-cadherin可能是胃黏膜癌变的早期分子事件,从低级别上皮内瘤变这一阶段开始进行积极有效地监测或干预,可能成为防治胃癌的有效途径之一。
EphA2属于受体酪氨酸激酶(RTK)亚家族之一,可通过胞外配体结合区与其配体EphrinA1结合形成受体-配体复合物,使其构象发生改变,导致自身磷酸化被降解,通过一系列信号转导参与细胞的生长、迁移和分化,在胚胎发育、血管生成、肿瘤形成等方面起重要作用。研究发现,EphA2通常在正常上皮细胞中低表达,而在胶质瘤、胃癌、肝细胞癌、结直肠癌等实体瘤中过表达,并且与肿瘤的转移和预后密切相关[9-12]。翟道宽等[13]的研究表明,在肝细胞癌中EphA2可通过调节E-cadherin的表达来发挥肿瘤细胞侵袭、转移作用,其机制可能是活化了Wnt/β-catenin通路,从而促进肝癌细胞发生上皮-间质转化(EMT),因此EphA2可能是肿瘤EMT过程中的调控分子。本研究结果表明,EphA2在各组中表达呈逐渐递增趋势,提示EphA2的异常活化可能是胃癌的早期事件,对胃癌的形成和发展具有重要作用。因此,如果能尽早地在分子水平上抑制EphA2表达,有望阻止胃癌的形成或发展。
本研究结果显示,ARID1A、E-cadherin和EphA2在各组中的表达具有相关性。其中,ARID1A与E-cadherin在各组中的表达呈正相关,提示两者可能协同促进胃癌的发生、发展,这也证实了Yan等[14]的研究结果,他们通过在胃癌细胞中构建E-cadherin启动子区域的报告基因,结果显示敲低ARID1A后,含CDH1启动子区域的报告基因数值显著下降,E-cadherin的表达水平也随之降低,细胞迁移、侵袭能力变强,提示ARID1A与CDH1的转录相关,由此得出ARID1A可能通过基因转录调控E-cadherin的表达,是肿瘤EMT过程中的调控分子。在上皮细胞中,E-cadherin与EphA2共同定位于上皮细胞的外侧缘,特别是细胞接触的部位[15],因此,两者可以相互调节。一方面,E-cadherin表达缺失和功能改变会使细胞的黏附性降低,影响EphA2的磷酸化及其与膜结合配体的膜定位,从而升高EphA2的表达[16];另一方面,EphA2表达升高也会破坏黏附连接,加速细胞接触的分离,导致细胞接触处E-cadherin表达下调更快[17]。本研究结果显示E-cadherin与EphA2在各组中的表达呈负相关,推测可能由于E-cadherin与EphA2黏附功能方面相互影响,形成负反馈环,因此,两者在胃黏膜癌变过程中可能存在拮抗作用。此外,本研究还发现,ARID1A与EphA2在各组中的表达呈负相关,推测在胃癌发生过程中,由于ARID1A的失活突变而触发了E-cadherin的低表达,而EphA2高表达的主要原因与E-cadherin表达降低有关,因而ARID1A在此过程中占据主导地位,EphA2可能受到ARID1A的间接调控作用。众所周知,EMT被认为是肿瘤细胞侵袭和转移的特征性事件,而E-cadherin表达下降或缺失是 EMT 的重要标志之一[18]。ARID1A和EphA2作为肿瘤EMT过程中的调控分子,异常表达后均可下调E-cadherin的表达,促进肿瘤细胞的侵袭、转移。因此,ARID1A、E-cadherin和EphA2在胃黏膜癌变过程中可相互影响,且其中ARID1A起决定性作用。
综上所述,ARID1A蛋白、E-cadherin蛋白的低表达,以及EphA2蛋白的高表达在胃癌的发生、发展过程中发挥着重要的作用,共同促进了胃癌的形成与发展,早期检测三者在胃癌癌前病变中的表达水平,将有助于判断病变的严重程度和进展趋势,能够更早地干预和治疗早期胃癌、逆转癌前病变,有望成为日后胃癌免疫治疗的新亮点。
