慢病毒介导miR-17过表达对溃疡性结肠炎小鼠的影响及机制初探
2020-01-08
溃疡性结肠炎(UC)属于炎症性肠病(IBD),好发于直肠和乙状结肠[1]。UC的发病机制目前尚未完全明确,其与环境、遗传、感染、细胞凋亡及免疫等多种因素相关。有研究显示,肠道黏膜细胞对维持肠道微生态平衡具有重要作用,而肠道黏膜细胞凋亡率升高将导致肠道黏膜屏障受损[2]。肠道黏膜屏障受损与UC久治不愈、病情反复密切相关。miR-17是由6个序列相似、结构相仿的核苷酸组成的RNA分子,其序列高度保守,存在于基因组中内含子的非编码区[3]。研究表明,miR-17主要与细胞凋亡、细胞周期调控相关[4]。本研究探讨了miR-17过表达对UC小鼠结肠组织的影响及可能的机制,以期为UC的治疗提供新的思路。
1 材料和方法
1.1 实验动物
SPF级BALB/c小鼠,雄性,共45只,体质量为25~32 g。由中国医科大学提供,许可证号:SYXK(辽)2018-0087。室温保持22 ℃~28 ℃,相对湿度35%~75%,昼夜自然光照,适应性饲养1周。
1.2 主要试剂与仪器
试剂:2,4,6-三硝基苯磺酸(TNBS)(美国Sigma公司),裂解液(美国BD公司),Tunel检测试剂盒(上海碧云天公司),水合氯醛(天津福星公司),BCA蛋白定量测定试剂盒(上海碧云天公司),HE染色试剂盒(北京索莱宝公司)、RNA提取试剂盒、反转录试剂盒(美国Beyotime公司),兔单克隆抗Bim抗体(美国PAA公司),HRP标记羊抗兔二抗(上海碧云天公司),SDS-PAGE凝胶配置试剂盒(南京建成公司),ECL发光试剂盒(美国Thermo公司)。 仪器:垂直电泳槽、稳压稳流电泳仪、RT-PCR反应扩增仪(美国Bio-Rad公司)。本研究由沈阳万类生物公司设计引物,引物序列见表1。
1.3 分组与UC模型构建
35只小鼠适应性饲养1周后,禁食不禁水维持24 h,腹腔注射4%水合氯醛溶液(40 mg/kg),待小鼠麻醉后,从小鼠的肛门插入直径为5 mm的硅胶管,进深约8 mm;该管另一端连接注射器,一次性注射2.5%TNBS乙醇溶液(TNBS溶于50 %的乙醇水溶液)灌肠(100 mg/kg),灌肠完毕后,提拉尾巴使小鼠倒立3 min,放回原笼继续饲养,参照文献[5]制作UC模型。随机选取5只小鼠处死,取结肠组织进行病理学观察,判断小鼠UC模型构建成功与否。将30只UC模型构建成功的小鼠随机分成模型组(B组)、模型+空载体组(C组)、模型+miR-17过表达组(D组),每组10只;另取10只小鼠用上述方法注射100 mg/kg的生理盐水灌肠,设为正常组(A组)。其中C组小鼠在第1、7、14、21天时于尾静脉注射慢病毒空载体100 μL;D组小鼠于相同时间点注射等量的miR-17过表达慢病毒载体;最后1次注射1周后处死全部4组小鼠,并将结肠组织存于-80 ℃冰箱中。

表1 引物序列
1.4 小鼠症状观察与评分
实验开始后,每日记录每只小鼠的体质量,观察每只小鼠的粪便情况以及便血情况,根据UC的疾病活动指数(DAI)标准,并参照文献[6]进行评分。具体如下:体质量无下降,粪便正常且无便血计0分;体质量下降<5 %,粪便松散且无便血计1分;体质量下降5 %~10 %,粪便松散有便血计2分;体质量下降11 %~15 %,稀便,有便血计3分;体质量下降>15 %,稀便,肉眼血便计4分。
1.5 HE染色观察小鼠结肠组织病理变化
将固定于4 %多聚甲醛溶液中的结肠组织取出,然后进行脱水、透明、石蜡包埋和切片,对组织切片进行脱蜡、水化、染色和封片。利用显微镜观察切片。
1.6 TUNEL法检测小鼠结肠组织细胞凋亡情况
将小鼠结肠组织从4%多聚甲醛溶液中取出,制成石蜡切片;采用3 %过氧化氢溶液室温孵育5 min,0.05 mol/L枸橼酸盐溶液100 ℃修复10 min,15%脱脂奶粉溶液封闭1 h,之后用1∶500 TUNEL检测液室温孵育90 min,1∶500荧光素抗体37 ℃孵育60 min,Hoechst室温孵育5 min,封片,利用荧光显微镜观察并拍照。结果判定标准:凋亡细胞的细胞核呈黄棕色或黄褐色,并且呈散状分布,周围无炎性细胞浸润,核固缩或核碎裂。凋亡指数=(凋亡阳性细胞核数/总细胞数)×100 %。
1.7 RT-PCR法检测小鼠结肠组织中Bim mRNA、PTEN mRNA的表达水平
从-80 ℃冰箱中取出小鼠结肠组织80 mg,加入RNAiso Plus 1 000 μL剪碎,研磨匀浆,室温中加入各项反应试剂,37 ℃温育,60 min;70 ℃温育10 min。以U6为内参,95 ℃ 10 min;95 ℃ 5 s,60 ℃ 35 s,40个循环。采用2-ΔΔCt法对实验数据进行分析。
1.8 Western Blot法检测小鼠结肠组织中Bim蛋白的水平
从-80 ℃冰箱中取出小鼠结肠组织,加入裂解液[组织体质量(mg)∶裂解液(μL)=1∶9],4 ℃离心20 min,提取上清液中的总蛋白,利用BCA蛋白检测试剂盒检测样本总蛋白浓度;随后加入25 %的上样缓冲液,沸水浴10 min变性;应用SDS-PAGE凝胶配置试剂盒进行电泳;完毕后将蛋白转移至PVDF膜上。1∶400兔单克隆Bim一抗4 ℃孵育过夜,1∶1 400 HRP标记羊抗兔IgG室温孵育1 h,用ECL发光液避光显影。应用Image J-pro 6.0 软件进行灰度值扫描分析,得出目的蛋白表达的相对值。
1.9 统计学方法

2 结果
2.1 各组症状及DAI评分比较
A、B、C、D组小鼠DAI评分分别为(0.10±0.03)分、(3.60±0.05)分、(3.53±0.60)分和(1.57±0.36)分,差异有统计学意义(F=113.57,P<0.001)。与A组相比,B、C、D组小鼠的DAI评分均显著升高,差异具有统计学意义(q=22.112 7、21.670 5、9.287 3,P<0.05)。与B组相比,C组小鼠的DAI评分差异无统计学意义(q=0.442 2,P>0.05),而D组则显著降低(q=12.825 4,P<0.05)。与C组相比,D组小鼠DAI评分显著降低,差异有统计学意义(q=12.383 1,P<0.05)。
2.2 各组小鼠结肠组织切片病理学比较
A组结肠组织细胞排列整齐,无明显的炎性细胞浸润及纤维化,也没有观察到任何病变。与A组相比,B、C组小鼠结肠组织出现明显的炎性细胞浸润及纤维化,D组较B、C组明显改善。见图1。
2.3 各组小鼠结肠组织TUNEL分析比较
A、B、C、D 组小鼠结肠组织细胞凋亡指数分别为(4.05±3.97)%、(77.68±5.89)%、(71.98±6.72)%和(30.20±8.64)%,差异有统计学意义(F=288.81,P<0.001)。与A组相比,B、C、D 组小鼠结肠组织细胞凋亡指数均显著升高,差异具有统计学意义(q=35.688 4、32.925 6,12.674 9,P<0.05)。与B组相比,C组差异无统计学意义(q=2.762 8,P>0.05),而D组则显著降低(q=23.013 5,P<0.05)。与C组相比,D组小鼠结肠组织细胞凋亡指数显著降低,差异具有统计学意义(q=20.250 7,P<0.05)。见图2。

图1各组小鼠结肠组织光镜下的病理改变 HE染色 ×200A正常小鼠B模型组C模型+空载体组D模型+miR-17过表达组

图2各组小鼠结肠组织TUNEL分析 HE染色 ×200A正常小鼠B模型组C模型+空载体组D模型+miR-17过表达组
2.4 各组小鼠结肠组织中Bim mRNA、PTEN mRNA的表达水平比较
如表2所示,4组小鼠结肠组织中Bim mRNA、PTEN mRNA的表达水平相比较,差异有统计学意义(F=36.88、86.67,P<0.001)。与A组相比,B、C、D组小鼠结肠组织中Bim mRNA、PTEN mRNA的表达水平均显著升高,差异具有统计学意义(q=12.694 4、12.933 9、7.305 3,P<0.05;q=17.985 9、19.569 6、6.900 3,P<0.05)。与B组相比,C组小鼠结肠组织中Bim mRNA、PTEN mRNA的表达水平差异均无统计学意义(q=0.239 5、1.587 3,P>0.05),而D组则均显著降低,差异具有统计学意义(q=5.389 1、11.085 7,P<0.05)。与C组相比,D组小鼠结肠组织中Bim mRNA、PTEN mRNA的表达水平均显著降低,差异具有统计学意义(q=5.628 6、12.669 3,P<0.05)。

表2 各组小鼠结肠组织中Bim mRNA、PTEN mRNA的表达水平
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05
2.5 各组小鼠结肠组织中Bim蛋白的表达水平比较
A、B、C、D组小鼠结肠组织中Bim蛋白的相对表达水平分别为0.39±0.16、0.93±0.17、0.70±0.18和0.36±0.18,差异具有统计学意义(F=17.25,P<0.001)。与A组相比,B、C组小鼠结肠组织中Bim蛋白的相对表达水平均显著升高,差异具有统计学意义(q=7.869 7、5.605 9,P<0.05)。与B组相比,C组小鼠结肠组织中Bim蛋白的相对表达水平差异无统计学意义(q=2.260 0,P>0.05),而D组则显著降低(q=8.398 3,P<0.05)。与C组相比,D组小鼠结肠组织中Bim蛋白的相对表达水平显著降低,差异具有统计学意义(q=6.138 3,P<0.05)。见图3。
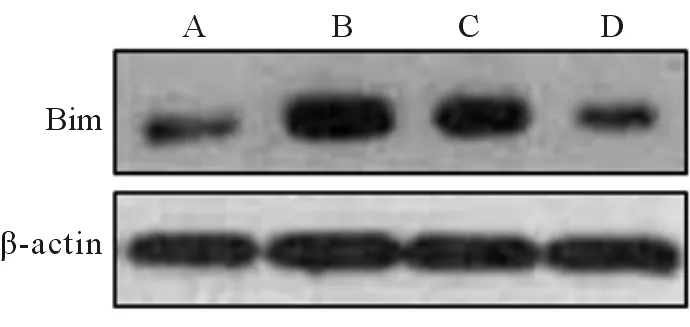
图3 各组小鼠结肠组织中Bim蛋白的表达
3 讨论
UC患者多伴有肠道炎性反应和肠道黏膜溃疡性损伤,主要表现为腹痛、腹泻等[7]。研究发现,UC是诱发结直肠癌的危险因素[8]。UC的病因较为复杂,其发病机制尚未完全阐明,多数学者认为其发病机制可能与遗传、环境、免疫、肠道菌群失调及黏膜细胞过度凋亡等因素有关[9-12]。UC反复发作可能是因结肠黏膜细胞凋亡增多导致屏障功能受损所致[13]。因此,抑制肠道黏膜细胞凋亡可能对UC的肠道屏障修复起重要作用。本研究给予小鼠2.5% TNBS乙醇溶液灌肠构建UC模型,通过慢病毒转染miR-17使之过表达抑制肠道黏膜细胞凋亡,观察UC小鼠的症状及结肠黏膜病理变化,并探究其机制。
本研究基于小鼠的症状、体征、DAI评分和小鼠结肠组织病理学检查,评价UC造模成功与否,结果显示,与正常小鼠相比,UC模型小鼠出现明显的UC症状及体征,并且DAI评分明显升高,小鼠结肠组织出现明显病理损伤,表明UC小鼠模型造模成功。本研究观察了慢病毒介导miR-17过表达对UC小鼠的影响,并通过光镜观察各组小鼠结肠的病理变化,结果表明过表达miR-17可能减轻UC小鼠结肠组织的病理损伤,使得溃疡得到抑制并逐渐愈合。本研究结果表明,UC小鼠结肠黏膜细胞的凋亡指数显著增加,导致溃疡加重,而过表达miR-17可使小鼠结肠黏膜细胞的凋亡指数明显下降;同时,本研究进一步验证了Bim mRNA、PTEN mRNA及Bim蛋白的表达情况,也得出上述结论。提示过表达miR-17可能是通过降低Bim蛋白表达而抑制了PTEN/Akt通路,下调UC小鼠结肠黏膜细胞的凋亡,从而使得UC小鼠的结肠组织溃疡受到抑制。
综上所述,过表达miR-17对UC小鼠具有保护作用,其机制可能与降低Bim蛋白表达及抑制PTEN/Akt通路有关,推测miR-17可能是UC的新靶点,但其具体机制还需要进一步探究。
