高强度间歇训练对自发性高血压大鼠肾脏纤维化的影响
2020-01-07付常喜李平秦永生彭朋
付常喜 李平 秦永生 彭朋

摘 要:目的:观察高强度间歇训练(HIT)对自发性高血压大鼠(SHR)肾脏纤维化的影响并探讨炎症反应和胶原代谢通路(合成代谢和分解代谢)在其间的作用机制,为制定针对高血压肾病患者的最佳运动康复处方提供依据。方法:30只雄性SHR随机分为安静对照组(SHR-Sed)和HIT组(SHR-HIT),同时将15只Wistar-Kyoto大鼠作为正常血压组(WKY)。SHR-HIT组大鼠进行为期8周的间歇跑台运动(5 d/week),WKY和SHR-Sed组保持安静状态。实验后利用无创血压测量仪测定尾动脉血压;以24 h尿蛋白含量、血尿素氮(BUN)和血清肌酐(SCr)含量作为肾功能参数;分离肾脏,利用HE和Masson染色进行组织病理学观察,获取间质胶原容积分数(CVF),Western blot法检测肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、环氧合酶2(COX-2)、转化生长因子β1(TGF-β1)、磷酸化Smad2/3(p-Smad2/3)、结缔组织生长因子(CTGF)、基质金属蛋白酶-2(MMP-2)、MMP-9以及组织金属蛋白酶抑制物-1(TIMP-1)蛋白表达量。结果:与WKY组比较,SHR-Sed组大鼠血压、CVF以及24 h尿蛋白含量、BUN和SCr含量升高(P<0.05),肾脏TNF-α、IL-6、COX-2、TGF-β1、p-Smad2/3、CTGF和TIMP-1蛋白表达量上调(P<0.05),MMP-2和MMP-9表达量以及MMP-2/TIMP-1和MMP-9/TIMP-1比值下降(P<0.05);与SHR-Sed组比较,SHR-HIT组血压和CVF下降(P<0.05),TNF-α、IL-6、COX-2、TGF-β1、p-Smad2/3、CTGF、TIMP-1、MMP-2和MMP-9蛋白表達量以及MMP-2/TIMP-1和MMP-9/TIMP-1比值均显著性下降(P<0.05),24 h尿蛋白含量、BUN和SCr含量无显著性变化(P>0.05)。结论:8周HIT能够减轻炎症反应并抑制胶原合成代谢进而改善SHR肾脏纤维化。然而由于胶原分解代谢通路同样受到抑制且肾功能并未改变,长期HIT对高血压肾病的健康效应尚待进一步证实。
关键词:高强度间歇训练;高血压;肾脏纤维化;炎症反应;细胞外基质
中图分类号:G804.2 文献标识码:A 文章编号:1006-2076(2020)03-0075-08
Abstract:Objective:To evaluate the effects of high intensity interval training (HIT) on renal fibrosis and investigate the possible mechanism of inflammatory reaction and collagen metabolic pathway (anabolism and catabolism) in spontaneously hypertensive rats (SHR), helping to provide evidence for optimal exercise rehabilitation prescription in patients of hypertensive nephropathy. Methods: 30 male SHR were randomly divided to sedentary (SHR-Sed) and HIT (SHR-HIT) groups, and 15 Wistar-Kyoto (WKY) were used as normotensive group. Animals in SHR-HIT group performed interval treadmill running training (5 d/week) for 8 weeks while those of WKY and SHR-Sed groups kept quietly. After test, parameters were measured including caudal artery blood pressure by non-invasive blood pressure tester, renal function by 24 h urine protein, blood urea nitrogen (BUN) and serum creatinine (SCr), histopathological observation by HE and Masson's staining to obtain interstitial collagen volume fraction (CVF), protein expression of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), cyclooxygenase-2 (COX-2), transforming growth factor-β1 (TGF-β1), phosphorylation of Smad2/3 (p-Smad2/3), connective tissue growth factor (CTGF), matrix metalloproteinase-2 (MMP-2), MMP-9 and tissue inhibitors of metalloproteinase-1 (TIMP-1) by Western blot. Results: Compared with WKY group, blood pressure, CVF, 24 h urine protein, BUN and SCr increased (P<0.05), protein level of TNF-α, IL-6, COX-2, TGF-β1, p-Smad2/3, CTGF and TIMP-1 upregulated (P<0.05) while MMP-2, MMP-9, MMP-2/TIMP-1 and MMP-9/TIMP-1 ratio downregulated(P<0.05) in SHR-Sed group; compared with SHR-Sed group, blood pressure (SBP) and CVF decreased (P<0.05), protein level of TNF-α, IL-6, COX-2, TGF-β1, p-Smad2/3, CTGF, TIMP-1, MMP-2, MMP-9 and MMP-2/TIMP-1 as well as MMP-9/TIMP-1 ratio downregulated (P<0.05), while 24 h urine protein, BUN and SCr showed no significant change in SHR-HIT group. Conclusion:HIT of 8 weeks improved renal fibrosis through alleviation of inflammatory reaction and suppression of collagen anabolism in SHR. However, health effect of long-term HIT on hypertensive nephropathy should be further confirmed due to inhibition of collagen catabolism pathway and no alteration of renal function.
Key words:high intensity interval training; hypertension; renal fibrosis; inflammatory reaction; extracellular matrix
高血压患者持续血压升高引起肾脏结构和功能损害(肾动脉硬化、肾小球滤过率增加、蛋白尿、肾脏炎症、纤维化),最终导致肾功能衰竭,称为高血压肾病[1]。高血压肾病的发生率与高血压的严重程度和持续的时间呈正相关[1]。肾脏纤维化是肾脏重塑的主要外在表现,是高血压患者最常见的并发症之一,其严重程度与患者预后及死亡率密切相关[2]。肾脏纤维化的发生是由于细胞外基质(extracellular matrix,ECM)过度沉积造成的[3]。ECM的主要成分是胶原,由成纤维细胞产生,胶原合成与降解动态平衡对于维持肾脏正常结构与功能具有重要调节作用[4]。实验证实,转化生长因子-β(transforming growth factor-β,TGF-β)-Smad[5]和基质金属蛋白酶(matrix metalloproteinase,MMP)-组织金属蛋白酶抑制物(tissue inhibitors of metalloproteinase,TIMP)[6]分别是调控胶原合成与降解的主要信号途径。TGF-β1是肾脏重塑和纤维化形成过程中的重要始動因子之一,具有刺激成纤维细胞合成胶原纤维的作用,其在高血压大鼠肾小球和肾小管间质细胞中的表达量明显上调[7]。TGF-β1能够使胞浆中的Smad2和Smad3磷酸化,继之转移至细胞核通过上调多种促纤维化因子如结缔组织生长因子(connective tissue growth factor,CTGF)以及编码ECM成分的基因表达,最终导致肾脏纤维化[8]。MMP是一类锌依赖性蛋白水解酶家族,催化ECM蛋白降解,肾脏中主要表达MMP-2和MMP-9,其作用是降解变性胶原及其他ECM蛋白。MMP受TIMP负反馈调节,以防止ECM过度降解[6]。研究证实[5-6],TGF-β-Smad信号活化(诱导胶原合成增加)和/或MMP/TIMP比值下降(造成胶原降解减少)是各种原因导致肾脏纤维化的主要分子生物学机制。
近年来的研究发现[9],炎症反应是肾脏纤维化发生发展的进展的关键因素。针对慢性肾脏疾病动物模型和高血压患者的临床研究均观察到肾脏中多种促炎细胞因子如白介素-6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)等含量显著升高[10-12]。Jaimes等[13]的另一项研究表明,高盐饮食诱导的高血压大鼠肾皮质环氧合酶2(cyclooxygenase-2,COX-2)基因表达量上调。由于COX-2是参与炎症反应的关键酶,而非甾体抗炎药(COX-2抑制剂)即通过抑制COX-2活性而发挥效应[14],进一步证实炎症反应介导了高血压肾损伤的病理过程。高血压肾病患者白细胞及其他细胞因子激活,从而出现慢性炎症反应状态,继之加速慢性肾病和终末期肾病进程[9-10]。实验证明[15],炎症因子如IL-6、TNF-α、COX-2可激活TGF-β-Smad信号通路,进而诱导肾脏纤维化。
运动疗法是高血压患者非药物治疗的主要手段,能够降低血压,减轻并发症,下调多种心血管危险因素,改善生活质量并降低住院率与死亡率[16]。有氧运动是高血压患者康复治疗的主要运动方式,其对肾脏的作用包括增加肾血流量和氧供应、氧化应激、减轻肾脏炎症反应、降低尿蛋白量等,因此同样适用于高血压肾病患者[17]。高强度间歇训练(high intensity interval training,HIT)是近年来新兴的一种运动模式,相对于传统持续有氧运动具有省时有效、趣味性强、易于接受和坚持等突出优势[18-19]。然而对比多项研究后发现[20-24],HIT对于心血管疾病的健康效应(尤其是心脏)尚存争议。课题组前期的研究亦发现,有氧运动能够抑制SHR心肌纤维化[21],但长期高强度运动[22]或HIT[23]却加重心脏重塑。然而HIT对肾脏纤维化的影响及机制尚不清楚。因此,本研究以SHR为研究对象,旨在观察8周HIT对肾脏纤维化的影响并探讨炎症反应和胶原代谢通路(TGF-β-Smad和MMPs-TIMPs信号途径)在其间的作用机制,为制定针对高血压肾病患者的最佳运动康复处方提供依据。我们假设,HIT能够改善SHR肾脏纤维化,其机制与减轻炎症反应、抑制胶原合成代谢并促进胶原分解代谢有关。
1 研究对象与方法
1.1 实验动物与分组
30只12周龄雄性SHR,体重(215±13)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2018-0027。同时以15只Wistar-Kyoto大鼠作为正常血压组(WKY)。大鼠饲养环境:温度24℃~26℃,湿度50%~60%,12 h明暗周期,分笼(5只/笼)标准饲料饲养,自由进食水。动物适应环境1周后利用随机数字表法将30只SHR随机分为安静对照组(SHR sedentary,SHR-Sed,n=15)和HIT组(SHR-HIT,n=15),其中SHR-HIT组进行为期8周HIT,WKY和SHR-Sed组保持安静状态(鼠笼内安静饲养)。
1.2 运动方案
大鼠先进行5 d跑台适应性训练,方案为:速度10~15 m/min,坡度0°,时间30 min/d。随后参照课题组前期建立的方案[21, 23]测定大鼠运动能力:起始负荷5 m/min,坡度0°,每2 min增加1.5 m/min,直至力竭,记录最大跑速(maximal velocity,Vmax)。随后SHR-HIT组进行8周跑台间歇训练,训练负荷(包括训练强度、持续时间、完成组数以及每周频率)逐级递增(见表1)。分别于第2、4和6周重新测定Vmax并及时调整训练强度(跑速)[23]。
1.3 尾动脉血压测定
末次训练后48 h,采用智能无创血压测量仪(BP-2010E,日本)测定尾动脉血压,包括收缩压(systolic blood pressure,SBP)、舒张压(DBP)和平均动脉压(MAP)。测量前将尾部预热15~20 min,待大鼠安静后,重复测量3次,取平均值。
1.4 大鼠取材
所有大鼠过夜禁食,于干净代谢笼内留取24 h 尿液。大鼠称量体重后用20%乌拉坦腹腔麻醉并固定,开胸后右心室采血3~5 mL。分离两侧肾脏,迅速在冷生理盐水中洗涤,滤纸吸干水分后称其质量并计算肾脏质量指数(肾脏质量÷体重)。一侧肾脏用于病理组织学观察,另一侧用锡纸包裹迅速转移至-80℃低温冰箱冻存待测胶原含量以及蛋白表达量。
1.5 肾功能检测
采用尿样分析仪(AX-4280,日本)以双缩脲法检测尿液样本24 h尿蛋白含量,生化分析仪(Bachman AU680,美国)检测血液样本尿素氮(blood urea nitrogen,BUN)及肌酐(serum creatinine,SCr)含量。严格按照试剂盒(武汉博士德生物工程有限公司)说明进行操作,每个样本重复3次取均值。
1.6 肾脏病理组织学观察
将肾组织用中性甲醛溶液固定24 h,脱水后石蜡包埋,利用病理切片机(RM2255,德国)制作4 μm切片。分别行HE和Masson染色,倒置相差显微镜(欧林巴斯IX71,日本)下选取10个视野,对肾脏病理组织学进行观察。用图像分析软件(Image Pro Plus 6.0,美国)测量Masson染色切片中结缔组织面积与所测视野面积的比值作为间质胶原容积分数(collagen volumetric fraction,CVF)。
1.7 肾脏蛋白表达量检测
利用Western Blot法检测蛋白表达量。取适量肾脏组织匀浆后提取总蛋白,用考马斯亮蓝法测定总蛋白浓度。取100 μg蛋白样品在垂直电泳仪上经SDS-PAGE分离,随后转移至PVDF膜上。兔抗鼠一抗(包括TNF-α、IL-6、COX-2、TGF-β1、Smad2/3、CTGF、MMP-2、MMP-9和TIMP-1)4℃静置孵育过夜,二抗(辣根过氧化物酶标记的羊抗兔IgG)37℃孵育2 h。充分洗涤后,ECL发光成像,扫描各条带灰度值。将各组与β-actin的比值作为目的蛋白相对表达量,将各组蛋白相对表达量与WKY组的比值作为相对表达率。
1.8 统计学处理与分析
所有数据用“均数±标准差”表示。各参数组间比较采用单因素方差分析,若F检验具有统计学意义,则多重比较采用LSD检验。显著性水平定为α=005。统计软件为SPSS 20.0 for Windows。
2 结果
2.1 样本量分析
在实验实施过程中,由于死亡、拒跑等原因,共剔除5只大鼠,因此最终样本量n=40,其中WKY组(n=15)、SHR-Sed组(n=14)、SHR-HIT组(n=11)。
2.2 体重、肾脏指数、尾动脉血压和肾功能的变化
与WKY组比较,SHR-Sed组SBP、DBP、MAP、24 h蛋白尿、BUN和SCr升高(P<0.05),与SHR-Sed组比较,SHR-HIT组SBP和MAP下降(P<0.05),肾功能无显著性变化(P>0.05)。
2.3 肾脏病理组织学观察及胶原含量的变化
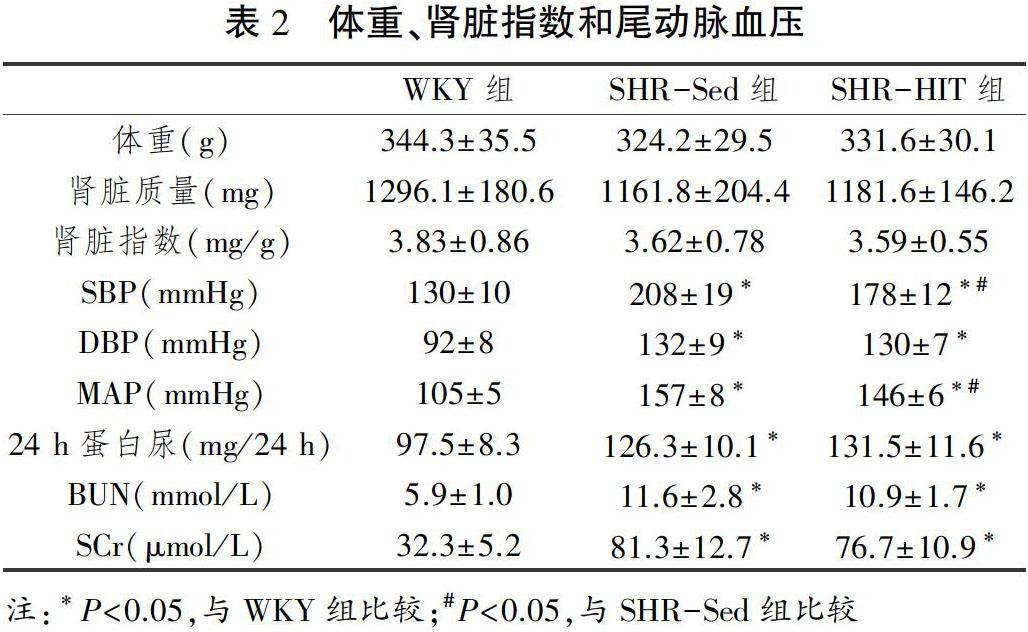
腎脏HE染色见图1所示,WYK组大鼠肾组织结构完整,无明显病理改变;与WKY组相比,SHR-Sed组大鼠肾小管上皮细胞坏死,管腔扩张,间质增厚,伴有炎症细胞浸润;与SHR-Sed组相比,SHR-HIT组大鼠肾小管和肾小球病变减轻,炎症细胞浸润减少。
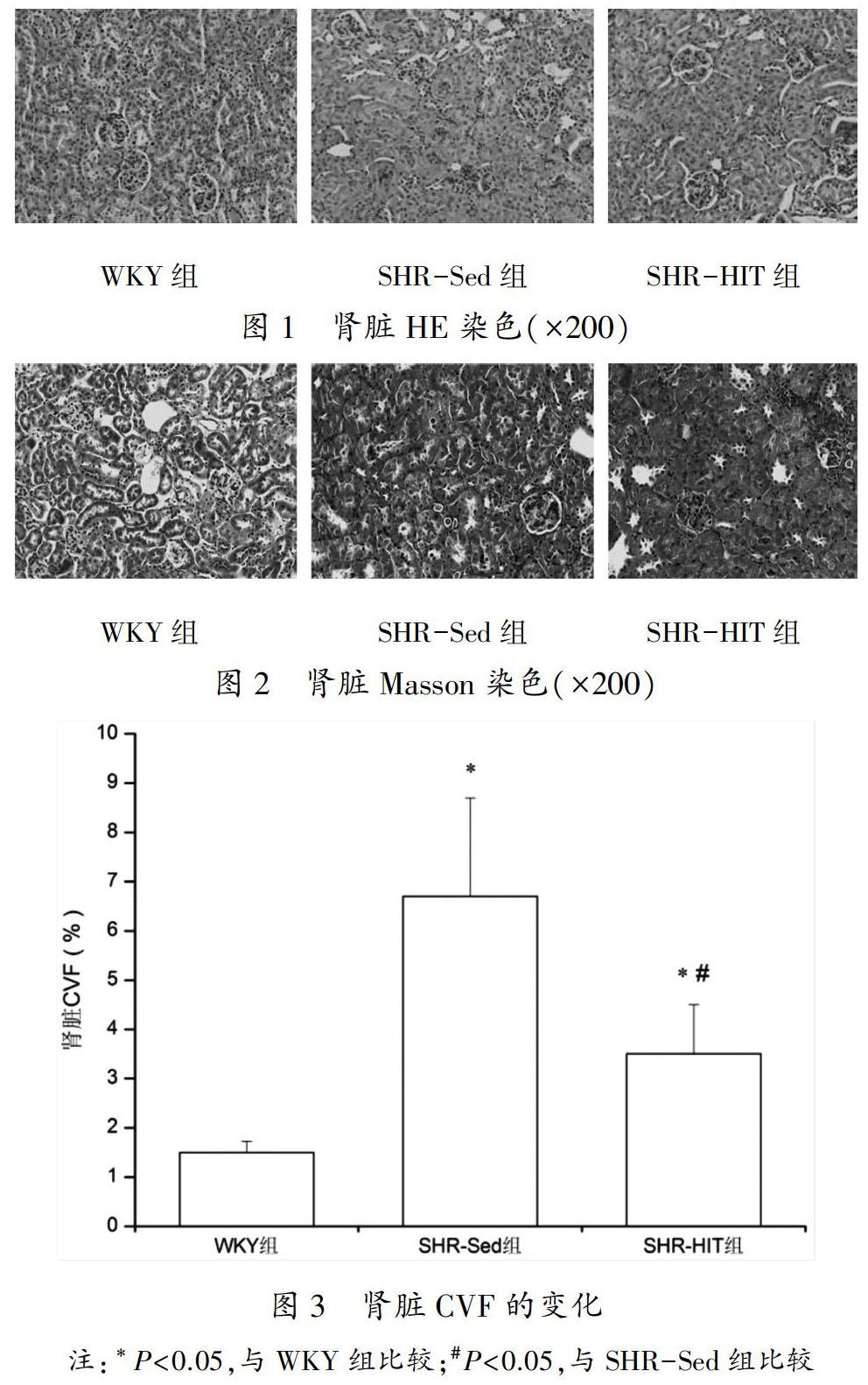
肾脏Masson染色见图1所示,肾脏CVF的变化见图2。WYK组肾脏间质有极少量胶原纤维,SHR-Sed组肾脏间质可见明显纤维化改变及胶原沉积,CVF I含量较WYK组显著性升高(P<0.05);与SHR-Sed组比较,SHR-HIT组纤维化程度减轻、CVF下降(P<0.05)。
2.4 肾脏炎症因子的变化
与WKY组比较,SHR-Sed组TNF-α、IL-6和COX-2蛋白表达量上调(P<0.05),与SHR-Sed组比较,SHR-HIT组上述炎症因子均下调(P<0.05)。见图4~图6。
2.5 肾脏胶原合成代谢信号通路各蛋白表达量的变化
与WKY组比较,SHR-Sed组TGF-β1、p-Smad2/3和CTGF蛋白表达量上调(P<0.05),与SHR-Sed组比较,SHR-HIT组上述蛋白表达量均下调(P<0.05)。见图7~图9。
2.6 肾脏胶原分解代谢信号通路各蛋白表达量的变化
与WKY组比较,SHR-Sed组TIMP-1蛋白表达量上调(P<0.05),MMP-2和MMP-9表达量以及MMP-2/TIMP-1和MMP-9/TIMP-1比值下降(P<005);与SHR-Sed组比较,SHR-HIT组TIMP-1、MMP-2和MMP-9蛋白表达量以及MMP-2/TIMP-1和MMP-9/TIMP-1比值均下降(P<0.05)。见图10~图13。
3 讨论
本研究以SHR为研究对象,旨在观察8周HIT对高血压肾病肾脏纤维化的影响及可能机制,结果发现,SHR-Sed组肾脏炎症反应增强,胶原合成代谢通路增强、分解代谢途径受抑,胶原含量明显增加并出现肾脏纤维化;经过8周HIT后,SHR-HIT组肾脏炎症反应减轻,胶原合成与分解代谢同时受到抑制,胶原含量减少、纤维化改善,但肾功能并无显著性变化。因此,本研究结果部分证实了前述假设。由于8周HIT同时抑制胶原合成与分解代谢且肾功能并无改善,故长期HIT对高血压肾病的健康效应尚待进一步证实。
临床研究发现[1],高血压肾病患者肾脏病理生理学改变主要表现为肾炎、肾小球硬化、肾小管萎缩和肾脏纤维化。大量的成纤维细胞活化以及ECM过量产生和沉积,导致肾实质破坏、肾脏纤维化,最终引起肾功能进行性下降[1]。在本研究中,SHR-Sed组血压、肾脏CVF以及24 h尿蛋白含量、BUN和SCr含量均显著性升高,证实SHR合并肾病,肾间质胶原堆积并发生纤维化。有氧运动对多种原因引起的组织(心脏、肝脏、肾脏等)纤维化均具有改善效应[25]。已证实,规律有氧运动(跑台、游泳等)[26-30]以及抗阻训练[31-32]能够抑制慢性肾病大鼠肾脏纤维化,然而HIT方式的作用鲜有关注。在本研究中,SHR-HIT组血压和肾脏CVF下降,提示不同运动方式均可改善肾脏纤维化,其机制未明。
慢性炎症反应伴随高血压肾病发生发展的整个过程[9]。动物实验与人体研究均证实[9-12, 15],炎症因子表达上调是高血压肾病的关键发病机制。抑制炎症因子表达可减轻各种模型(如输尿管阻塞、缺血-再灌注等)引起的肾脏损伤及纤维化[32-33]。在本研究中,SHR-Sed组TNF-α、IL-6和COX-2表达量较WKY组上调,而经过8周HIT后,SHR-HIT组上述因子表达量均显著性下降,与Huang等[28]以跑台持续有氧运动以及Moraes等[31]和Souza等[32]以抗阻训练为干预手段的研究结果一致,提示不同运动方式均能够减轻高血压引起的肾脏炎症反应。炎症因子不仅造成肾功能紊乱,而且是诱导肌肉萎缩(肌力下降)的重要介质[34],因此HIT诱导炎症因子下降将有利于提高高血压肾病患者运动能力并减轻疲劳、呼吸困难等症状,进而改善生活质量。此外,Souza等[32]证实,运动还能够上调慢性肾病大鼠肾脏抗炎因子(IL-4和IL-10)表达量,维持免疫系统稳态,进而改善慢性炎症反应状态。
肾脏纤维化是肾脏胶原过度沉积造成的,由于胶原含量是其分解代谢与合成代谢相互作用的结果,因此胶原代谢稳态平衡是肾脏纤维化的决定因素[35]。在本研究中,SHR-Sed组TGF-β1、p-Smad2/3和CTGF表达上调,提示介导胶原合成的TGF-β-Smad信号活化,炎症因子上调是这一途径激活的始动因素;另外,由于TIMP-1上调,MMP-2和MMP-9下降,说明介导胶原降解的MMP-TIMP途径受到抑制。因此SHR肾脏纤维化是胶原合成增加以及降解减少造成的。经过8周训练后,SHR-HIT组TGF-β1、p-Smad2/3和CTGF下降,提示胶原合成受抑。此外,本研究还发现,SHR-HIT组TIMP-1蛋白表达量较WYK組下降,似乎暗示TIMP-1对MMP-2和MMP-9的抑制效应减弱。然而Yang等[36]的研究进一步显示,MMP与TIMP之间的动态平衡(用两者的比值表示)才是胶原分解代谢的决定因素。SHR-HIT组MMP-2/TIMP-1和MMP-9/TIMP-1比值均下降,说明TIMP-1对MMP-2和MMP-9的抑制作用增强,MMP-TIMP信号系统稳态平衡进一步破坏,胶原降解减少,这一结果出乎意料,也就是说,HIT诱导肾脏的胶原来源(合成)减少与去路(分解)减少同时存在。由于SHR-HIT组肾脏纤维化改善,故推测HIT对胶原合成代谢抑制的程度必然高于分解代谢,提示肾脏宏观表型与微观分子变化之间并不一致,然而这一调节机制对于改善肾脏纤维化而言是一种不经济的方式,或者是一种潜在的病理状态,肾功能无显著性变化也间接证实了这一点,说明HIT对肾脏结构的良性作用并未转化为肾功能的改善。发生这一改变的机制可能与HIT运动强度较高有关[37]。在Aparicio等[37]的研究中,健康SD大鼠进行为期12周高强度抗阻训练后肾脏形态和功能均发生异常;Bongers等[38]证实,持续高强度甚至力竭运动可通过缺血-再灌注机制造成肾脏损伤。结合本研究结果我们认为,HIT对机体既具有良性效应又存在不利影响,鉴于此,长期HIT可能存在潜在风险。
课题组前期的研究证实,短期(8周)HIT改善SHR心肌肥大和心肌纤维化[21],然而将干预时间延长至18周后(相当于人类运动10年)却发现心脏重塑加重、心力衰竭进展加速[23],提示HIT的心脏效应存在“一过性(暂时性)”特征。值得注意的是,Benito等[39]发现,SD大鼠18周高强度训练诱导心肌纤维化,42%的动物发生心律失常,然而上述改变在停训8周得到逆转,提示高强度运动诱导的心肌纤维化具有可逆性特征。然而长期HIT对高血压肾病的健康效应尚不得而知。结合本研究的结果,我们推测,长期(>8周)HIT可能诱导胶原合成增加和/或进一步抑制胶原分解,进而导致肾脏纤维化加重,若及时停训或将降低运动强度,其纤维化程度将得以缓解,但这一推论尚需实验证实。
4 结论
8周HIT通过减轻炎症反应并抑制胶原合成代谢进而改善SHR肾脏纤维化。然而由于胶原分解代谢通路同样受到抑制且肾功能并无改变,长期HIT对高血压肾病的健康效应尚待进一步证实。
参考文献:
[1]Seccia TM, Caroccia B, Calò LA. Hypertensive nephropathy. Moving from classic to emerging pathogenetic mechanisms[J]. J Hypertens, 2017, 35(2): 205-212.
[2]Sun HJ. Current opinion for hypertension in renal fibrosis[J]. Adv Exp Med Biol, 2019(1165): 37-47.
[3]Nogueira A,Pires MJ,Oliveira PA.Pathophysiological mechanisms of renal fibrosis: a review of animal models and therapeutic strategies[J]. In Vivo, 2017, 31(1): 1-22.
[4]Bonnans C,Chou J,Werb Z.Remodelling the extracellular matrix in development and disease[J]. Nat Rev Mol Cell Biol, 2014, 15(12): 786-801.
[5]Hu HH, Chen DQ, Wang YN,et al. New insights into TGF-β/Smad signaling in tissue fibrosis[J]. Chem Biol Interact, 2018(292): 76-83.
[6]Arpino V, Brock M, Gill SE. The role of TIMPs in regulation of extracellular matrix proteolysis[J]. Matrix Biol, 2015(44/46): 247-254.
[7]Higgins SP,Tang Y,Higgins CE,et al.TGF-β1/p53 signaling in renal fibrogenesis[J]. Cell Signal, 2018(43): 1-10.
[8]Khalil H, Kanisicak O, Prasad V,et al. Fibroblast-specific TGF-β-Smad2/3 signaling underlies cardiac fibrosis[J]. J Clin Invest, 2017, 127(10): 3770-3783.
[9]Lv W, Booz GW, Wang Y,et al. Inflammation and renal fibrosis: Recent developments on key signaling molecules as potential therapeutic targets[J]. Eur J Pharmacol, 2018( 820): 65-76.
[10]Akchurin OM, Kaskel F. Update on inflammation in chronic kidney disease[J]. Blood Purif, 2015, 39(1/3): 84-92.
[11]Yang P, Xiao Y, Luo X,et al. Inflammatory stress promotes the development of obesity-related chronic kidney disease via CD36 in mice[J]. J Lipid Res, 2017, 58(7): 1417-1427.
[12]Cobo G, Lindholm B, Stenvinkel P. Chronic inflammation in end-stage renal disease and dialysis[J]. Nephrol Dial Transplant, 2018, 33(suppl 3): 35-40.
[13]Jaimes EA, Zhou MS, Pearse DD,et al.Upregulation of cortical COX-2 in salt-sensitive hypertension: role of angiotensin II and reactive oxygen species[J]. Am J Physiol Renal Physiol, 2008, 294(2): F385-392.
[14]Nderitu P, Doos L, Jones PW,et al. Non-steroidal anti-inflammatory drugs and chronic kidney disease progression: a systematic review[J]. Fam Pract, 2013, 30(3): 247-255.
[15]Liu M, Ning X, Li R, et al. Signalling pathways involved in hypoxia-induced renal fibrosis[J]. J Cell Mol Med, 2017, 21(7): 1248-1259.
[16]Boutcher YN,Boutcher SH.Exercise intensity and hypertension:what's new[J]. J Hum Hypertens, 2017, 31(3): 157-164.
[17]Wilkinson TJ, Shur NF, Smith AC. "Exercise as medicine" in chronic kidney disease[J]. Scand J Med Sci Sports, 2016, 26(8): 985-988.
[18]Wewege M, van den Berg R, Ward RE,et al.The effects of high-intensity interval training vs. moderate-intensity continuous training on body composition in overweight and obese adults: a systematic review and meta-analysis[J]. Obes Rev, 2017, 18(6): 635-646.
[19]MacInnis MJ, Gibala MJ. Physiological adaptations to interval training and the role of exercise intensity[J]. J Physiol, 2017, 595(9): 2915-2930.
[20]Holloway TM, Bloemberg D, da SML,et al. High intensity interval and endurance training have opposing effects on markers of heart failure and cardiac remodeling in hypertensive rats[J]. PLoS One, 2015, 10(3): e0121138.
[21]范朋琦, 秦永生, 彭朋. 不同運动方式对自发性高血压大鼠心脏重塑和运动能力的影响[J]. 现代预防医学, 2018, 45(23): 4341-4345.
[22]黄凯, 彭朋, 李晓霞. 长期自主跑轮运动对心肌梗死大鼠心肌重塑的影响[J]. 武警后勤学院学报:医学版, 2015, 24(5): 337-341.
[23]孟宪欣, 管泽毅, 葛吉生, 等. 间歇运动干预自发性高血压大鼠病理性心脏肥大:运动强度与健康效应的关系[J]. 体育科学, 2019, 39(6): 73-82.
[24]Holloway TM, Bloemberg D, da SML,et al. High-intensity interval and endurance training are associated with divergent skeletal muscle adaptations in a rodent model of hypertension[J]. Am J Physiol Regul Integr Comp Physiol, 2015, 308(11): R927-934.
[25]Sallis RE. Exercise in the treatment of chronic disease: an underfilled prescription[J]. Curr Sports Med Rep, 2017, 16(4): 225-226.
[26]Peng CC, Chen KC, Hsieh CL,et al. Swimming exercise prevents fibrogenesis in chronic kidney disease by inhibiting the myofibroblast transdifferentiation[J]. PLoS One, 2012, 7(6): e37388.
[27]Tang LX, Wang B, Wu ZK. Aerobic exercise training alleviates renal injury by interfering with mitochondrial function in type-1 diabetic mice[J]. Med Sci Monit, 2018( 24): 9081-9089.
[28]Huang C, Lin YY, Yang AL,et al. Anti-renal fibrotic effect of exercise training in hypertension[J]. Int J Mol Sci, 2018, 19(2).
[29]Agarwal D, Elks CM, Reed SD,et al. Chronic exercise preserves renal structure and hemodynamics in spontaneously hypertensive rats[J]. Antioxid Redox Signal, 2012, 16(2): 139-152.
[30]Bao C, Yang Z, Cai Q,et al. Incremental load training improves renal fibrosis by regulating the TGF-β1/TAK1/MKK3/p38MAPK signaling pathway and inducing the activation of autophagy in aged mice[J]. Int J Mol Med, 2019, 44(5): 1677-1686.
[31]Moraes MR, Rosa TS, Souza MK,et al. Resistance training downregulates macrophages infiltration in the kidney of 5/6 nephrectomized rats[J]. Life Sci, 2018(213): 190-197.
[32]Souza MK,RVP N,Rosa TS,et al.Resistance training attenuates inflammation and the progression of renal fibrosis in chronic renal disease[J]. Life Sci, 2018(206): 93-97.
[33]Chen W, Yuan H, Cao W,et al. Blocking interleukin-6 trans-signaling protects against renal fibrosis by suppressing STAT3 activation[J]. Theranostics, 2019, 9(14): 3980-3991.
[34]Londhe P, Guttridge DC. Inflammation induced loss of skeletal muscle[J]. Bone, 2015(80): 131-142.
[35]Magnusson SP,Heinemeier KM,Kjaer M.Collagen homeostasis and metabolism[J]. Adv Exp Med Biol, 2016(920): 11-25.
[36]Yang DC,Ma ST,Tan Y,et al.Imbalance of matrix metalloproteinases/tissue inhibitor of metalloproteinase-1 and loss of fibronectin expression in patients with congestive heart failure[J]. Cardiology, 2010, 116(2): 133-141.
[37]Aparicio VA, Tassi M, Nebot E,et al. High-intensity exercise may compromise renal morphology in rats[J]. Int J Sports Med, 2014, 35(8): 639-644.
[38]Bongers C, Alsady M, Nijenhuis T,et al. Impact of acute versus prolonged exercise and dehydration on kidney function and injury[J]. Physiol Rep, 2018, 6(11): e13734.
[39]Benito B, Gay-Jordi G, Serrano-Mollar A,et al. Cardiac arrhythmogenic remodeling in a rat model of long-term intensive exercise training[J]. Circulation, 2011, 123(1): 13-22.
