禽腺病毒-I群、新城疫病毒和传染性支气管炎病毒多重PCR检测方法的建立
2020-01-07江之瑶王欣慧王守春栾庆东王建琳尹燕博
江之瑶,王欣慧,王守春,栾庆东,王建琳,尹燕博
(青岛农业大学动物医学院,山东 青岛 266109)
禽腺病毒-I群(Fowl adenovirus,FAV-I),属于腺病毒科,包括12个血清型(血清1-8a, 8b-11),FAV-Ⅰ可引起鸡包涵体肝炎、心包积液综合征、再生障碍性贫血等症状[1]。临床FAV-I感染的调查结果表明,我国主要流行血清4型、8a型、8b型和11型[2],其中血清4型FAV-I自2014年以来,给我国肉鸡给养殖业造成了巨大损失[3]。
自2007年以来,青岛农业大学预防兽医学实验室对我国部分地区临床FAV-I感染流行病学研究结果显示,2007年到2014年6月,我国主要流行血清11型FAV-I,该血清型病毒主要引起鸡包涵体肝炎;2014年7月到2016年,我国主要流行血清4型FAV-I,该血清型病毒主要引起鸡心包积液综合征;自2017年以来,主要流行血清8b型FAV-I,该血清型病毒主要引起鸡包涵体肝炎[2,4]。调查结果显示,临床FAV-I往往与其他病原混合感染,常见的有新城疫病毒(NDV)、传染性支气管炎病毒(IBV)、鸡传染性贫血病毒(CIAV)、H9亚型禽流感病毒(AIV-H9)和大肠杆菌[4],鉴于临床以上病原的混合感染,本研究拟建立针对FAV-I、NDV和IBV的多重PCR检测方法,可用于快速检测并区分这 3 种病毒。
1 材料与方法
1.1 毒株 试验所用AIV-H9(C/SD/196/11株)、NDV (LaSota株)、IBV(M41株)、FAV-I(FAV-4)、CIAV、Ⅲ群禽腺病毒(EDSV)、马立克病毒(MDV)为本实验室鉴定保存毒株。
1.2 主要试剂 RNAiso Plus,购自TaKaRa公司;M-MLV反转录酶、5×Buffer 、RNA酶抑制剂、2×Mix、随机引物等,均购自宝生物工程(大连)有限公司。
1.3 方法
1.3.1 引物设计与合成 根据GenBank中登陆的FAV-I的Hexon基因、NDV的F基因和IBV 的N基因分别设计了3对特异性引物(表1),由北京擎科新业生物技术有限公司合成。
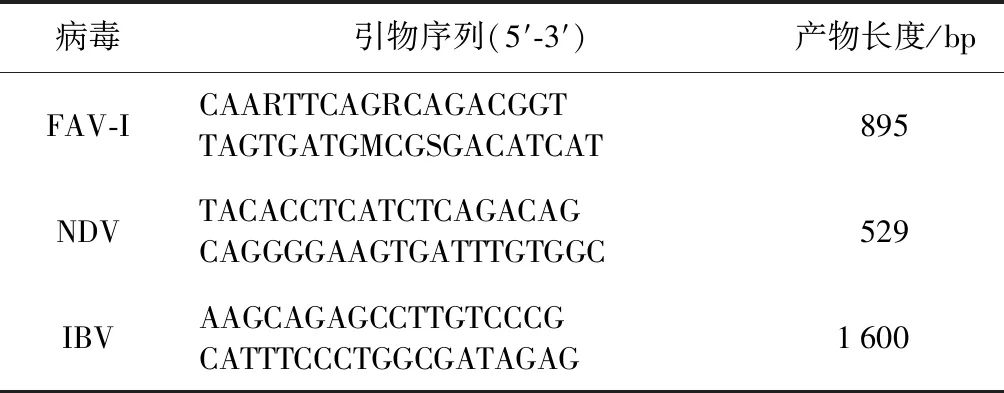
表1 FAV-I、NDV和IBV检测用引物序列
1.3.2 病毒核酸的提取与反转录 取1.5 mL离心管,加入700 μL RNAiso Plus后加入200 μL组织研磨液,吹打混匀,-20 ℃静止10 min,加入140 μL氯仿,涡旋混匀,室温静置3 min。12 000 r/min离心15 min。取上清液550 μL,与500 μL异丙醇混匀,-20 ℃静置10 min,12 000 r/min离心15 min,弃上清液。加入1 000 μL 75%冰乙醇,7 500 r/min离心5 min,弃上清液,反复2次。将离心管口敞开,在室温中干燥。干燥彻底后加入20 μL反转录体系(RNasefree H2O 11 μL、 5×Buffer 4 μL、 dNTPs 2 μL、 M-MLV 1 μL 、Inhibitor 0.5 μL、 随机引物 1.5 μL),轻弹离心管底部,使核酸充分溶解。42 ℃水浴1 h后,反转录为cDNA,-70 ℃保存。
1.3.3 反应条件优化 取FAV-I、NDV 和IBV 的cDNA,单项扩增后将PCR产物测序后构建质粒。在单项PCR反应条件基础上,建立多重PCR方法,并对其反应条件(退火温度、引物浓度)进行优化,确定最佳反应条件。
1.3.4 特异性和敏感性试验 应用优化后的多重PCR分别对EDSV、 MDV、 CIAV和 AIV-H9进行特异性检验。
将用FAV-I、NDV 和IBV扩增产物构建的质粒导入感受态细胞中并培养扩繁,提取质粒后测定其浓度并计算拷贝数。将提取出的质粒10倍比稀释作为模板,进行敏感性试验。
1.3.5 临床病料检测 取送检的疑似FAV-I感染病死鸡的肝脏、肾脏等脏器,加入5倍量生理盐水后匀浆。反复冻融3次后离心取上清液,提取核酸。用单项PCR和本试验建立的多重PCR进行检验。
2 结果
2.1 单项PCR建立 反应体系:2×Master Mix 12.5 μL、ddH2O 8.5 μL、上下游引物各1 μL、模板2 μL;扩增程序:95 ℃ 5 min、94 ℃ 30 s、55 ℃(IBV 57 ℃、NDV 56 ℃)40 s、72 ℃ 1 min 20 s、35个循环,72 ℃ 10 min。FAV、IBV和NDV 均能扩增出预计条带,大小分别为894 bp、529 bp和1 600 bp(见图1),扩增产物经测序,且结果正确。
2.2 多重PCR建立
2.2.1 退火温度确定 扩增程序:95 ℃ 5 min,94 ℃ 30 s,退火温度40 s,72 ℃ 1 min 20 s,35个循环,72 ℃ 10 min。退火温度设置为47~57 ℃(见图2)。试验确认,退火温度为55 ℃时,扩增效果最好且没有干扰。

图1 FAV、NDV和IBV单项PCR扩增结果
M: DNA Marker DL-2 000 ; 1: NDV ; 2: FAV-I ; 3: IBV
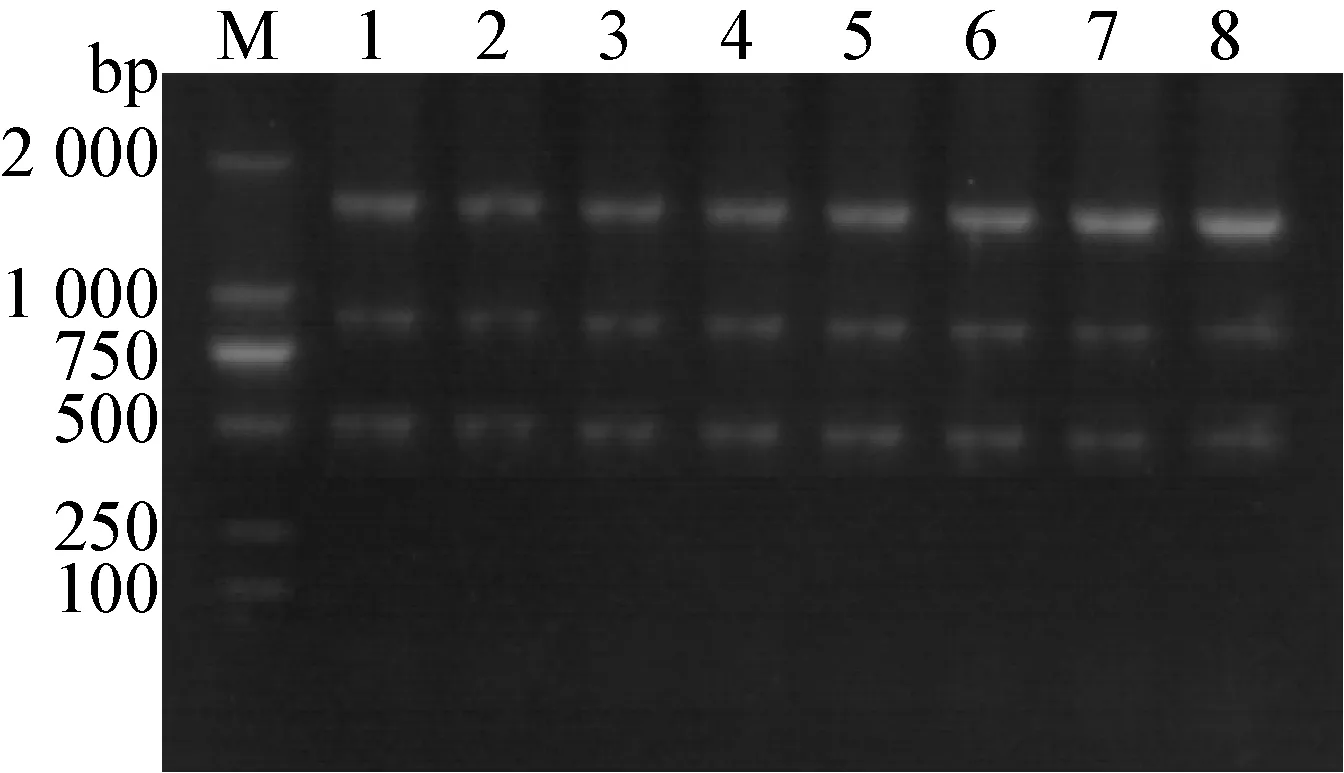
图2 FAV-I、NDV和IBV多重PCR退火温度的优化
M: DNA Marker DL-2 000 ; 1: 47 ℃ ; 2: 48.2 ℃ ; 3: 49.5 ℃ ; 4: 50.7 ℃ ; 5: 52.5 ℃ ; 6: 54.1 ℃ ; 7: 55.7 ℃ ; 8: 57 ℃
2.2.2 引物浓度确定 经过对FAV-I、NDV、IBV单项及多重PCR引物浓度、退火温度等条件的优化,最终确认多重PCR反应体系:2×Master Mix 12.5 μL、模板 2 μL、上游引物1 μL、下游引物1 μL;扩增程序:95 ℃预变性5 min、94 ℃变性30 s、55 ℃退火40 s、72 ℃延伸1 min 20 s、共计35个循环,72 ℃终延伸10 min。FAV-I、NDV和IBV的引物浓度分别为3 pmol/μL、3 pmol/μL和6 pmol/μL。
2.3 特异性检测 提取实验室保存的毒株FAV-I、NDV、IBV、EDSV、MDV、CIAV和AIV-H9的核酸,后经反转录,按照已确认的多重PCR条件进行扩增。其中FAV-I、NDV、IBV均可扩增出与预期一致的条带,而EDSV、MDV、CIAV和AIV-H9均无特异性条带(见图3)。

图3 FAV-I、NDV和IBV多重PCR特异性试验
M: DNA Marker DL-2 000 ; 1: FAV-I+NDV+IBV ; 2: EDSV ; 3: MDV ; 4: CIAV ; 5: AIV-H9
2.4 敏感性检测 将已扩增出的FAV-I、NDV、IBV目的条带切胶回收,连接pMD19-T质粒后导入感受态细胞中。经37 ℃摇菌扩繁8 h,用质粒提取试剂盒提取质粒。测定质粒浓度为FAV-I 165.3 ng/μL、NDV 93 ng/μL、IBV 293.2 ng/μL经换算得出拷贝数为FAV-I 4.27×1010拷贝/μL、NDV 2.68×1010拷贝/μL、IBV 6.33×1010拷贝/μL。将质粒10倍比梯度稀释后作为模板,经多重PCR检测得出该方法中FAV-I、NDV和IBV的最低检测限分别为: 1.46×105拷贝/μL、8.93×102拷贝/μL和2.11×104拷贝/μL(见图4)。

图4 FAV-I、NDV和IBV多重PCR敏感性试验
M: DNA Marker DL-2 000 ; 1:100倍稀释 ; 2: 101倍稀释 ; 3: 103倍稀释 ; 4: 104倍稀释 ; 5: 105倍稀释 ; 6: 106倍稀释 ; 7: 107倍稀释 ; 8: 108倍稀释
2.5 临床病料检测 从各地收集到有明显病变的病料17份,提取核酸后反转录分别多重PCR和单项PCR分别检测。多重PCR检测结果为:阴性2份、IBV 2份、FAV-I 7份、NDV 3份、FAV-I+IBV 3份,与单项PCR结果相同(见图5)。
图5 FAV-I、NDV和IBV多重PCR对临床样品的检测结果
M: DNA Marker DL-2 000 ; 1-17: 临床样品
3 讨论
建立多重PCR方法的关键是引物的选择,在设计引物时要同时考虑各引物之间、引物与模板之间的关系;既要保证扩增的效率;又要尽可能的降低引物二聚体和非特异性扩增,还要考虑扩增条带之间可以明显区分和退火温度的一致[5]。在本研究中,3对引物均设计在模板的保守区,有良好的特异性且互相之间没有干扰;且3对引物的扩增片段为大小分别为894 bp、529 bp和 1600 bp,每对的扩增片段长度差均大于100 bp,具有明显的区分度,可使扩增产物在凝胶成像时有良好的区分度。在退火温度的选择上,本研究在退火温度梯度PCR中显示54~57 ℃扩增过程无干扰且扩增效果良好,根据研究报道[6]及实验室的习惯,本研究的退火温度选用比较通用的55 ℃。
FAV-I所包括的12 个血清型毒株中,其Hexon基因作为分型的重要研究对象,虽然毒株序列存在着一定的差异,但也具有有很高的保守性[7],根据其Hexon基因的保守区设计引物,可全部扩增12个血清型,且通过扩增产物测序来区分不同的血清型[2,4]。我国自2014年开始大规模暴发FAV-I,其中在我国的流行血清型为血清4、8a、8b、11型,且这几种血清型虽然部分毒株之间具有一定的交叉反应性[2],但毒株之间不能完全的交叉保护[8],表明我国FAV-I流行具有多种血清型,且可能存在多种血清型同时感染的可能;鉴于血清4型FAV-I感染造成肉鸡大量死亡,故本研究通过Hexon基因的保守区设计引物以扩增FAV-I的全部血清型毒株,以血清4型FAV-I为代表进行了FAV-I的检测研究。
IBV的基因组为不分阶段的单股正链RNA,NDV的基因组为不分阶段的单股负链RNA,而FAV-I的基因组为线状双链DNA。在核酸提取过程中,本研究将所有病毒都视为RNA病毒提取核酸并进行了反转录,试验表明,FAV-I的DNA在经过反转录后依然可以有效扩增。FAV-I的基因组为线状双链DNA,有良好的稳定性,在42 ℃时,不会被破坏、降解,均能被检测到。
本研究建立的多重PCR能且只能准确的扩增出FAV-I、NDV、IBV的特异条带,表明多重PCR方法有对FAV-I、NDV、IBV有良好的特异性。本多重PCR方法能检测出FAV-I 1.46×105拷贝/μL、NDV 8.93×102拷贝/μL、IBV2.11×104拷贝/μL,表明本方法有良好的敏感性,但3种病毒的检测限各不相同,是因为各引物的结合能力有差异且最佳退火温度有细微差别。在临床样品检测结果表明,本方法与单项PCR检测结果一致,能够满足临床样品检测的要求。
本研究建立的FAV-I、NDV、IBV多重PCR方法可同时检测出这3种病毒,且能进行鉴别,该方法具有较高的特异性、敏感性和稳定性,可为临床该3种病毒的检测提供重要的依据。
