骨髓间充质干细胞及其分泌因子对治疗犬股骨头缺血性坏死的效果观察
2020-01-07张媛媛黄绍义汪迪飞李素华汪登如郑小波
汪 逸,张媛媛,黄绍义,汪迪飞,李素华,汪登如,郑小波
(1.华中农业大学动物科学技术学院动物医学院,湖北 武汉 430070;2.西南大学动物科技学院,重庆 荣昌 4024602;3.云南研灵生物科技有限公司,云南 昆明 650201;4.西南林业大学生命科学院,云南 昆明 650224)
1 材料
1.1 试验犬只 26只健康杂种犬,雌雄不限,年龄在8~12月龄,体重6~8 kg,术前经DR检查,双侧股骨头均正常。
1.2 试验试剂 犬骨髓间充质干细胞(BMSCs)、犬骨髓间充质干细胞分泌因子(BMSCs-cm,云南研灵生物科技有限公司)、舒泰、H.E.染色试剂等。
1.3 试验仪器 动物手术器械、高压灭菌锅、DR摄片机、显微镜等。
2 方法
2.1 动物分组 26只试验犬随机分成4组,A组为单纯造模组(8只),B组为髓芯减压治疗组(6只);C组为骨髓间充质干细胞分泌因子治疗组(6只);D组为骨髓间充质干细胞移植治疗组(6只)。
2.2 犬股骨头缺血性坏死模型的建立 按无菌操作原则进行手术,依次显露股骨头,不切断圆韧带,髋关节不脱位,用棉签蘸取液氮,连续冷冻股骨头15次,持续3 min,再用37 ℃温生理盐水复温3 min,如此循环2次,造成局部冷热交替损伤。最后用生理盐水冲洗术区,逐层缝合切口,碘伏涂抹皮肤切口两侧。
2.3 骨髓间充质干细胞及其分泌因子移植 B、C、D 组的股骨头第2次复温后,不关闭切口,均从股骨颈向股骨头钻入导针至软骨下骨,确认方向深度后,用骨科电钻将直径4.0 mm的导针钻到软骨下2.0~3.0 mm处,将孔内残留的组织清除干净。B组(髓芯减压治疗组),一共植入3 mL生理盐水,钻孔后,孔内植入明胶海绵,注入0.1 mL生理盐水,随即逐层关闭切口,再把2.9 mL的生理盐水向关节腔里分点注射,最后缝合皮肤,碘伏涂抹皮肤切口两侧;C组(骨髓间充质干细胞分泌因子治疗组),一共植入3 mL的BMSCs-CM,钻孔后,孔内植入明胶海绵,先注入0.1 mL的BMSCs-CM,随即逐层闭合切口,再把2.9 mL的BMSCs-CM向关节腔里分点注射,最后缝合皮肤,碘伏涂抹皮肤切口两侧;D组(骨髓间充质干细胞移植治疗组),一共植入1 mL的BMSCs,钻孔后,孔内植入明胶海绵,先注入0.1 mL的BMSCs,随即逐层闭合切口,再把0.9 mL的BMSCs向关节腔里分点注射,最后缝合皮肤,碘伏消毒。
2.4 术后护理 术后为了预防感染,给试验犬佩戴伊丽莎白圈,防止舔咬,肌肉注射氨苄西林钠0.5 g/只,用碘伏对切口进行消毒,持续7 d。
2.5 检测内容和方法
2.5.1 一般情况观察 观察试验动物的精神状态、进食、切口愈合情况、活动量及有无跛行等情况。
2.5.2 DR影像学检查 A组于术后3、7、21、42、63 d;B、C、D三组分别于术后21、42、63 d进行DR髋关节正位检查,试验动物仰卧于摄片床,四肢外展并用绳子固定于摄片床沿,随后进行DR拍摄。观察股骨头DR影像变化,对DR影像进行定性评价,包括股骨头外形、骨密度、是否出现塌陷。
2.5.3 股骨头病理组织学观察 股骨头标本经过固定,脱钙,冲洗,脱水,透明,石蜡包埋,切片等处理,最后进行染色封片,H.E.染色。观察股骨头软骨细胞、骨细胞、脂肪细胞、骨髓组织的变化情况;骨小梁形态结构、排列的变化及有无断裂等情况;空骨陷窝的数量变化情况,缺损区内的变化情况。空骨陷窝计数测定:400倍视野下,每一标本H.E.染色切片中,共计数200个骨陷窝,测定空骨陷窝所占百分比,空骨陷窝率=空骨陷窝数/总骨陷窝数。
3 结果与分析
3.1 一般情况观察 所有的试验动物生理状态均正常,术后7 d拆除缝合线,伤口愈合良好。造模组(A组),术后2 d内,造模侧均回缩呈悬挂状态,不敢下地行走,偶有点地行走,之后一直跛行;术后7 d左右,大多数动物的运动量、步态基本恢复正常,跛行不明显。髓芯减压治疗组(B组),运动情况跟A组动物表现基本相同。骨髓间充质干细胞分泌因子治疗组(C组),动物在术后1 d,术肢不能着地,术后2 d开始点地行走,但运动量也不大,之后一直处于跛行状态;术后5 d左右,运动量、步态基本恢复正常。骨髓间充质干细胞移植治疗组(D组),动物在术后1 d,术肢可以点地行走,运动量不大,但是比起A、B组动物,运动情况要好;于术后4 d左右,运动量、步态基本恢复正常。
3.2 DR影像学检查 A 组在术后的3 d、7 d,分别进行髋关节正位DR检查,试验侧(箭头所指)股骨头外形近似圆形、密度均匀,无异常改变(图1、图2)。
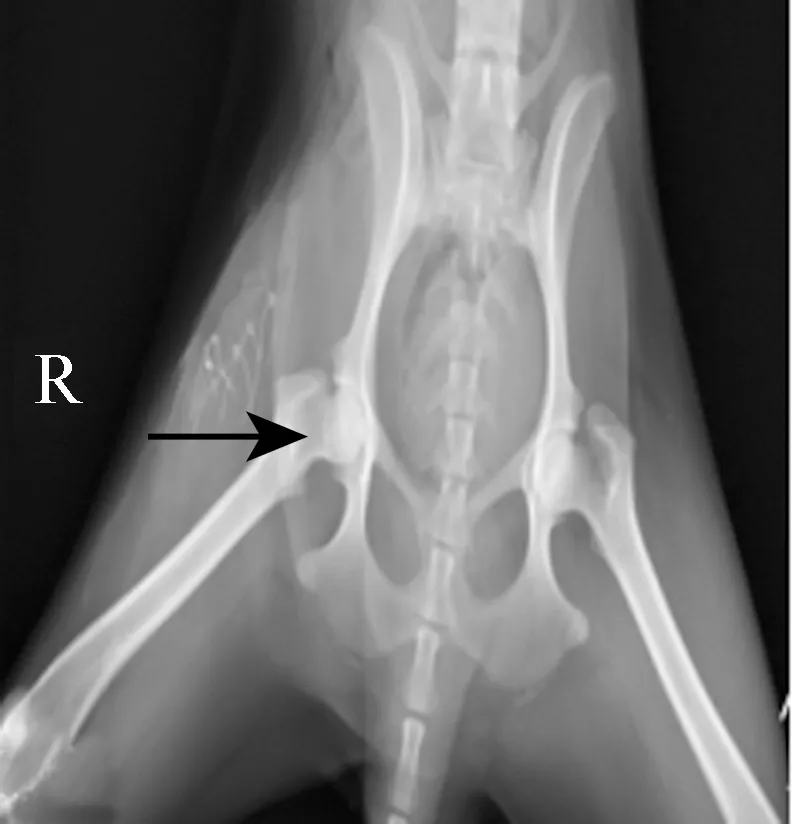
图1 A组股骨头DR影像 (术后3 d)
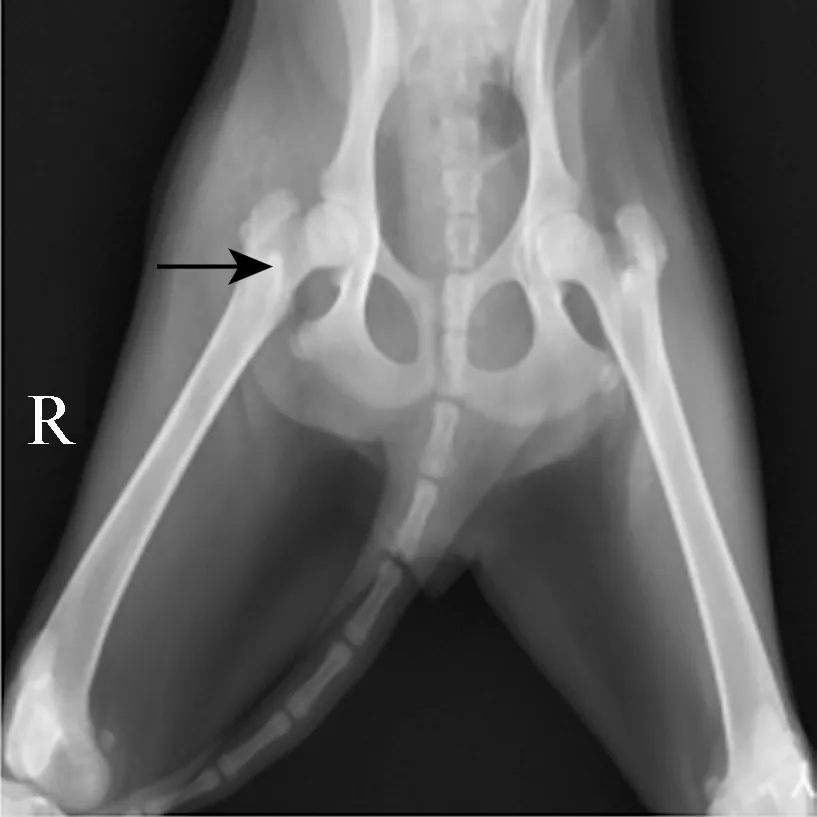
图2 A组股骨头DR影像 (术后7 d)
在术后21 d,A、B、C、D四组分别进行髋关节正位DR检查,试验侧(箭头所指)股骨头外形正常,钻孔区域外密度与正常侧无明显异常,B、C、D三组钻孔区域内密度均明显降低(图3)。

图3 各组股骨头DR影像 (术后21 d)
a: A组;b: B组;c: C组;d: D组
在术后42 d,A、B、C、D四组分别进行髋关节正位DR检查,试验侧(箭头所指)股骨头外形正常,钻孔区域外密度均有所升高,B、C、D三组钻孔区域内密度均在逐渐升高,其中D组可见缺损面积有所减少(图4)。
在术后63 d,A、B、C、D四组分别进行髋关节正位DR检查,试验侧(箭头所指)股骨头外形正常;A组股骨头密度明显增高,密度不均匀;B组钻孔区域外,密度明显增高,钻孔区域内边缘密度增高,中心密度还是较低,缺损面积基本没有改变;C、D两组钻孔区域外,密度均明显增高,C组钻孔区域内密度明显增高,缺损面积减少,D组钻孔区域内密度明显高,缺损面积明显减少,只存在少量的缺损区域(图5)。
3.3 病理组织学观察 A组术后7d,冷冻处软骨细胞出现坏死,核固缩或核溶解;此时骨小梁的形态、排列正常,但是有较多空骨陷窝(见中插彩版图6)。
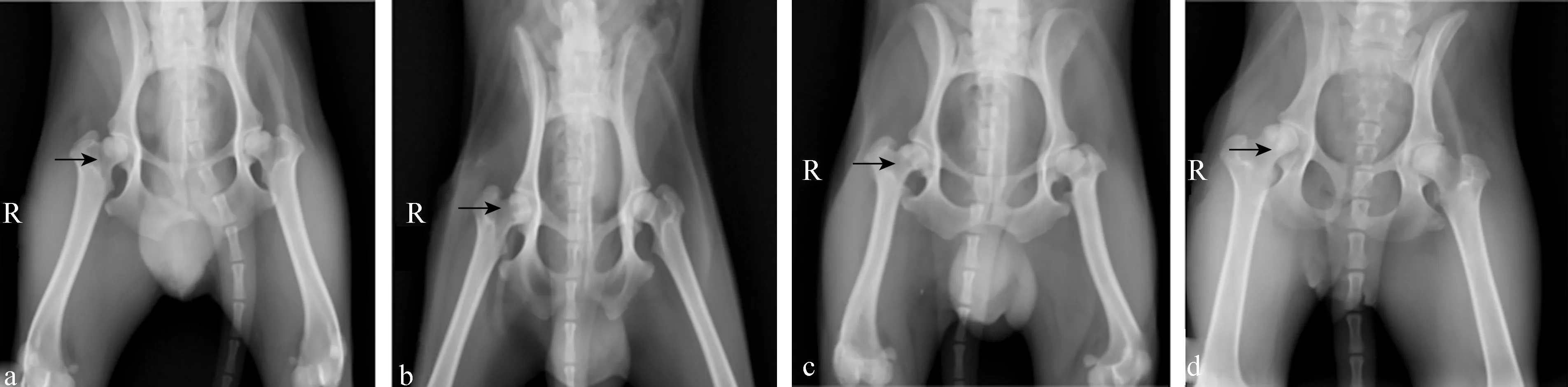
图4 各组股骨头DR影响 (术后42 d)
a: A组;b: B组;c: C组;d: D组
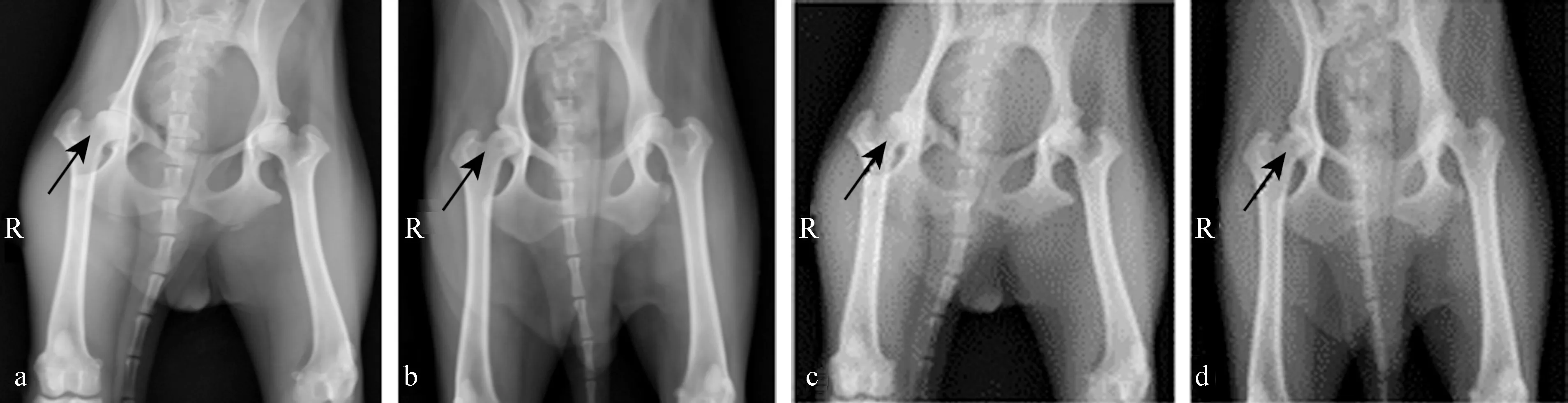
图5 各组股骨头DR影响 (术后63 d)
a: A组;b: B组;c: C组;d: D组
A组术后21 d,骨小梁有较多空骨陷窝出现,骨小梁变细,部分发生断裂,排列无规则,骨小梁周围出现纤维组织,髓腔内有充血、出血,脂肪细胞增大,有部分融合现象(见中插彩版图7)。
B组术后21 d,在钻孔区域外的病理变化大致跟A组相似。在钻孔区域内,边缘出现较多成骨细胞,并且已有类骨质和少量幼稚骨小梁出现,钻孔区域中间有少量的成骨细胞(见中插彩版图7)。
C组术后21 d,在钻孔区域外,骨小梁的坏死程度轻于A、B两组,修复反应明显强于A、B两组,虽然骨小梁空骨陷窝有所增多,骨小梁变细,但是没有断裂现象,排列较规则,可见较多的骨小梁被增生的纤维组织包绕着,髓腔内脂肪细胞增多;钻孔区域内,有较多幼稚的骨小梁和类骨质生成,还有大量的成骨细胞,开始有骨髓组织形成(见中插彩版图7)。
D组术后21d,在钻孔区域外病理变化与C组相似,在钻孔区域内形成的幼稚骨小梁较C组更粗大、排列更紧密,出现了较多的骨髓组织(见中插彩版图7)。
A组术后42 d,骨小梁空骨陷窝增多,发生断裂,排列紊乱,骨小梁周围出现纤维组织爬行替代,有少量新生类骨质形成,髓腔周围出现死骨碎片,脂肪细胞增大、弥散(见中插彩版图8)。
B组术后42 d,在钻孔区域外,骨小梁空骨陷窝增多,骨小梁断裂现象不严重,排列紊乱,骨小梁周围出现纤维化骨匍行附着,有较多新生类骨质形成,髓腔周围出现少量死骨碎片,脂肪细胞增大、弥散;在钻孔区域内,边缘幼稚骨小梁增多,开始出现骨髓组织(见中插彩版图8)。
C组术后42 d,在钻孔区域外,骨小梁空骨陷窝比21 d有所减少,骨小梁周边有少量新生骨形成,脂肪细胞减少;在钻孔区域内,边缘有大量骨小梁趋于成熟,中央区域有较多新生骨小梁,有较多骨髓组织出现(见中插彩版图8)。
D组术后42 d,在钻孔区域外,骨小梁空骨陷窝比21 d有所减少,骨小梁周边有较多新生骨形成,骨小梁增粗,脂肪细胞减少;在钻孔区域内,有大量骨小梁趋于成熟,骨髓组织丰富(见中插彩版图8)。
A组术后63 d,骨小梁内有大量空骨陷窝,稀疏变细,碎裂严重,髓腔周围较多骨碎片,可见新骨沉积性生长(见中插彩版图9)。
B组术后63 d,在钻孔区域外,骨小梁空骨陷窝减少,周围有部分新骨形成;在钻孔区域内,出现较多未成熟的骨小梁,边缘区骨小梁趋于成熟,有较多骨髓组织出现(见中插彩版图9)。
C组术后63 d,在钻孔区域外,骨小梁空骨陷窝明显减少,周围有较多新骨形成,骨小梁增粗,脂肪细胞减少;在钻孔区域内,里面已填充着大量的成熟骨小梁和骨髓组织及少量新生骨小梁(见中插彩版图9)。
D组术后63 d,在钻孔区域外,骨小梁空骨陷窝明显减少,周围有较多新骨形成,骨小梁明显增粗,脂肪细胞减少;在钻孔区域内,骨小梁较宽,排列紧密,可见骨小梁成熟和髓腔形成(见中插彩版图9)。
术后63 d,A组:软骨层内,软骨细胞坏死严重,软骨面剥脱;B组:软骨层内,软骨细胞坏死严重,软骨面未出现剥脱;C组:软骨层内,部分软骨细胞出现核固缩现象,软骨面未出现剥脱;D组:软骨层内,软骨细胞,核较大,位于中央,趋于正常(见中插彩版图10)。
3.4 空骨陷窝率计算结果 术后21、42、63 d,A模型组逐渐升高,B治疗组先升高后下降,C、D两治疗组均逐渐下降。在术后21 d,模型组与3组治疗组比较,空骨陷窝率均差异不显著(P>0.05);在术后42 d,A模型组与B治疗组比较差异不显著(P>0.05),与C治疗组比较差异显著(P<0.05),与D治疗组比较差异极显著(P<0.01);在术后63 d,A模型组空骨陷窝率最高,与B治疗组比较差异显著(P<0.05),与C、D两治疗组比较均差异极显著(P<0.01)。B、C、D三组治疗组进行比较,在术后21 d,空骨陷窝率均差异不显著(P>0.05);在术后42 d,B、C两组比较差异不显著(P>0.05),B、D两组比较差异显著(P<0.05),C、D两组比较差异不显著(P>0.05);在术后63 d,B、C两组比较差异显著(P<0.05),B、D两组比较差异显著(P<0.05),C、D两组比较差异不显著(P>0.05)(表1)。
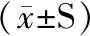
表1 术后各组空骨陷窝率比较
注:与A组比较,*:P<0.05,**:P<0.01; 与B组比较,#:P<0.05
4 分析与讨论
4.1 犬股骨头缺血性坏死模型的建立 股骨头缺血性坏死(Avascular necrosis of the femoral head,ANFH)是一种常见的骨科疾病,又称为股骨头坏死或股骨头无菌性坏死,主要是由于各种病因破坏了股骨头的血供,造成股骨头部分甚至完全缺血,从而引起骨的活性成分(骨细胞、骨髓造血细胞及脂肪细胞)死亡[1]液氮造模属于非创伤方式,常用液氮冷冻股骨头后再复温,液氮冷冻股骨头作用快,可直接损伤骨细胞,引起血管痉挛,诱发髓腔出血;再用温生理盐水复温,引起缺血再灌注损伤,双重作用加重对细胞的损伤[2]。
4.2 术肢运动机能恢复情况 犬髋关节作为犬全身最重要的负重关节,是连接躯干与下肢的球窝多轴关节[3]。本试验4组犬经过手术后,术后1 d,造模组、髓芯减压组的所有犬术肢回缩,呈悬垂状态,均不能着地,而BMSCs-CM治疗组有1只犬可以着地,BMSCs治疗组有5只犬可以着地;术后2 d,造模组仅有2只犬可以点地行走,髓芯减压组有3只犬可以点地行走,而BMSCs-CM治疗组有5只犬可以点地行走,BMSCs治疗组的6只犬全部可以点地行走;造模组、髓芯减压组于术后3 d,各有2只犬可以全负面着地行走,而BMSCs-CM治疗组、BMSCs治疗组各自的6只犬均可以全负面着地行走。造模组、髓芯减压组犬于7 d后,BMSCs-CM治疗组犬于5 d左右、BMSCs治疗组犬于4 d左右,步态和运动量基本恢复正常。
4.3 DR结果分析 本试验采用了DR进行股骨头影像学检测,造模组、髓芯减压治疗组、BMSCs-CM治疗组、BMSCs治疗组,在术后21 d、42 d、63 d,冷冻区域密度均在逐渐升高,这点与文献报道的早期ANFH表现为股骨头承重区斑片状骨质硬化,呈局限性片状高密度灶表现一致[4]。牛敬才等[5]在21 d 时就已经观察到试验侧股骨头骨密度有所增加,而本试验在42 d时才发现试验侧股骨头密度有所增加,这可能是由于我们采用的是棉签蘸取液氮冷冻,范围有限,而他们采用漏斗倾倒液氮的方式,坏死程度和范围更广,修复距离增加。
4.4 股骨头大体形态分析 本试验在术后63 d,造模组出现了软骨剥脱情况,表面粗糙且色泽暗黄,说明骨内有明显的出血现象,坏死严重,髓芯减压治疗组、BMSCs-CM治疗组、BMSCs治疗组在术后63 d,都没有出现软骨剥脱的情况,与造模组相比,股骨头冷冻处的颜色较造模组浅,表面也没有那么粗糙。说明3种治疗措施都延缓了股骨头坏死的进程,但是髓芯减压治疗组股骨头表面粗糙且颜色泛黄情况较BMSCs-CM治疗组、BMSCs治疗组严重,说明髓芯减压对股骨头坏死治疗效果不佳,而BMSCs-CM和BMSCs对股骨头坏死治疗效果明显。
4.5 组织病理切片结果分析 股骨头的病理组织学特征是最直观、最准确的判断股骨头坏死的指标。其病理组织学判定标准可归纳为以下4点:(1)骨髓造血成分凋亡,脂肪细胞水肿、变性;(2)骨髓脂肪网状坏死;(3)骨小梁变薄、断裂和完全坏死;(4)在坏死的骨髓及骨小梁周围,有纤维组织或类新骨组织形成[6]。
4.6 空骨陷窝率结果分析 除了病理组织学判断标准外,骨细胞的状态也能作为诊断骨坏死的重要依据,骨细胞是骨组织的重要构成部分,它由成骨细胞转变而来,被包埋在骨陷窝中[7];经骨髓间充质干细胞治疗后,相对于造模组空骨陷窝率显著下降。
髓芯减压、骨髓间充质干细胞、骨髓间充质干细胞分泌因子对犬股骨头缺血性坏死都有一定的治疗效果;髓芯减压可以减缓股骨头缺血性坏死的进程,但是在治疗早期效果并不明显;骨髓间充质干细胞及其分泌因子可以促进成骨细胞增殖分化,加速股骨头内血运恢复,对治疗犬股骨缺血性坏死效果明显,但是由于骨髓间充质干细胞治疗组是直接增加了坏死区内的干细胞数量,而骨髓间充质干细胞分泌因子组并不会立即增加坏死区内干细胞数量[8],它促进内源性干细胞的增殖分化也需要一定时间,所以骨髓间充质干细胞治疗组较骨髓间充质干细胞分泌因子组要先发挥成骨作用,能更早地促进骨的修复与重建,疗效显著。
