扶正化瘀胶囊联合恩替卡韦治疗慢性乙型肝炎肝纤维化的系统评价Δ
2020-01-06廖庆英张雯雯李浩田魏士长文建霞赵艳玲
马 骁,廖庆英,何 璇,关 蓉,张雯雯,李浩田,魏士长,文建霞,,赵艳玲#
(1.成都中医药大学药学院,中药材标准化教育部重点实验室,四川 成都 611137; 2.成都市新都区石板滩镇卫生院药剂科,四川 成都 610511; 3.中国人民解放军总医院第五医学中心药学部,北京 100039)
慢性乙型肝炎是全球公认的重大公共卫生问题,25%~40%的慢性乙型肝炎患者将持续发展至肝硬化或肝癌,而肝纤维化是慢性乙型肝炎向终末期肝病发展的必经过程[1-3]。恩替卡韦作为抗乙型肝炎病毒(hepatitis B virus,HBV)药被证实能够在缓解慢性乙型肝炎的肝纤维化进程中发挥出抗病毒作用,然而,尚无特异性针对慢性乙型肝炎肝纤维化发展的特效药物[4]。临床多项研究结果证明,扶正化瘀胶囊可有效改善多种原因所致肝纤维化、肝硬化等多种肝病[5-7]。目前,扶正化瘀胶囊在多项临床随机对照试验(randomized controlled trial,RCT)结果支持下,已被列为治疗慢性乙型肝炎肝纤维化的推荐药物[8]。基于此,本研究将从循证药学的角度,系统评价扶正化瘀胶囊联合恩替卡韦治疗慢性乙型肝炎肝纤维化的有效性与安全性,有助于指导临床合理应用扶正化瘀胶囊。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型:相关的临床RCT研究文献。
1.1.2 研究对象:符合《慢性乙型肝炎防治指南》或《病毒性肝炎治疗指南》等诊断标准,并诊断为HBV相关的肝纤维化患者。
1.1.3 干预措施:观察组患者采用扶正化瘀胶囊联合恩替卡韦治疗,对照组患者单独采用恩替卡韦治疗。
1.1.4 结局指标:肝功能相关指标水平,包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)及白蛋白(ALB);肝纤维化相关指标水平,包括透明质酸(HA)、Ⅲ型前胶原(PC-Ⅲ)、Ⅳ型胶原(Ⅳ-C)及层粘连蛋白(LN);HBV DNA转阴率;脏器影像情况与肝脏僵硬程度。
1.1.5 排除标准:重复发表的文献;非RCT研究(包含临床案例报道、相关文献综述、动物药理实验及非RCT临床试验等类型的文献);结局指标评定不全面、不准确的相关文献;RCT研究中观察组干预措施除扶正化瘀胶囊及恩替卡韦外还包含其他药物,对照组未使用恩替卡韦进行干预;包含有慢性乙型肝炎肝硬化或已发展至肝癌等进程的患者。
1.2 文献检索策略
采用PRISMA流程对文献进行检索与筛选,以独立检索的方式检索中国知网(CNKI)、万方数据库、维普数据库(VIP)及中国生物医学文献数据库(CBM)等4个中文数据库和Pubmed、EMBase及the Cochrane Library等3个英文数据库,检索时限为建库至2019年3月。在检索时采用PICOS原则,将题目分解为“P:慢性乙型肝炎+肝纤维化”“I:扶正化瘀胶囊+恩替卡韦”“C:恩替卡韦”“O:慢性乙型肝炎病毒学与肝纤维化相关指标”和“S:随机对照试验”。因此,采用“扶正化瘀胶囊+恩替卡韦+肝纤维化+慢性乙型肝炎”为关键词(主题词)分别预检索中英文数据库,并根据预检索结果,进一步优化检索策略,最终记录并收集检索文献的情况。
1.3 资料提取与方法学质量评价
将检索的文献进一步收集、整理与汇总,严格按照Cochrane协作网的系统评价工作手册相关标准及已制定的纳入、排除标准,筛选出合格的文献。提取符合标准文献的相关信息,记录基线信息、给药情况、治疗疗程及给药剂量等数据。通过Cochrane协助网的RCT质量评估标准,对纳入的文献进行方法学质量评价,明确纳入文献在随机方法、分配隐藏、实施者与参与者双盲、结局评估盲法、不完整结局数据、选择性报告及其他等7个维度的偏倚情况。
1.4 统计学方法
采用RevMan 5.3软件对记录的数据进行统计学分析,二分类变量与连续性变量分别使用相对危险度(RR)、平均差值(MD)进行统计,计算95%置信区间(CI)。当合并的数据无显著异质性(P≥0.10,I2≤50%)时,采用固定效应模型进行分析;合并的数据具有显著异质性(P≤0.10,I2≥50%)时,则采用随机效应模型分析;P<0.05为差异有统计学意义。同时,绘制倒漏斗图,对报道数量充足的数据进行发表偏倚分析。
2 结果
2.1 文献筛选流程及结果
初步检索出166篇文献;排除重复文献73篇,剩下93篇文献进行进一步筛析;排除不相关论文52篇、综述论文7篇,剩余34篇文献进行全文评价;经过全文泛读,按照纳入、排除标准筛选出符合Meta分析标准的文献,共17篇[9-25],见图1。

图1 文献筛选流程及结果Fig 1 Screening process and results of included literature
2.2 纳入文献的基本特征
纳入的17篇[9-25]文献共涉及1 440例患者,其中,观察组患者730例,对照组患者710例;纳入文献中,RCT的最大样本量为128例,最少为52例;患者年龄主要范围为18~70岁;恩替卡韦给药剂量为1次0.5 mg,扶正化瘀胶囊给药剂量为1次1~5粒;疗程为24周至12个月不等,见表1。
2.3 纳入文献的方法学质量评价
17篇[9-25]文献中,7篇[12,18-19,22-25]采用随机数字方法,为低风险,另外2篇[11,13]所使用随机方法为高风险;均未报告分配隐藏,1篇[25]提及实施者与参与者双盲、结局评估盲法;8篇[11-12,16-19,24-25]无缺失数据,1篇[14]数据的报告存在不完整可能;1篇[13]报告主要结局指标未采用预先指定的测定方法,5篇[12,17,19,24-25]则为低风险;3篇[12,19,25]无其他偏倚来源。纳入文献的方法学质量评价见图2。

表1 纳入文献的基本特征Tab 1 Basic characteristic of included literature

图2 纳入文献的方法学质量评价Fig 2 Methodological quality assessment of included literature
2.4 Meta分析结果
2.4.1 肝功能指标水平。(1)13篇[9,11-14,16-22,25]文献报告了治疗后血清ALT、AST水平变化情况,各研究间具有显著异质性(P<0.000 01,I2=93%;P<0.000 01,I2=96%),故采用随机效应模型进行Meta分析。结果显示,治疗后,观察组患者血清ALT(MD=-15.06,95%CI=-19.87~-10.25,P<0.000 01)、AST(MD=-13.59,95%CI=-19.76~-7.42,P<0.000 1)水平明显低于对照组,差异均有统计学意义,见图3(A—B)。(2)8篇[9,11-12,17-19,21,25]文献报告了治疗后血清TBIL水平变化情况,各研究间具有显著异质性(P<0.000 01,I2=93%),故采用随机效应模型进行Meta分析。结果显示,治疗后,观察组患者血清TBIL水平明显低于对照组,差异有统计学意义(MD=-7.24,95%CI=-11.07~-3.40,P=0.000 2),见图3(C)。(3)4篇[9,12,17,25]文献报告了治疗后血清ALB水平变化情况,各研究间无显著异质性(P=0.15,I2=43%),故采用固定效应模型进行Meta分析。结果显示,治疗后,观察组患者ALB水平明显高于对照组,差异有统计学意义(MD=1.86,95%CI=1.08~2.64,P<0.000 01),见图3(D)。

A.ALT;B.AST;C.TBIL;D.ALBA.ALT;B.AST;C.TBIL;D.ALB图3 两组患者肝功能指标水平比较的Meta分析森林图Fig 3 Meta-analysis forest plot of comparison of liver function levels between two groups
2.4.2 肝纤维化指标水平:(1)16篇[9-19,21-25]文献报告了治疗后血清HA水平变化情况,各研究间具有显著异质性(P<0.000 01,I2=97%),故采用随机效应模型进行Meta分析。结果显示,治疗后,观察组患者血清HA水平明显低于对照组,差异有统计学意义(MD=-54.78,95%CI=-64.10~-45.46,P<0.000 01),见图4(A)。(2)分别有16篇[9-19,21-25]、15篇[9-19,22-25]文献报告了治疗后血清PC-Ⅲ、Ⅳ-C水平变化情况,各研究间具有显著异质性(P<0.000 01,I2=97%;P<0.000 01,I2=99%),故采用随机效应模型进行Meta分析。结果显示,治疗后,观察组患者血清PC-Ⅲ(MD=-48.28,95%CI=-56.29~-40.28,P<0.000 01)、Ⅳ-C(MD=-39.74,95%CI=-52.73~-26.75,P<0.000 01)水平明显低于对照组,差异均有统计学意义,见图4(B—C)。(3)16篇[9-19,21-25]文献报告了治疗后LN水平变化情况,各研究间具有显著异质性(P<0.000 01,I2=98%),故采用随机效应模型进行Meta分析。结果显示,治疗后,观察组患者血清LN水平明显低于对照组,差异有统计学意义(MD=-37.56,95%CI=-47.87~-27.24,P<0.000 01),见图4(D)。
2.4.3 HBV DNA转阴率:6篇[12,15,17-18,22,25]文献报告了治疗后血清HBV DNA转阴情况,各研究间无显著异质性(P=0.38,I2=3%),故采用固定效应模型进行Meta分析。结果显示,治疗后,观察组患者血清HBV DNA转阴率有高于对照组的趋势,但差异无统计学意义(RR=1.06,95%CI=0.98~1.13,P=0.13),见图5。
2.4.4 脏器影像情况与肝脏僵硬程度:3篇[20,22,25]、10篇[9-12,17-19,21-22,25]和9篇[9-12,17-19,21,25]文献分别报告了治疗后肝脏僵硬程度、门静脉内径和脾厚度情况,各研究间具有显著异质性(P<0.000 01,I2=97%;P<0.000 01,I2=98%;P<0.000 01,I2=90%),故采用随机效应模型进行Meta分析。结果显示,治疗后,观察组患者肝脏僵硬程度(MD=-5.35,95%CI=-10.51~-0.19,P=0.04)、门静脉内径(MD=-1.57,95%CI=-2.62~-0.52,P=0.003)与脾厚度(MD=-6.19,95%CI=-8.15~-4.23,P<0.000 01)明显低于对照组,差异均有统计学意义,见图6。
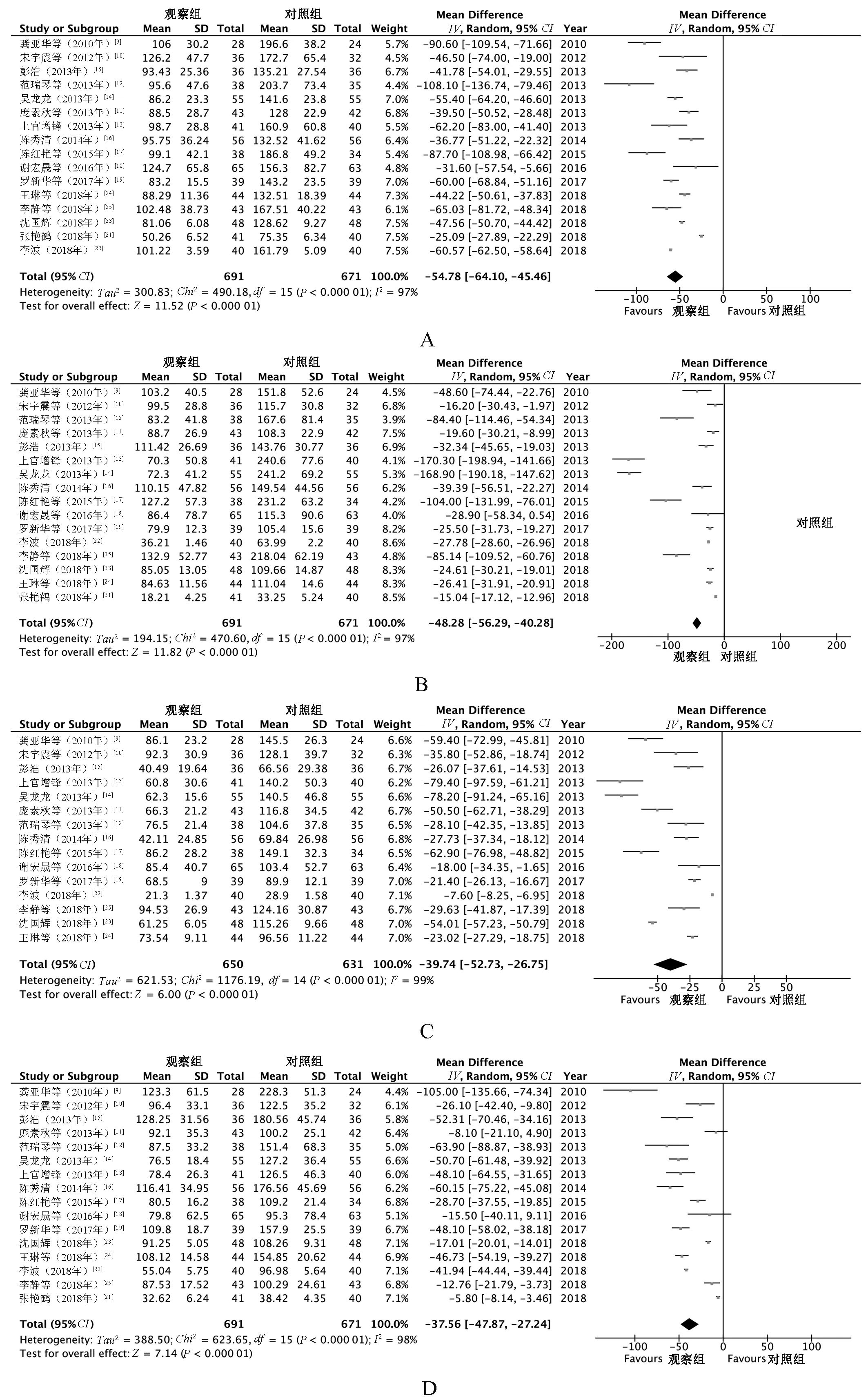
A.HA;B.PC-Ⅲ;C.Ⅳ-C;D.LNA.HA;B.PC-Ⅲ;C.Ⅳ-C;D.LN图4 两组患者肝纤维化指标水平比较的Meta分析森林图Fig 4 Meta-analysis forest plot of comparison of liver fibrosis levels between two groups

图5 两组患者HBV DNA转阴率比较的Meta分析森林图Fig 5 Meta-analysis forest plot of comparison of HBV DNA negative rate between two groups

A.肝脏僵硬程度;B.门静脉内径;C.脾厚度A.liver stiffness; B.portal vein diameter; C.spleen thickness图6 两组患者脏器影像、肝脏僵硬程度比较的Meta分析森林图Fig 6 Meta-analysis forest plot of comparison of viscera image and liver stiffness between two groups
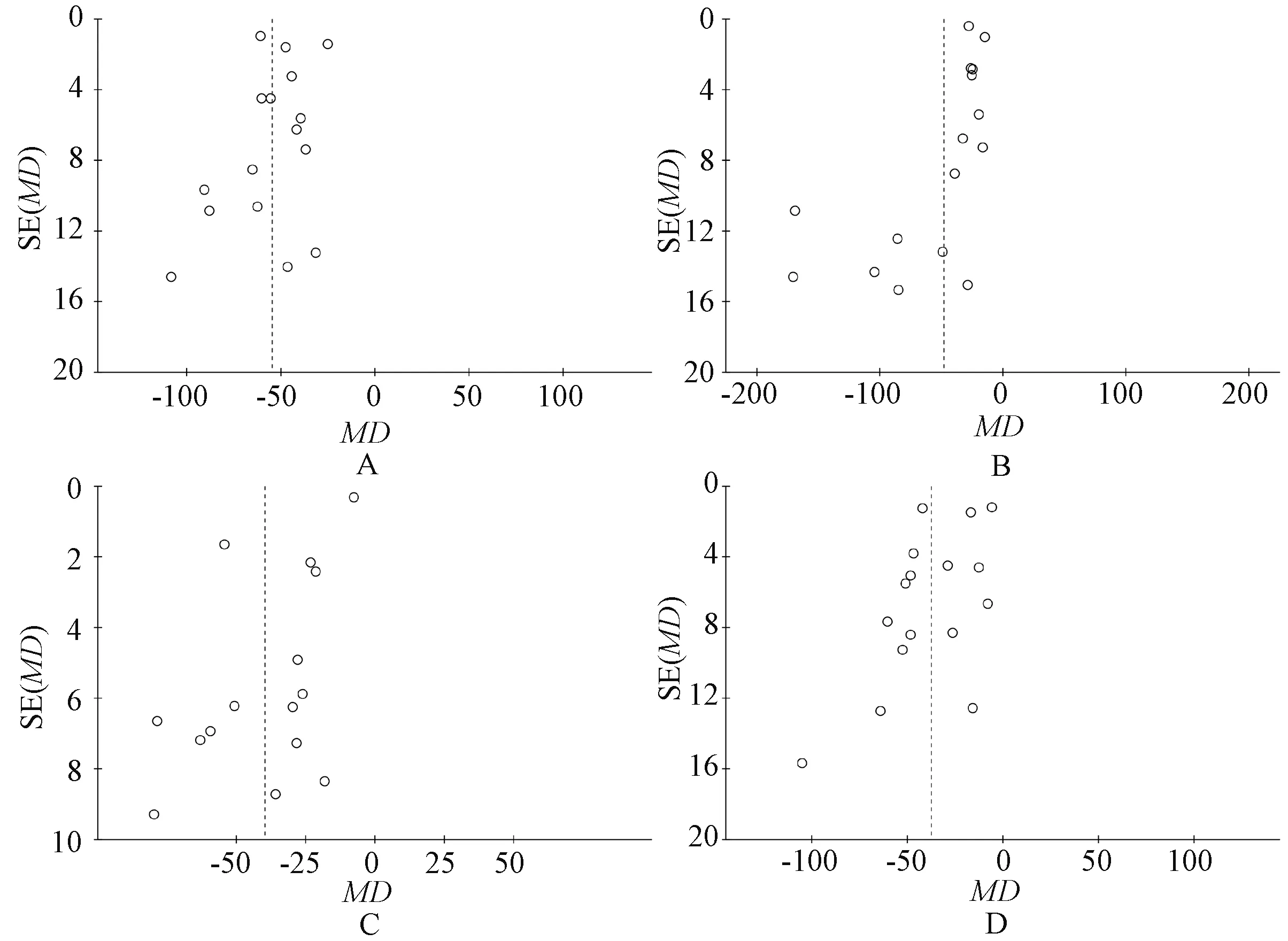
A.HA;B.PC-Ⅲ;C.Ⅳ-C;D.LNA.HA;B.PC-Ⅲ;C.Ⅳ-C;D.LN图7 基于肝纤维化指标水平的发表偏倚倒漏斗图Fig 7 Funnel plot based on liver fibrosis levels
2.4.5 不良反应发生率:9篇[9-10,12,14,16-17,19,22,24]文献报告了不良反应发生情况,其中,4篇[12,16-17,22]提及观察组患者出现头痛、恶心、眩晕、腹泻及胃部不适等不良反应合计9例,对照组患者出现相关不良反应合计4例;其余5篇[9-10,14,19,24]均提及两组患者无不良反应发生。由上可知,扶正化瘀胶囊联合恩替卡韦治疗慢性乙型肝炎肝纤维化具有较高的安全性。
2.4.6 发表偏倚评估:针对主要结局指标HA、PC-Ⅲ、Ⅳ-C及LN水平绘制倒漏斗图,结果显示,倒漏斗图均存在不对称情况,提示存在一定的发表偏倚,见图7。
3 讨论
HBV感染是诱发肝纤维化的重要因素,在慢性乙型肝炎肝纤维化的治疗中,抑制肝纤维化与抗病毒是2个相辅相成的过程。恩替卡韦是目前作用最强的口服抗HBV药,其抗病毒活性超过其他核苷类似物300倍,抑制病毒的能力优于同类药物,但病毒耐药性远低于其他核苷类药物[26]。我国传统医学认为,血瘀阻络是肝纤维化发生的基本病因,而正气亏虚则是肝纤维化形成的内在条件。扶正化瘀胶囊功效为活血祛瘀、益精养肝,自2002年被批准上市以来,已广泛应用于临床肝纤维化和肝硬化的治疗,但在循证药学方面的证据仍需要进一步发掘。因此,本研究系统评价了扶正化瘀胶囊联合恩替卡韦治疗慢性乙型肝炎肝纤维化的有效性与安全性,为进一步指导临床合理用药提供依据。
本研究结果显示,扶正化瘀胶囊联合恩替卡韦治疗慢性乙型肝炎肝纤维化,可显著抑制患者血清ALT、AST活性,降低血清TBIL水平,提升血清ALB水平,提示联合用药能够减轻HBV诱导的肝损伤。血清肝纤维化指标是反映细胞外基质代谢特征的经典指标,与肝纤维化程度高度相关,为目前评价肝纤维化的重要非创伤性指标。本研究结果显示,扶正化瘀胶囊联合恩替卡韦治疗,可显著抑制患者血清NA、PC-Ⅲ、Ⅳ-C及LN活性。肝脏僵硬程度、门静脉内径及脾厚度为间接反映肝纤维化程度的指标,本研究结果显示,扶正化瘀胶囊联合恩替卡韦治疗还能显著降低患者肝脏僵硬程度、门静脉内径及脾厚度。故综合提示,相较于单独应用恩替卡韦,联合用药能够显著缓解慢性乙型肝炎肝纤维化进程。值得注意的是,联合用药在HBV DNA转阴率方面的效果与单独应用恩替卡韦相近,提示扶正化瘀胶囊无明显抗病毒作用。
此外,本研究存在以下局限性如下:首先,纳入的部分文献在质量评估上存在潜在的偏倚,由于部分文献中提供的相关信息不充分,难以对这些文献偏倚进行更细致的评价;其次,纳入的文献中,部分RCT样本量不大,最少为52例,无法具有更广泛的代表性。设计大样本、多中心、随机和双盲等高质量的相关临床试验是解决上述2个方面局限性的重要方法[27]。今后的临床试验也应进一步结合扶正化瘀胶囊联合恩替卡韦在剂量、疗程及不良反应发生率方面的特征,进行更细致的设计,以获取联合用药规律的高水平证据,为临床实践提供直接指导。
综上所述,现有文献分析结果提示,相较于单独应用恩替卡韦,扶正化瘀胶囊联合恩替卡韦治疗慢性乙型肝炎肝纤维化,能够显著降低肝脏损伤程度,抑制肝纤维化进程,但两者在HBV DNA转阴率方面的效果相近。由于本研究所纳入的文献有一定偏倚风险,因此,建议应差异更严格、更规范的方式进行RCT研究,进一步为扶正化瘀胶囊联合恩替卡韦的临床安全、有效应用提供保障。
