乙酰半胱氨酸治疗晚期新生儿社区获得性肺炎的疗效观察
2020-01-06魏春晖郑明平
叶 圣,魏春晖,陈 强,郑明平
(福建医科大学附属宁德市医院新生儿科,福建 宁德 352100)
社区获得性肺炎(community acquired pneumonia,CAP)是晚期新生儿(出生14~28 d)最常见的感染性疾病,也是导致晚期新生儿死亡的重要因素[1]。炎症导致肺部痰液的增多,影响了晚期新生儿的呼吸功能,因此,除了CAP的基础治疗外,常加用祛痰药物辅助治疗。目前,全国多家新生儿中心均已证实氨溴索在新生儿CAP治疗中的疗效[2-4]。但氨溴索在国内并无雾化制剂,属于超说明书用药,存在一定的风险,需要谨慎对待。乙酰半胱氨酸为新型雾化祛痰药,已有在多地区儿科中心应用于CAP的治疗经验[5-7],但针对晚期新生儿CAP的研究仍较缺乏。本研究探讨了乙酰半胱氨酸治疗晚期新生儿CAP的疗效及对氨溴索的替代价值,现报告如下。
1 资料与方法
1.1 资料来源
选取2017年6月至2018年6月福建医科大学附属宁德市医院收治的晚期新生儿CAP患儿162例。纳入标准:符合CAP诊断[8],即有发热、咳嗽和气促等症状,肺部闻及中细湿啰音和(或)影像学检查提示存在肺炎;C反应蛋白(CRP)、降钙素原(PCT)水平升高,提示存在细菌感染;年龄14~28 d;通过伦理审批,监护人知情同意。排除标准:病毒感染性肺炎者;医院内感染者;存在如肺不张、败血症及细菌性脑膜炎等严重并发症者;需呼吸支持治疗者。采用抽签法随机分为A、B和C组,每组54例。引入转运生理稳定指数(transport risk index of physiologic stability,TRIPS)评分进行快速评估病情轻重程度[9]。A组患儿中,男性30 例,女性24 例;胎龄35~39+6周,平均(37.60±1.55)周;日龄14.1~27.9 d,平均(22.06±4.22) d;体质量2.54~4.99 kg,平均(3.47±0.58)kg;TRIPS评分9~37分,平均(22.07±9.00)分。B组患儿中,男性28例,女性26例;胎龄33~41+4周,平均(36.68±2.49)周;日龄15.3~27.7 d,平均(21.46±3.95)d;体质量2.51~4.49 kg,平均(3.51±0.63) kg;TRIPS评分9~38分,平均(22.94±9.52)分。C组患儿中,男性25例,女性29例;胎龄34+1~40+4周,平均(37.14±1.98)周;日龄14.9~26.8 d,平均(21.00±3.68) d;体质量2.53~4.50 kg,平均(3.49±0.61) kg;TRIPS评分9~38分,平均(25.28±9.04)分。三组患儿一般资料相似,具有可比性。
1.2 方法
A组患儿给予CAP常规管理,应用抗菌药物,每4 h翻身拍背,及时吸痰等综合治疗[10-11]。B组患儿在A组的基础上加用盐酸氨溴索注射液(规格:15 mg∶2 ml)1次7.5 mg,加0.9%氯化钠注射液至2 ml,雾化5 min,1日2次,治疗7 d。C组患儿在A组的基础上加用吸入用乙酰半胱氨酸溶液(规格:3 ml∶0.3 g)雾化吸入,1次1 ml,加0.9%氯化钠注射液至2 ml,雾化5 min,1日2次,治疗7 d。
1.3 观察指标
(1)症状复常时间。观察三组患儿住院期间发热、咳嗽及痰鸣复常时间。(2)辅助检查。三组患儿入院当日、治疗7 d后分别检查CRP、PCT水平和胸部X线情况。(3)安全性。比较三组患儿入院当日、治疗7 d的安全指标:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酐(SCr)及尿素氮(BUN)水平。(4)临床疗效。
1.4 疗效评定标准
痊愈:临床症状消失,CRP、PCT水平恢复正常,且胸部X线检查结果提示肺炎基本吸收;有效:临床症状改善,CRP、PCT水平降低,且胸部X线检查结果提示肺炎稍吸收;无效:临床症状消失,CRP、PCT水平升高或无明显变化,且胸部X线检查结果提示肺炎依旧或加重[12]。总有效率=(痊愈病例数+有效病例数)/总病例数×100%。
1.5 统计学方法

2 结果
2.1 三组患儿临床症状复常时间比较
B、C组患儿发热、咳嗽及痰鸣复常时间明显短于A组,差异均有统计学意义(P<0.05);但B、C组的差异均无统计学意义(P>0.05),见表1。
表1 三组患儿临床症状复常时间比较Tab 1 Comparison of recovery time of clinical symptoms
2.2 三组患儿治疗前后血清CRP、PCT水平比较
治疗前,三组患儿CRP、PCT水平的差异均无统计学意义(P>0.05);治疗后,B、C组患儿CRP、PCT水平明显低于A组,差异均有统计学意义(P<0.05),但B、C组的差异均无统计学意义(P>0.05),见表2。
表2 三组患儿治疗前后血清CRP、PCT水平比较Tab 2 Comparison of serum CRP and PCT among three groups before and after treatment
2.3 三组患儿临床疗效比较
B、C组患儿的总有效率明显优于A组,差异均有统计学意义(A、B组比较,χ2=7.144,P=0.008;A、C组比较,χ2=6.000,P=0.014);但B、C组的差异无统计学意义(χ2=0.055,P=0.814),见表3(两两比较的χ2检验需根据公式调整检验水准,仅当P<0.017时有意义)。
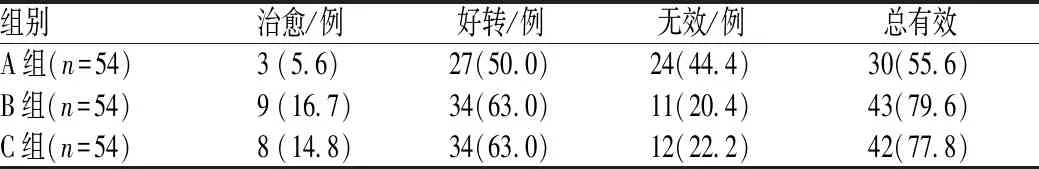
表3 三组患儿临床疗效比较[例(%)]Tab 3 Comparison of clinical efficacy among three groups [cases (%)]
2.4 三组患儿ALT、AST、SCr及BUN水平比较
治疗前后,三组患儿ALT、AST、SCr及BUN水平的差异均无统计学意义(P>0.05),见表4。
3 讨论
CAP的药物治疗途径分为口服、静脉及雾化给药,最主要的目的是为了让药物能到达下呼吸道,维持病变部位的血药浓度。雾化给药可使药物直达病变部位,消除了口服给药的吸收过程,减少了静脉给药的风险,因此,除必要的口服及静脉治疗外,应优选雾化给药治疗[13]。感染造成气道分泌物增加,影响了通气、换气功能。新生儿尤其是早产儿呼吸系统发育不健全,纤毛摆动功能低下,呼吸中枢的不成熟造成咳嗽反射弱,当发生CAP时,容易导致痰液排出困难,因此,雾化祛痰是必要的。氨溴索是我国临床常见的雾化祛痰药,应用广泛[14]。气道高反应现象常由患儿的肺部感染造成,氨溴索经由0.9%氯化钠注射液溶解后呈酸性状态,而正常生理状态下呼吸道上皮表面的黏液为中性,应用氨溴索酸性溶液的雾化刺激后可导致支气管痉挛[15]。此外,氨溴索国内无雾化品种,尚无正式的安全性评价,属超说明书用药。乙酰半胱氨酸为《儿童常见呼吸道疾病雾化吸入治疗专家共识》[16]遴选的雾化祛痰药,乙酰半胱氨酸所含巯基可裂解痰液蛋白中的双硫键,使痰液稀释,易于排出。其由氨基酸合成,可在体内代谢为半胱氨酸,并在体内发挥抗炎、抗氧化和调节免疫的功能[17-18]。另外,结合国外指南推荐的祛痰药种类[19],本研究选取国内应用最广泛的氨溴索和目前具有良好应用前景的乙酰半胱氨酸进行临床对比。
表4 三组患儿ALT、AST、SCr及BUN水平比较Tab 4 Comparison of ALT, AST, SCr and BUN among three groups before and after treatment
本研究结果显示,B、C组患儿发热、咳嗽及痰鸣复常时间明显短于A组,差异均有统计学意义(P<0.05),考虑氨溴索与乙酰半胱氨酸雾化治疗均可以改善晚期新生儿CAP的症状;但B、C组的差异均无统计学意义(P>0.05),提示氨溴索与乙酰半胱氨酸在改善晚期新生儿CAP的临床症状方面效果相当。细菌是导致新生儿CAP感染最主要的病原体[20-21]。本研究应用CRP、PCT 2种炎症指标进行细菌感染判断和评估治疗效果,结果显示,治疗后,B、C组患儿CRP、PCT水平明显低于A组,差异均有统计学意义(P<0.05);但B、C组的差异均无统计学意义(P>0.05)。B、C组患儿的总有效率明显优于A组,差异均有统计学意义(P<0.05);但B、C组的差异无统计学意义(P>0.05)。提示应用氨溴索、乙酰半胱氨酸治疗晚期新生儿CAP均有效且两者治疗效果相当。由于药物多通过肝肾代谢,故选取能够代表肝肾功能的ALT、AST、SCr及BUN作为安全性指标进行比较,结果显示,治疗前后三组患儿ALT、AST、SCr及BUN水平的差异均无统计学意义(P>0.05),提示乙酰半胱氨酸在新生儿中的应用是安全的。因此,可以考虑将乙酰半胱氨酸替代氨溴索应用于新生儿CAP的治疗。但目前样本量仍较少,有待进一步的研究。
综上所述,乙酰半胱氨酸雾化吸入治疗晚期新生儿CAP,可改善临床症状,用药安全,疗效明确,可考虑用乙酰半胱氨酸替代氨溴索,以减少超说明书用药的风险。
