青海湖裸鲤胚胎不同发育时期TRH mRNA的原位杂交
2020-01-01梁志康冯静雯谢保胜
梁志康,冯静雯,谢保胜
(1. 青海大学昆仑学院, 西宁 810016; 2. 高原生态与农业国家重点实验室,青海大学生态环境工程学院,西宁 810016)
70年代,Giullemin和Schall先后在绵羊和猪的下丘脑中分离提纯促甲状腺激素释放激素(thyrotropin-releasing hormone,TRH),该激素是由焦谷氨酸-组氨酸-脯氨酞胺组成的一类神经多肽分子[1]。促甲状腺激素释放激素在中枢神经系统的脑部、垂体、脊髓和甲状腺等均有表达,且该基因序列在脊椎动物中具有保守性[1]。除了对脑垂体的调节作用外,对神经系统具有保护和促进生长的作用[2]、对皮肤的新皮生成和抑制肠道胃酸的分泌等均有作用[3];此外,在器官和组织上生长、分化和代谢方面也有影响[4]。而促甲状腺激素释放激素在青海湖裸鲤的研究尚未发现报道,尤其是在裸鲤胚胎发育中的TRH基因表达水平的研究更未提及。为此,对青海湖裸鲤胚胎的TRH基因的原位杂交进行了研究,分析其表达部位和表达时期的时空特点,获得TRH基因在青海湖裸鲤的发育相关表达的初步研究,为以后进一步研究青海湖裸鲤的细胞与发育生物学提供实验数据。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验用青海湖裸鲤及其胚胎由青海湖裸鲤救护中心刚察县孵化站提供(青海,刚察)。亲鱼采自沙柳河野生健康的成年青海湖裸鲤,室外人工授精,孵化车间进行孵化,孵化水温11~13℃。1~11 d胚胎用4%的多聚甲醛固定48 h,置于-20℃保存,用于整胚原位杂交,参照文献[5-6]进行操作。成年鱼麻醉取脑组织至于冻存管后,立刻放液氮中保存备用。
1.1.2 试剂与仪器
Takara MiniBest Universal RNA Extraction Kit试剂盒(Takara)、primerscritTMⅡ1st strand cDNA synthesis kit试剂盒(Takara)、Green Taq mix试剂盒(Vazyme)、DNA纯化试剂盒(Takara)、SanPrep柱式质粒DNA小量抽提试剂盒(Sangon Biotech)、T载体PCR产物快速连接试剂盒(Promega)、HM(-)、HM(+)、脱色液、封闭液、显色液、终止液等。
尼康体视显微镜(Nikon SMZ18,日本)、核酸检测仪(Implen N60,德国)、循环浴槽(PolyScience,美国)、凝胶成像仪(Uvitec Essential V6,英国)、高速冷冻离心机(Eppendorf,德国)、梯度PCR仪(Eppendorf,德国)、离心机(Sigma,德国)、BG-Power300电泳仪(Baygene,中国)等。
1.2 方法
1.2.1 引物设计与合成
从青海大学生态环境工程学院青海湖裸鲤转录组测序结果得到的TRH基因序列,使用Primer Premier 5.0设计引物,扩增基因片段长度为552 bp,引物序列为TRH-F:5’-GCAGGA CCGAGGT TGTCATGAG-3’;TRH-R:5’-TCCAGTCCTCGCAC AGTCTCTTC-3’。引物合成由生工生物工程(上海)公司完成。
1.2.2 总RNA的提取和cDNA的合成
从液氮中取出脑组织,用组织研磨器(Tiangen)进行研磨,使用Takara MiniBest Universal RNA Extraction Kit提取总RNA,核酸微量仪检测提取的RNA浓度和纯度。
1.2.3 PCR扩增与纯化
使用Green Taq mix试剂盒,常规PCR扩增。回收扩增产物并用DNA纯化试剂盒纯化,检测回收条带。
1.2.4 连接、转化和测序
目的片段与PGEM-T载体链接并转化至DH5α大肠杆菌。LB培养基37℃培养,经菌液PCR菌液验证后测序。
1.2.5 提取质粒
利用SanPrep柱式质粒DNA小量抽提试剂盒提取质粒DNA,检测质粒的浓度和纯度。
1.2.6 制备探针
分析测序结果:TRH基因插入方向为正向,上游引物在T7端,选择的酶切位点在T7端。将上述提取的重组质粒用Sac Ⅱ酶酶切,用地高辛抗体和SP6 RNA聚合酶制备RNA探针[7]。
1.2.7 原位杂交
杂交第1天:取1~11 d的青海湖裸鲤胚胎各五个至EP管中;复水处理;胰蛋白酶处理胚胎,1~3 d的胚胎不做处理,4~11 d的胚胎蛋白酶K处理时间依次为20、25、30、35、40、45、50、60 min。脱色处理,1~11 d的胚胎脱色液处理时间依次为0.5、1、2、3、4、6、8、10、12、14、16 min。将胚胎放入杂交槽中,加入400 μL预热的HM(-),70℃水浴2 h。弃HM(-),加入500 μL HM(+)与TRH探针混合液。杂交槽避光,70℃水浴过夜。
杂交第2天:回收探针;HM(-)和SSC(柠檬酸钠缓冲液)处理70℃水浴,避光。在如下梯度洗涤:
100% HM(-),15 min;75% HM(-)+25% 2 × SSC, 15 min;50% HM(-)+50% 2 × SSC, 15 min;25% HM(-)+75% 2 × SSC, 15 min;2 × SSC, 15 min;0.2 × SSC, 30 min, 2次。
室温下在慢速摇晃的摇床上进行以下梯度洗涤:
75% 0.2 × SSC+25% PBST, 10 min;50% 0.2 × SSC+50% PBST, 10 min;25% 0.2×SSC+75% PBST, 10 min;100% PBST, 10 min;
各杂交槽中加入封闭液500 μL,2 h后弃封闭液。在杂交槽中加入抗体+封闭液 500 μL,摇床1 h,4℃冰箱过夜。
杂交第3天:吸出抗体+封闭液,快速加入500 mL PBST,摇床10 min;加入500 mL PBST,摇床避光6×15 min;加入500 μL staining buffer,3×5 min显色;显色完成后,加入Stopping staining,停止显色;采集图像。

图2 青海湖裸鲤与其他鱼类的TRH的氨基酸序列同源性比较Figure 2 Comparison of the homologous alignments of the amino acid sequences of TRH of Gymnocypris przewalskii with that of other Fishes
2 结果
2.1 PCR扩增TRH基因
电泳条带清晰明亮,与预期条带552 bp的长度一致。(图1)

注:M:2000 marker;1,2,3,4,5均为相同的TRH基因PCR产物。图1 青海湖裸鲤TRH基因的PCR扩增片段Note: M: 2000 marker; 1,2,3,4,5 are PCR products of the same TRH gene.Figure 1 PCR amplification fragments of the TRH gene in Gymnocypris przewalskii
2.2 质粒DNA酶切鉴定结果
用sacⅡ酶酶切TRH基因的质粒后得到的DNA序列,结果显示条带单一,检测浓度满足制作探针的要求。
2.3 TRH基因的CDS区分析与同源性比较
DNAstar软件分析TRH基因CDS为606 bp,编码201个氨基酸(见图2)。在NCBI网上比对与其他鱼类氨基酸的同源性,并用Clustal X2.1和GeneDoc软件做同源性比对图。如图2所示,裸鲤TRH基因编码的氨基酸序列与鲤鱼(Cyprinuscarpio, XP_018964823.1)、鲫鱼(Carassiusauratus, XP_026126278.1)、犀角金线鲃(Sinocyclocheilusrhinocerous, XP_016394563.1)、滇池金线鲃(SinocyclocheilusgrahamXP_016106118.1)、斑马鱼(Daniorerio, NM_001012365.2)的同源性分别为144/187 (77%)、139/187 (74%)、129/187 69%)、117/189 (62%)、105/189 (56%)。提示青海湖裸鲤与鲤鱼、鲫鱼、犀角金线鲃和金鱼的同源性较高;与斑马鱼的同源性较低。
2.4 原位杂交结果
为更准确地证明实验的反义探针的特异性,用T7制备质粒DNA正义探针,1~11 d的胚胎原位杂交实验结果显示大脑和脊髓以及其他各组织均未发现杂交信号,胚胎浅层和组织深处的颜色均一,无明显的标记。表明阴性探针不与靶基因产生特异性杂交。用SP6制作反义探针,胚胎原位杂交显示其间脑、中脑、后脑和髓脑出现阳性杂交信号,且随着胚胎的发育,表达点不断增多,间脑表达效果明显。表明阳性探针与胚胎的靶基因产生特异性结合,以及TRH基因表达具有时间特异性和空间特异性。(见图3)
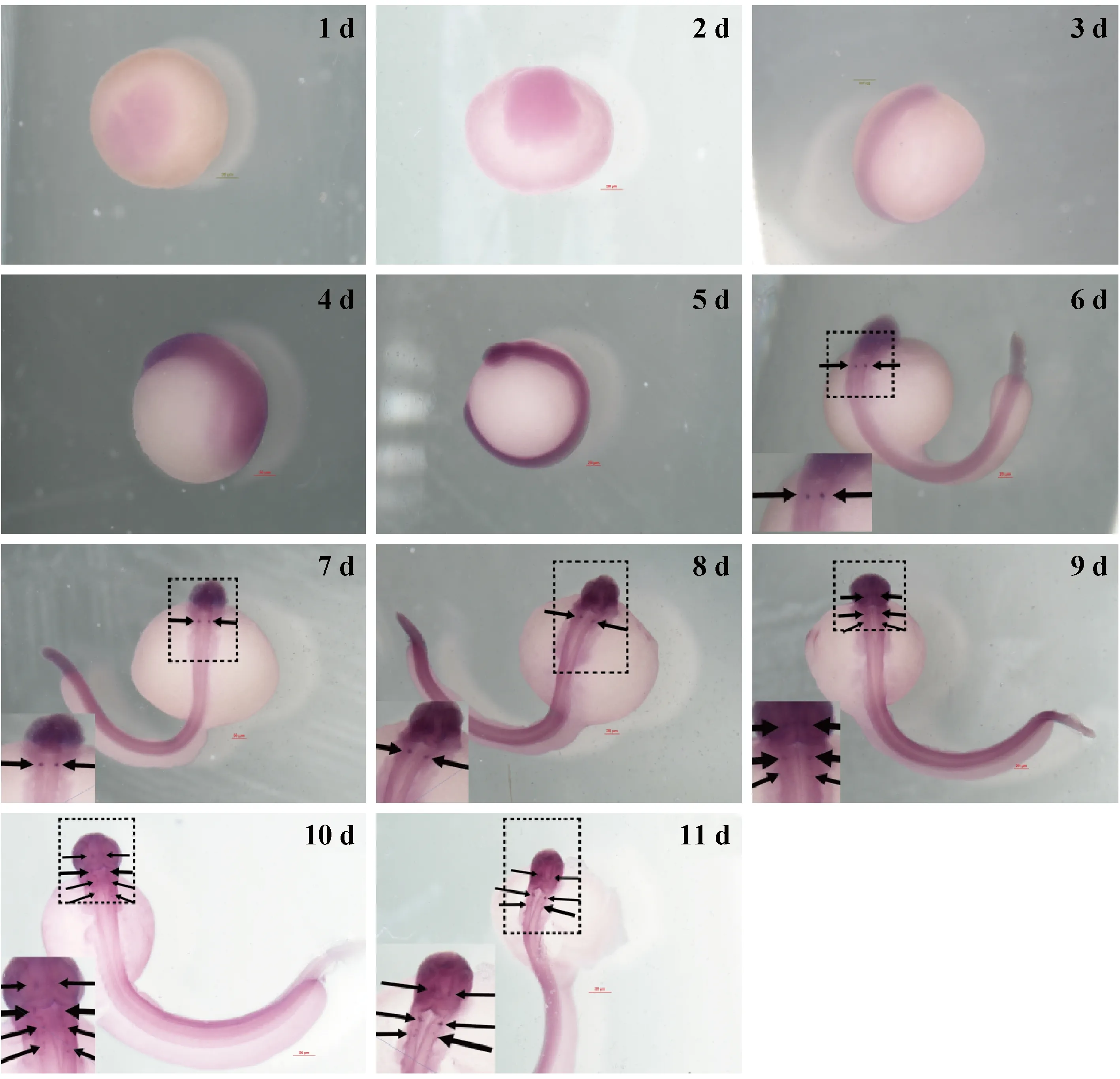
注:1 d: 2细胞期;2 d: 低囊胚期;3 d: 原肠晚期;4 d: 神经胚期;5 d: 视泡形成期;6 d: 尾牙期;7 d: 肌肉效应期 1;8 d: 肌肉效应期 2;9 d: 心脏搏动期 1;10 d: 心脏搏动期 2;11 d: 嗅板期。图3 原位杂交阳性探针图(×2)Note. 1 d, Two-cells stage. 2 d, Low blastula stage. 3 d, Late gastrula stage. 4 d, Neurula stage. 5 d, Optic vesicle stage. 6 d, Tail bud stage. 7 d, Somites stage 1. 8 d, Somites stage 2. 9 d, Heart beating stage 1. 10 d, Heart beating stage 2. 11 d, Olfactory placode stage.Figure 3 Positive probe in situ hybridization(×2)
3 讨论
青海湖裸鲤胚胎发育至视泡期之前,没有观察到TRH基因杂交信号,可能是由于该时期中枢神经系统尚未发育完善,处于神经管至脑泡脑的发育阶段。肌肉效应期阶段观察到TRH基因在脑泡脑的间脑部位有较清晰的杂交信号,而在中脑、后脑、髓脑和脊髓处没有观察到杂交信号。心脏搏动期至嗅板期阶段,间脑、中脑、后脑和髓脑检测到TRH基因均有表达,间脑的表达量明显高于其他脑部位。提示TRH基因表达最早时期出现于肌肉效应期,且主要表达部位在间脑,此后在脑组织广泛区域均有表达。提示TRH除对垂体有促进作用之外,对其他脑区可能发挥神经调质的作用。
TRH作为下丘脑-垂体-甲状腺(hypothalamus-pituitary-thyroid,HPT)轴的关键神经信息分子[8-9],能够促进垂体前叶释放促甲状腺激素(TSH),而TSH可促使甲状腺泡释放甲状腺激素(THs),从而加强机体的基础代谢。有报道,促甲状腺激素释放激素具有广泛的生物学功能,能够促进生长激素的分泌,进而促进肌肉的生长以及长骨的生长[10]。张晓娜等[11]也证实了鱼类甲状腺激素对鱼类胚胎发育、仔鱼的变态发育、提高存活率和促进生长等方面均有作用。青海湖裸鲤在高盐碱,寒冷的生境中得以生存、生长和繁殖,TRH发挥着极其重要的调节作用,该基因在裸鲤胚胎期就得以表达,这更有力地验证了这一推测。另外,TRH基因在裸鲤中枢神经系统具有时空特异性表达的特点,表明该基因是可作为中枢神经发育的分子标记物,对进一步研究该基因在裸鲤发育生物学的特殊作用具有重要意义。青海湖裸鲤与其他鲤科鱼类TRH同源性比较得出,TRH蛋白具有一定的保守性。从进化的角度看,青海湖裸鲤的TRH基因突变的程度相对较低,是否存着另外特殊的作用,有待进一步研究。此外,利用RISPR/Cas9技术对青海湖裸鲤TRH基因进行编辑[12],来进一步验证该基因对裸鲤生物学功能影响将是我们未来的研究方向。
