信号调节蛋白α在足细胞损伤中的作用
2019-12-31夏园园综述曾彩虹审校
袁 蓓 夏园园 综述 曾彩虹 审校
足细胞是肾小球中的一种终末分化上皮细胞,相邻足细胞间足突相交错形成特殊的细胞间连接称为裂孔隔膜,并与基膜、毛细血管内皮细胞构成了肾小球滤过屏障。研究发现,免疫、感染、药物、代谢及遗传等多种因素均能直接或间接引起足细胞损伤或丢失,导致肾小球滤过屏障结构和功能异常,并进一步产生蛋白尿、肾小球硬化及肾功能恶化[1-4]。所以裂孔隔膜上分子的稳定对维持足细胞正常形态及肾小球滤过功能具有重要意义。信号调节蛋白α(SIRPα)是一种近期新发现在足细胞裂孔隔膜上表达的跨膜蛋白,正常状态下被高度磷酸化后转导胞内信号并维持足细胞高自噬活性,其改变及磷酸化水平改变可能会参与并介导足细胞损伤[1]。
足细胞
足细胞是肾小球中的一种终末分化的上皮细胞,具有分支状的足突并通过α3β1整合素锚定于肾小球基膜上,包绕于肾小球毛细血管外侧[1-4]。在正常足细胞的足突内,具有高度有序、平行收缩的肌动蛋白纤维束,以维持细胞骨架及细胞结构[5-6]。相邻足细胞间足突相互交错,形成一种特殊的细胞间连接,即裂孔隔膜[7]。裂孔隔膜主要是由足突的跨膜蛋白nephrin、NEPH1等分子相交错构成拉链状蛋白质三维结构,通过nephrin等复合物锚定于足细胞肌动蛋白骨架上[8]。
裂孔隔膜构成主要的肾小球滤过屏障,允许水及小分子物质从毛细血管腔滤过形成原尿,并限制了大分子物质如白蛋白的滤过[3]。裂孔隔膜上分子的缺失或突变会导致蛋白尿的发生。并且裂孔隔膜还可以作为信号转导平台,通过裂孔隔膜上蛋白质胞质内区域酪氨酸残基的磷酸化,传递胞外刺激信号进入胞内,以调节足细胞的形态及功能[9-10]。如nephrin的酪氨酸磷酸化可以调节钙离子信号、肌动蛋白细胞骨架重塑、PI3 激酶/Akt信号通路的活化等胞内信号通路[11-13]。
在多种形式的肾小球疾病中,均有足细胞形态及功能的改变,并在疾病发生发展起关键作用,主要表现为肌动蛋白细胞骨架重塑、足突融合或消失、裂孔隔膜的缺失以及足细胞密度及数量减少,导致临床蛋白尿的发生及肾功能损害[3,6]。近期有研究发现在不同肾小球疾病中,还伴有裂孔隔膜分子磷酸化水平的不同程度改变,例如在糖尿病肾病中,nephrin酪氨酸残基Y1174、Y1193、Y1217磷酸化水平下调,足突消失[13-14];而在膜性肾病及微小病变性肾病中,出现相反的Y1217磷酸化水平上升,足突融合[14]。说明当足细胞损伤时有裂孔隔膜蛋白质的磷酸化水平的改变,裂孔隔膜上蛋白质磷酸化水平的稳定对足细胞结构及功能的维持也具有重要意义。
正常足细胞维持着高水平的自噬活性,并且在肾小球疾病和衰老过程中,自噬在足细胞稳态中起着至关重要的作用[15-16]。Zeng等[16]通过追踪重复肾活检的微小病变(MCD)患者的足细胞自噬活性,发现维持足细胞高自噬活性的患者保留了MCD状态,而足细胞自噬活性下降的患者进展为局灶节段性肾小球硬化(FSGS),说明了足细胞自噬活性在肾损伤情况下起着重要的保护作用。
SIRPα蛋白
SIRPα的基本结构SIRPα是一种来自SIRP家族,主要由髓系细胞和巨噬细胞、神经元等表达的跨膜蛋白[17]。多项研究发现在人、小鼠及大鼠的足细胞中也有SIRPα的表达[1,9-10,18]。
SIRPα的结构包括胞外区域、跨膜区域及胞浆内区域。其中胞外区域有3个免疫球蛋白样结构域,胞浆内区域有4个酪氨酸残基并构成免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-Based inhibitory motif,ITIM),发挥SIRPα主要作为抑制性受体的作用[1,17]。当配体与SIRPα结合时,SIRPα的酪氨酸残基被磷酸化,通过ITIM可以招募并活化含有Src同源区2(Src Homology 2,SH2)的酪氨酸磷酸酶,如SHP-1 或SHP-2,进一步向细胞内传递抑制性信号[12,17]。
SIRPα的主要生理作用SIRPα作为一种免疫抑制性受体,可以与CD47、肺表面活性蛋白SP-A和SP-D等多种配体结合,向胞内主要传递抑制性信号,在不同系统发挥不同的生理作用[10,12,19](图1)。
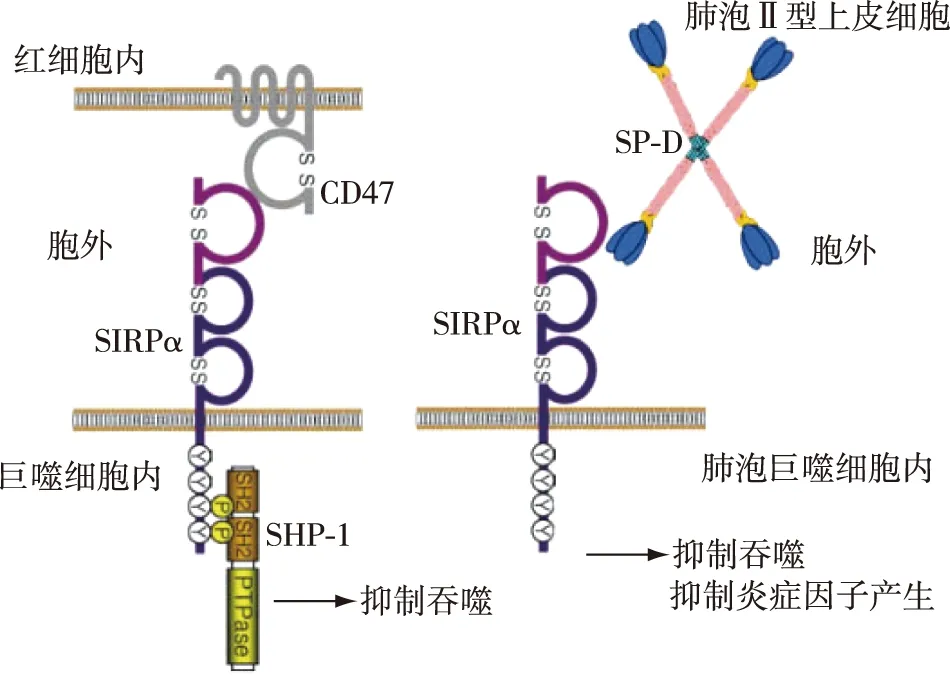
图1 信号调节蛋白α(SIRPα)与其配体间的作用红细胞表面的CD47与巨噬细胞表面的SIRPα结合,导致SIRPα磷酸化并招募SHP-1到巨噬细胞胞膜,产生抑制巨噬细胞吞噬红细胞的信号;肺泡Ⅱ型上皮细胞的肺表面活性蛋白SP-D与肺泡巨噬细胞表面的SIRPα结合后,产生抑制吞噬,抑制炎症因子产生成下游信号
抑制吞噬 SIRPα抑制吞噬的作用主要是通过与细胞表面广泛表达的跨膜蛋白CD47结合,招募下游分子SHP-1所产生的[17]。如在造血系统,红细胞表面的CD47与巨噬细胞表面的SIRPα结合,导致SIRPα磷酸化,磷酸化后招募SHP-1到巨噬细胞胞膜并与之结合,使巨噬细胞产生“don’t eat me”的下游信号,通过抑制非肌性肌球蛋白IIA等的功能从而抑制其吞噬红细胞[12,17,20]。在细胞在凋亡或被感染时,CD47表达下调以促进巨噬细胞对其的吞噬[19]。但是在急性髓系白血病等恶性血液病的肿瘤细胞中,CD47出现过表达,以达到肿瘤免疫逃逸目的[21]。也有研究指出在呼吸系统,配体SP-A和SP-D与SIRPα结合后可以抑制肺泡巨噬细胞的吞噬[22]。
抑制炎症因子产生 Jiaravuthisan等[23]运用表达SIRPα的人单核细胞样细胞(THP-1)与存在CL-SP-D杂合蛋白的猪内皮细胞(SEC)进行共培养发现,肺表面活性蛋白SP-D与SIRPα结合后,抑炎因子IL-10的产生增多而促炎因子IL-1β减少,从而减轻吞噬细胞受到脂多糖刺激后所介导的异基因细胞毒性反应。Yamaguchi等[24]也发现SP-D与SIRPα的相互结合后IL-12p40的产生减少,并且这种抑炎作用可能是通过SIRPα 下游的Rho相关卷曲螺旋形成蛋白激酶(ROCK)、胞外信号调节激酶(ERK)信号通路所介导的。目前运用重组SP-D对新生儿哮喘,囊性纤维化,肺气肿等疾病进行治疗的项目已进入临床试验[24]。
调节细胞增殖及迁移 有研究证实,SIRPα可以通过SHP-2及下游的ROCK促进皮肤的树突状细胞迁移至淋巴管以诱导皮肤免疫反应,运用针对SIRPα的抗体以及ROCK抑制剂都可以抑制细胞的迁移[25]。在多种癌细胞中,SIRPα却可以促进细胞凋亡,负性调节细胞增殖,发挥抑癌作用,这可能是通过p38丝裂原活化蛋白激酶(MAPK)/NF-κB所介导的[26]。但是SIRPα作为上游分子调节细胞增殖及迁移时,其磷酸化水平的改变及胞外刺激信号尚待进一步研究。
SIRPα在足细胞的表达及作用
SIRPα主要存在于足细胞裂孔隔膜 Kurihara等[9]运用双重免疫荧光技术发现在大鼠中SIRPα与紧密连接蛋白1(zonula occludens 1,ZO-1)有共定位,ZO-1是一种主要定位于足细胞足突并聚集于裂孔隔膜的蛋白质,说明SIRPα主要存在于足细胞裂孔隔膜,其存在对维持裂孔隔膜完整性很重要。并且Kajiho等[10]运用一种可以识别SIRPα特定磷酸化位点Y501的多克隆抗体(anti-pY501)进行蛋白质免疫印迹实验发现,在正常大鼠肾小球中,SIRPα也被高度磷酸化。Takahashi等[1]通过免疫共沉淀发现了高度磷酸化的SIRPα活化并招募SHP-2。但触发SIRPα被持续磷酸化的调节因子尚不清楚。
SIRPα调控足细胞自噬水平 正常足细胞维持着高水平的自噬活性,当自噬活性下降,受损的细胞结构不能清除时,会导致足细胞内胞质蛋白聚集物的逐渐积累、线粒体缺陷和脂褐素的聚集[15]。Li等[27]发现,6个月龄的SIRPα敲除小鼠的足细胞内脂褐素聚集、微绒毛形成;20个月龄的SIRPα敲除小鼠的足细胞内大量粗面内质网膨胀、线粒体受损。而这均与足细胞自噬水平降低的表现相吻合。进一步的基础研究证实,SIRPα通过降低Akt的磷酸化水平并进一步抑制Akt/GSK-3β/β-catenin信号通路,从而促进足细胞自噬。
SIRPα与nephrin存在相互作用 Kajiho等[10]发现SIRPα与nephrin存在免疫共沉淀,提出SIRP在体内可能与nephrin形成复合物并相互作用。并且在体外实验中,磷酸化的SIRPα会降低nephrin的磷酸化水平。表明在正常足细胞中,SIRPα被高度磷酸化,通过与SHP-2的结合可能抑制了足细胞内其他分子的磷酸化,进一步抑制了其他分子所介导的细胞骨架重塑等信号通路,但是SIRPα结合SHP-2后转导的具体胞内信号通路及其作用机制,还有待进一步研究。
Kurihara等[9]发现在肾小球中CD47与SIRPα也有一定的相互作用:CD47主要在系膜细胞表面表达,当系膜细胞受损时,CD47被释放并通过裂孔隔膜与SIRPα相连,使SIRPα发生去磷酸化,并释放磷酸基团与SHP-2,进一步向足细胞内传递损伤刺激信号。
SIRPα蛋白与足细胞损伤
Li等[27]发现,在FSGS患者及阿霉素小鼠、嘌呤霉素小鼠、链脲霉素小鼠等肾小球疾病模型中,SIRPα的表达水平较正常对照组均降低,并且SIRPα表达水平与肾小球病变程度呈负相关。为了进一步验证SIRPα存在的作用及意义,Li等[27]构建了SIRPα全身敲除小鼠,发现SIRPα敲除小鼠足细胞自噬水平降低,表现出了年龄依赖性的蛋白尿、足细胞损伤及肾小球硬化。并且在20个月时,有超过60%的SIRPα敲除小鼠出现>300 mg/L的蛋白尿。而过表达SIRPα,则会通过提高足细胞自噬水平,逆转嘌呤霉素所致的蛋白尿及肾损伤。所以,SIRPα可以通过维持足细胞高自噬水平以及维持裂孔隔膜的完整性,对足细胞形态及功能具有保护作用,但是在FSGS等肾小球疾病中SIRPα表达降低的机制有待进一步的研究,可能是依赖转录后调节[27]。
Kajiho等[10]在大鼠中运用硫酸鱼精蛋白(protamine sulfate,PS)灌注使足突融合产生蛋白尿,发现SIRPα表达量无明显变化而磷酸化水平呈进行性下降,nephrin Y1191,Y1208位点的磷酸化水平升高。表明PS灌注产生蛋白尿时,SIRPα发生了去磷酸化并释放SHP-2,通过释放SHP-2改变了足细胞内其他分子的磷酸化水平,进一步改变胞内信号,以介导足细胞损伤,但是其具体相互作用机制还有待阐释。Takahashi等[1]曾采用一种SIRPα突变小鼠使得小鼠足细胞SIRPα胞质内区域缺乏,SIRPα无法被磷酸化。经研究发现SIRPα磷酸化水平下降,小鼠出现不同程度的蛋白尿及肾功能下降,电镜下足突出现节段或广泛融合,说明足细胞中的SIRPα磷酸化对维持足细胞正常形态及功能具有一定的作用,但是SIRPα发生去磷酸化的具体刺激因素有待研究。
Kajiho等[10]研究发现,在IgA肾病及Alport综合征患者的肾小球中,SIRPα的表达水平与正常对照组无明显差异。在先天性肾病综合征患者的肾小球中,几乎没有SIRPα的表达,但是SIRPα缺失的机制及意义尚不清楚。
小结:SIRPα是一种存在于足细胞裂孔隔膜上的跨膜蛋白,正常状态时被高度磷酸化后招募SHP-2,传递胞内信号,维持足突内其他分子磷酸化水平的稳定并维持足细胞高自噬水平及正常形态功能。当足细胞受到损伤刺激时,SIRPα表达降低导致足细胞自噬水平降低裂孔隔膜完整性被破坏;或发生去磷酸化并释放SHP-2,使足细胞内其他分子磷酸化水平上升并传递胞内下游信号,导致足细胞损伤、足突融合及蛋白尿发生,这使得SIRPα信号通路有望成为足细胞损伤时的治疗新靶点。
