腹膜透析早期技术失败的危险因素和处理
2019-12-31张志宏综述俞雨生审校
张志宏 综述 俞雨生 审校
腹膜透析(PD)是终末期肾病(ESRD)患者血液净化治疗的重要方式之一。PD技术失败是评价PD质量的关键指标之一,也是影响患者预后的重要因素[1]。既往研究显示,PD技术失败的原因及危险因素众多,呈现鲜明的时空特色[2-3]。相对而言,PD早期技术失败的临床意义和研究价值更加突出。本文综述现阶段对PD早期技术失败的认识,介绍其定义、发生率、原因分类、危险因素和处理策略。
早期技术失败的定义
完整定义PD早期技术失败应包含三方面内容,即PD技术失败内涵、出现时间与持续时长。迄今,有关PD早期技术失败定义尚无公认标准,在临床实践中往往报告1年期PD技术生存率,故而可以将PD治疗第1年(或更短时间)内终止,并转入血液透析(HD)至少30d归入早期技术失败,将死亡与肾移植归入PD技术失败的竞争事件(competing events)。有关PD早期技术失败的不同定义详见表1[4-9]。事实上,上述定义的模糊在一定程度上反映了当前各地区PD技术应用与发展的不均衡现状,也制约了该领域开展高质量随机对照临床研究,亟待推动所谓“预后标准化评估”[10]。
早期技术失败发生率
PD早期技术失败的发生率依不同定义而差别迥异。韩国PD健康保险审查和评估服务数据库(HIRA)显示PD治疗第1年内技术失败发生率为4.9%[8]。法语地区腹膜透析注册研究(RDPLF)队列PD治疗6个月内转入HD的比例为6.3%[5];澳洲透析与肾移植注册队列研究(ANZDATA)发现PD治疗第1年内转入HD的比例高达17.8%[11]。Cho等[12]荟萃分析了分别来自加拿大、瑞士、美国与荷兰等地区的7项大型队列研究,统计的PD第1年技术失败发生率波动于12.7%~24.8%。
我国拥有的PD患者数量居世界第一位,截至2016年底,估计约有6.2万例PD患者[13]。总体而言,我国腹膜透析质量仍不尽人意。2015年中国国家肾脏病网络调查(China Kidney Disease Network,CK-NET)报告显示[14],仅33.9%的PD患者能够定期就诊与更换透析组件。此外,我国不同地区间PD技术失败发生率仍存在较大差异。华南地区报告的PD治疗第1年技术失败发生率约2%[15];而同期四川地区报告的PD患者第1年掉队率为28%,累积5年PD技术失败发生率为24.5%[16]。
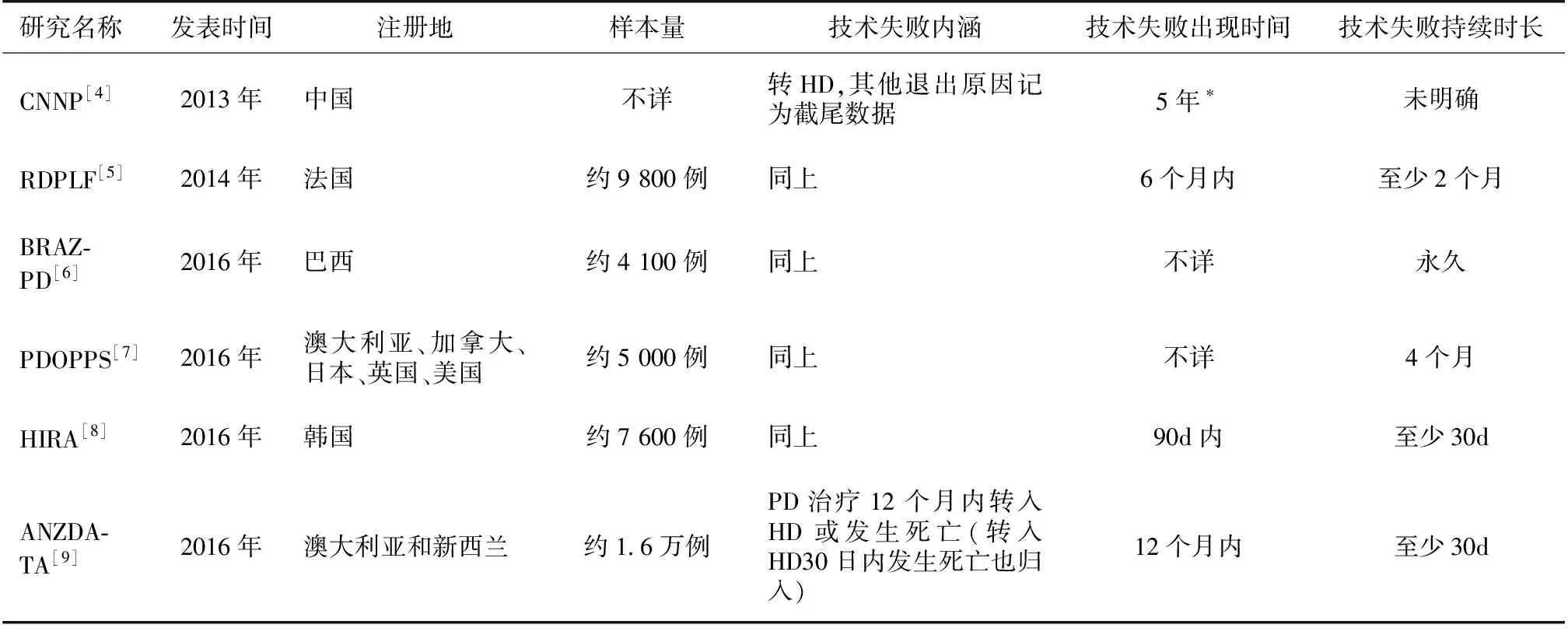
表1 PD早期失败的不同定义标准
CNNP:中国北方腹膜透析协作组;RDPLF:法语地区腹膜透析注册研究;BRAZPD:巴西腹膜透析患者注册研究;PDOPPS:腹膜透析预后与实践模式研究;HIRA:韩国健康保险审查和评估服务数据库;ANZDATA:澳洲透析与肾移植注册队列研究;PD:腹膜透析;HD:血液透析;*:原文为专家共识暂定5年,供参考
早期技术失败的原因
对于PD技术失败的原因,既往研究进行了分类与总结。巴西腹膜透析患者注册研究(BRAZPD)归纳出10项原因[6],前述RDPLF研究则报告了19项原因[5]。ANZDATA研究者将PD技术失败的原因分为7大类[9],即:(1)感染;(2)机械因素;(3)透析不充分;(4)社会因素;(5)包裹性腹膜硬化(EPS);(6)死亡;(7)其他原因。腹膜透析预后与实践模式研究(PDOPPS)是一项多国多中心合作的PD治疗真实世界观察性研究[7]。PDOPPS研究者认为,比较不同区域或中心之间腹膜透析质量,PD技术失败的原因应尽可能标准化,有必要进行亚类分组。他们对PD技术失败的原因采取多层次方式分类(Multi-Level Approach),即首层-亚层-第三层分类法。有关ANZDATA研究与PDOPPS研究对PD技术失败的原因分类详见表2与表3。PD早期技术失败的前三位原因,RDPLF研究显示分别为PD导管功能障碍、社会心理因素以及PD相关其他因素[5];而ANZDATA研究报告则分别为死亡、感染及其他[9,11]。
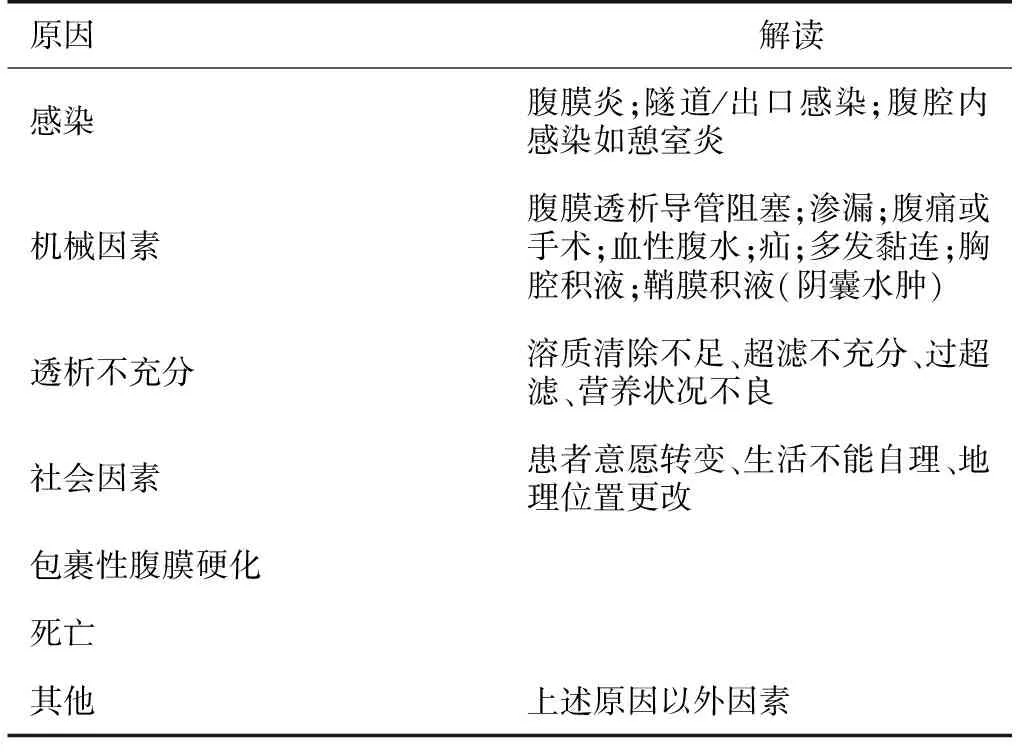
表2 澳洲透析与肾移植注册队列研究研究关于腹膜透析技术失败的原因分类[9]
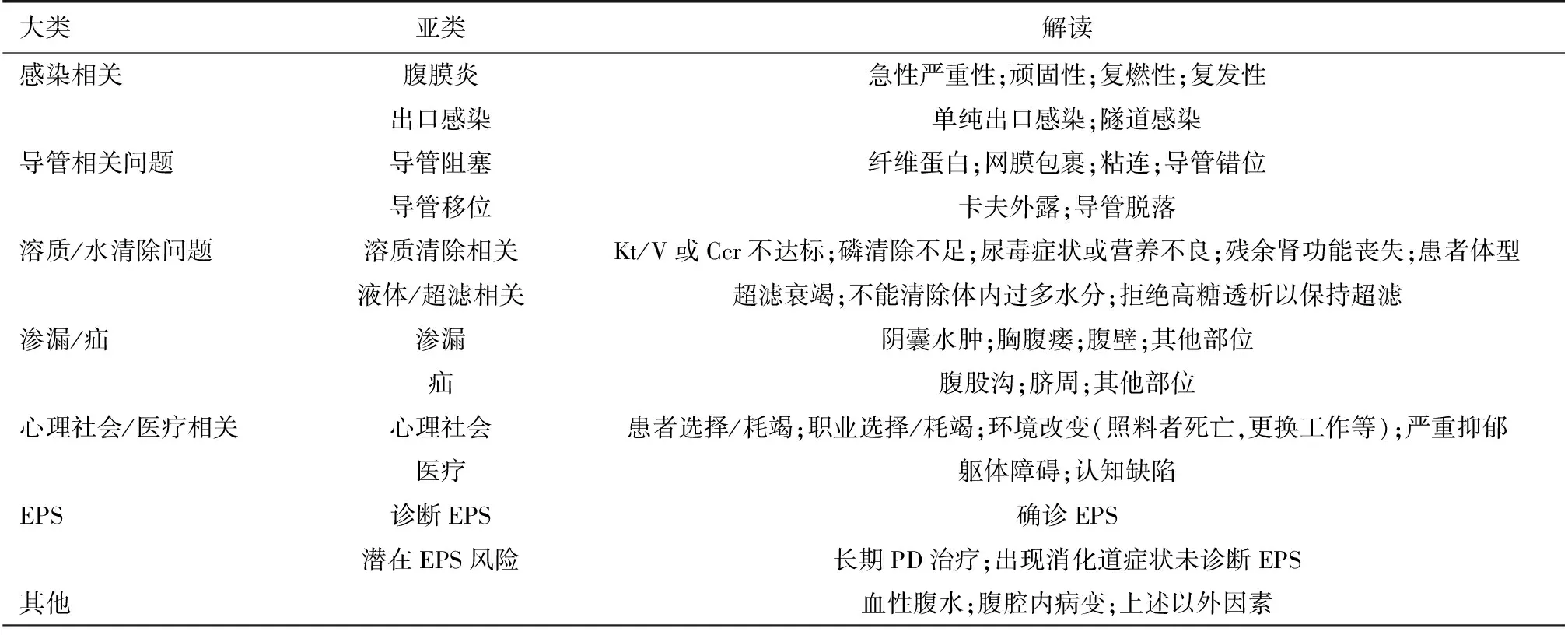
表3 PD预后与实践模式研究研究关于PD技术失败原因的多层次分类[7]
Kt/V:尿素清除指数;Ccr:肌酐清除率;EPS:包裹性腹膜硬化;PD:腹膜透析
早期技术失败的危险因素
PD治疗第1年是患者由ESRD向维持性PD转换阶段,患者身心状况是触发PD早期技术失败的主要危险因素。
年龄ANZDATA研究采用竞争风险回归模型显示,患者年龄>70岁是PD早期技术失败的独立危险因素,相对风险较≤50岁患者升高43%(30%~56%)[11]。但RDPLF研究显示,患者高龄仅是患者全因死亡的独立危险因素[HR(95%CI):1.06(1.06~1.07)],与转入HD风险呈临界相关关系[HR(95%CI):0.99(0.99~1.00)][5]。HIRA研究亦得出类似结论[HR(95%CI):1.00(1.00~1.01)][8]。新近,意大利老年肾脏病研究组织(Study Group on Geriatric Nephrology of the Italian Society of Nephrology,SIN)的报告也显示,<65岁组与≥65岁组患者随访近5年的PD技术生存率比较无统计学差异(77.2%vs72.4%,P=0.54)[17]。分析年龄对于PD早期技术失败的影响,我们认为上述研究结论的差异主要源自是否将死亡定义为竞争事件。ANZDATA研究定义PD早期技术失败包含死亡结局,而其他研究仅统计转入HD事件。此外,RDPLF研究与HIRA研究仅统计PD治疗6个月与3个月内的临床事件,较ANZDATA研究1年时限明显缩短,由此可能造成阳性事件出现不足,影响统计学差异性。
营养状况、机能状态以及合并症ANZDATA研究指出消瘦(BMI<18.5 kg/m2)、合并糖尿病与缺血性心脑血管疾病或外周动脉病变均是PD早期技术失败的独立危险因素[11]。血清白蛋白水平被认为是评估患者营养状况的良好指标。近期发表的我国台湾地区的一项前瞻性队列研究,共纳入514例PD患者,随访12年,采用竞争风险模型发现基线血清白蛋白水平是PD技术失败的独立危险因素[Alb≥36 g/L,HR(95%CI):0.75(0.58,0.96)][18]。类似的,安徽地区的一项回顾性队列研究也发现,基线血清白蛋白水平低显著升高PD技术失败风险[Alb<36 g/L,HR(95%CI):3.148(1.603,6.182)][19]。来自伊朗的一项回顾性队列研究,采用贝叶斯联合建模(Bayesian joint modeling)发现PD患者血清白蛋白的动态轨迹与转入HD风险呈现负性相关关系,即血清白蛋白动态下降预示转入HD风险升高;该规律对于糖尿病与非糖尿病PD患者均成立,相关系数分别为-0.720(-0.971,-0.472)与-0.784(-0.963,-0.587)[20]。
残余肾功能利用美国肾脏病注册系统(US Renal Data System,USRDS)2007~2010年资料,Weinhandl等[21]发现新入PD治疗患者术后技术失败发生率6个月与12个月分别为17.3%与27.1%(删失死亡事件),其中进入ESRD短于6个月(间接提示残余肾功能较好)的患者PD早期技术失败率较低,6个月与12个月分别为11.1%与19.1%[21]。前述RDPLF研究也指出PD治疗前接受HD治疗(提示残余肾功能低下)或移植肾失功的患者均是PD早期技术失败的高危人群[5]。
容量负荷应用生物电阻抗技术测量发现PD患者发生容量负荷过重的比例高达53.4%~72.1%[22]。新近发表的一项荟萃分析显示容量负荷过重(即细胞外水与总体水含量比例)显著增加PD患者的全因死亡风险[OR(95%CI):2.19(1.59,3.00)]及技术失败风险[OR(95%CI):6.20(4.96,7.74)][23]。值得注意的是,糖尿病患者的容量负荷问题更加突出。UdoA等[24]的研究表明,新入PD治疗的糖尿病患者,即使体重、残余肾功能和腹膜平衡试验结果与非糖尿病患者无明显差异,其细胞外容量负荷也远远高于后者[9.6%(6.3%~12.3%)vs4.9%(0.7%~8.9%)]。
教育程度韩国一项前瞻性队列研究纳入655例新入PD患者,平均年龄48.4岁,中位随访41月;使用Cox比例风险模型,校正其他因素后发现,受教育程度为初级中学以下是PD技术失败的独立危险因素[HR(95%CI):1.87(1.10,3.18)][25]。
降低早期技术失败风险的措施
PD适应证筛选既往研究已显示ESRD患者的营养状况、机能状态、合并症、残余肾功能、容量负荷状况以及受教育程度均显著影响PD技术存活。因而,选择合适的评价指标建立PD适应征纳入门槛是降低PD早期技术失败风险的有效应对措施。需要指出的是,现有研究认为患者年龄和性别对于PD技术存活影响有限。
置管技术PD置管技术除传统开放手术与腹腔镜手术外,微创的经皮穿刺置管术近年来发展迅速。对PD置管方式与预后的关系已有评述[26],即三种置管技术在PD技术存活方面比较均无显著差异。但PD导管本身可能影响PD技术存活。本中心对820例患者分别置入Tenckhoff卷曲管、swan-neck卷曲管和swan-neck直管,均由同一术者采用开放手术置入,术后1月内导管移位发生率分别为5.2%、15.1%和1.9%(P=0.001)。选择swan-neck直管术后移位较少可能与其固有U型塑形减少外力传导至腹内段有关,同时其腹内段长度适中,不易折曲[27]。
紧急置管紧急PD(Urgent-start PD)是指针对CKD晚期患者出现严重氮质血症或容量超负荷,实施紧急腹膜透析管置入术,并于术后48或72h内开始的PD治疗。新近发表的一项Meta分析纳入6项观察性研究,共1 241例PD患者,荟萃分析显示紧急开始PD较传统PD确有增加渗漏风险[OR(95%CI):6.72(2.11,21.32)],但在患者全因死亡、腹膜炎及整体机械并发症方面均无显著差异[28]。
治疗模式与透析液选择ANZDATA研究认为使用自动化腹膜透析(APD)是PD早期技术失败的独立危险因素[11]。但RDPLF研究指出PD治疗模式与PD早期技术失败无显著相关性[5]。传统PD液为非生理性溶液。BRAZPD研究将2 592例PD患者依照PD液葡萄糖暴露水平进行四分位分组,校正其他因素后发现,PD液葡萄糖含量较高是患者1年内发生PD技术失败的独立危险因素,相对风险比分别为1.41、1.86和1.63[29]。生物相容性PD液包括低葡萄糖降解产物(GDP)中性PD液和艾考糊精PD液(icodextrin)。2018年发表的一项荟萃分析显示,尽管生物相容性PD液较传统PD液具有减缓残余肾功能减退的价值,但现有的临床证据不支持其对于患者生存或PD技术失败硬终点的影响[30]。
腹膜炎后遗影响PD相关腹膜炎可直接导致患者死亡,腹膜炎也是ANZDATA研究与PDOPPS研究定义PD技术失败的直接原因之一。有研究指出,PD治疗1年内发生的腹膜炎直接导致PD技术失败发生率高达16.4%[31]。新近澳大利亚的一项小型观察性研究发现,腹膜炎也可作为危险因素,影响感染后1年的PD技术存活。该研究随访了27例发生腹膜炎的PD患者预后,前三位感染病原体为凝固酶阴性葡萄球菌、金黄色葡萄球菌和革兰阴性杆菌。在腹膜炎发作后第12月末有10例患者转入HD,5例死亡;剩余患者每日总超滤量亦下降显著(1 101±160 mlvs感染前1 624±139 ml,P=0.02);但溶质清除指标如Kt/V、Ccr及血清白蛋白水平均无显著改变[32]。
中心一体化管理本中心2011年统计数据显示PD治疗第1年技术失败发生率为13%(删失死亡事件)[33];经过创建门诊-病房-腹透室一体化管理模式,将PD患者管理实现全链条化无缝衔接,建立专职医师与护理团队,依据病情进行分层随访,开展持续质量改进;至2014年统计显示PD治疗第1年技术失败发生率已降至4.4%[34]。RDPLF研究与ANZDATA研究亦指出,PD中心规模较小(年PD置管<10例次)是PD早期技术失败的独立危险因素[5,11]。
小结:迄今为止,PD早期技术失败的定义及其原因分类仍未达成共识,有待临床研究尽快实现“标准化”。患者营养状况、机能状态、合并症、残余肾功能、容量负荷状况以及受教育程度均是PD早期技术失败的危险因素;完善患者纳入评价体系是降低PD早期技术失败的首要措施;此外,PD治疗导管的选择、避免紧急开始PD、减少高渗腹透液使用以及腹膜炎防控均有助于改善PD技术存活;而专病一体化管理模式与持续质量改进也是降低PD早期技术失败的有效措施。
