ARA290抑制糖尿病大鼠肾脏氧化应激反应
2019-12-31党建中涂亚芳杨英杰
党建中 涂亚芳 王 娟 杨英杰
糖尿病肾脏病(Diabetic kidney disease,DKD)是糖尿病常见的微血管并发症,目前临床尚无特效治疗方法,所以研究者们一直在寻求DKD新的治疗靶点。研究发现糖尿病患者机体氧化应激水平显著增高,通过抗氧化应激治疗可抑制糖尿病神经病变、心脏病、肾脏病等糖尿病并发症的发生发展[1-3]。促红细胞生成素(EPO)因其刺激红细胞生成作用,临床上广泛应用于肾性贫血和肿瘤化疗相关贫血的治疗。然而,最近在一些非红系细胞中也发现了EPO受体(EPOR)的表达,例如施旺细胞、心肌细胞、血管内皮细胞,且给予外源性EPO可以对上述细胞发挥保护作用[4-6]。既往研究多认为EPO主要通过抗细胞凋亡机制来发挥非血液学组织保护作用,但近来有观点认为单独的抗凋亡效应不能完全解释EPO的非血液学组织保护效应[7]。已有研究证实EPO及其衍生物可通过改善机体氧化应激状态发挥组织保护作用,EPO及其衍生物的抗氧化应激作用逐步受到关注[7]。一些临床研究还发现EPO治疗可降低透析患者血浆氧化应激水平[8-9],但EPO及其衍生物能否抑制DKD时肾脏的氧化应激反应发挥肾脏保护作用目前还不清楚。本研究通过链脲菌素腹腔注射诱导糖尿病大鼠模型,观察糖尿病大鼠肾脏氧化应激及肾脏病变情况,探究EPO衍生肽ARA290能否抑制糖尿病大鼠肾脏氧化应激及肾脏损伤。
材料与方法
实验材料
实验动物 选择7~8周龄,体重180~200g,SPF级健康SD雄性大鼠进行研究,实验动物由湖北省实验研究动物中心提供[合格证号scxk(鄂)2015-0018]。
主要试剂 ARA290(美国CSNpharm),EPOR、CD131、β-actin抗体(美国Santa Cruz),丙二醛(MDA)抗体(武汉艾美捷),8-羟基脱氧鸟苷(8-OHdG)抗体(美国Abbiotec),尿白蛋白ELISA 检测试剂盒(武汉贝茵莱),尿肌酐ELISA 检测试剂盒(武汉贝茵莱),活性氧(ROS) ELISA 检测试剂盒(上海江莱)。
实验方法
动物模型制备及分组 24只SD大鼠适应性饲养1周,随机选择18只禁食后,一次性腹腔注射60 mg/kg链脲菌素制备糖尿病大鼠模型。72h后断尾采血测空腹血糖,血糖≥16.7 mmol/L为糖尿病大鼠成功模型。将18只造模成功的糖尿病大鼠随机分为糖尿病模型组(DM组)6只:皮下注射生理盐水0.5 ml,隔日1次;糖尿病模型+ARA290 50 U/kg治疗组(DA1组)6只:皮下注射ARA290,50 U/kg,隔日1次;糖尿病模型+ARA290 100 U/kg治疗组(DA2组)6只:皮下注射ARA290,100 U/kg,隔日1次。同时设立正常对照组(NC组)6只,皮下注射生理盐水0.5 ml,隔日1次。高盐高脂饮食饲养12周处死大鼠,心脏取血收集血标本,肾组织用4%多聚甲醛固定,石蜡包埋,切片行PAS、免疫荧光及免疫组化检测,部分肾组织保存于-70℃冰箱,待行Western印迹不相关检测。
一般指标检测 根据试剂盒说明采用ELISA法检测大鼠尿白蛋白和肌酐,计算尿白蛋白/尿肌酐(ACR)。尿β2微球蛋白(β2-MG)、血糖采用全自动生化检测,红细胞比容(Hct)采用自动化血液分析仪检测,尾套法测定大鼠尾动脉收缩压。
病理学观察 肾组织石蜡切片行常规PAS染色,普通光学显微镜观察肾脏病理变化。每张切片随机取20个正切的肾小球,系膜区面积占肾小球毛细血管丛面积的百分比用Image-pro plus 6.0软件分析计算。
ROS检测 肾组织冰上研磨制成组织匀浆,离心后取上清,根据试剂盒说明采用ELISA法检测大鼠肾脏ROS水平。
免疫荧光 石蜡切片常规脱蜡,微波修复,滴加EPOR、CD131抗体,4℃过夜。翌日滴加 FITC标记的二抗,荧光显微镜观察摄像,Image-pro plus 6.0软件进行半定量分析,以平均吸光度表示阳性物质的相对含量。
免疫组化 石蜡切片常规脱蜡,微波修复,滴加MDA、8-OHdG抗体,4℃过夜。翌日滴加二抗,DAB显色,苏木素复染,封片镜检。MDA和8-OHdG阳性细胞呈棕黄色,用Image-pro plus 6.0软件进行半定量分析,以平均吸光度表示阳性物质的相对含量。
实时定量PCR(RT-PCR) 用TRIzol法提取肾脏总RNA,反转录合成cDNA,进行RT-PCR检测。NOX4引物:上游5′- T ̄G ̄T ̄A ̄A ̄C ̄A ̄G ̄A ̄G ̄G ̄G ̄A ̄A ̄A ̄A ̄C ̄A ̄G ̄T ̄T ̄G ̄G ̄A-3′,下游5′-G ̄T ̄T ̄C ̄C ̄G ̄G ̄T ̄T ̄A ̄C ̄T ̄C ̄A ̄A ̄A ̄C ̄T ̄A ̄T ̄G ̄A ̄A ̄G ̄A ̄G-3′;β-actin引物:上游5′-A ̄G ̄C ̄C ̄A ̄T ̄G ̄T ̄A ̄C ̄G ̄T ̄A ̄G ̄C ̄C ̄A ̄T ̄C ̄C-3′,下游5′-T ̄C ̄T ̄C ̄A ̄G ̄C ̄T ̄G ̄T ̄G ̄G ̄T ̄G ̄G ̄T ̄G ̄A ̄A ̄G-3′。实验数据采用2-△△CT法进行分析。
Western印迹 提取肾组织总蛋白,取50 μg总蛋白经10%SDS-PAGE凝胶电泳后,转移至PVDF膜,然后加入NOX4、β-actin抗体进行杂交过夜。翌日滴加HRP标记的二抗杂交,曝光成像后用Gel-Pro图像分析系统分析吸光度。
免疫共沉淀 用IP裂解液裂解肾组织,收取上清蛋白。蛋白质中加入30 μl琼脂糖蛋白A+G预处理,消除非特异性结合。然后去除Agarose protein A+G,加Co-IP抗CD131 抗体到500 μl总蛋白中,与目标蛋白反应,4℃过夜。翌日加30 μl琼脂糖蛋白A+G 4℃缓慢摇动3h,离心后弃上清,溶于适量SDS-PAGE蛋白上样缓冲液中,用于后续Western印迹检测。
统计学处理应用《SPSS 22.0》进行统计分析。计量资料数据用均数±标准差表示,两组间均数比较采用t检验,P<0.05视为差异有统计学意义。
结 果
ARA290对糖尿病大鼠尿ACR、β2-MG及Hct、血压、血糖的影响与NC组相比,DM组尿ACR、β2-MG显著增高。与DM组相比,ARA290治疗组尿ACR、β2-MG降低,且高剂量ARA290治疗组尿ACR、β2-MG下降更明显。DM组及不同剂量ARA290治疗组Hct、尾动脉收缩压、血糖均无显著差异 (图1)。
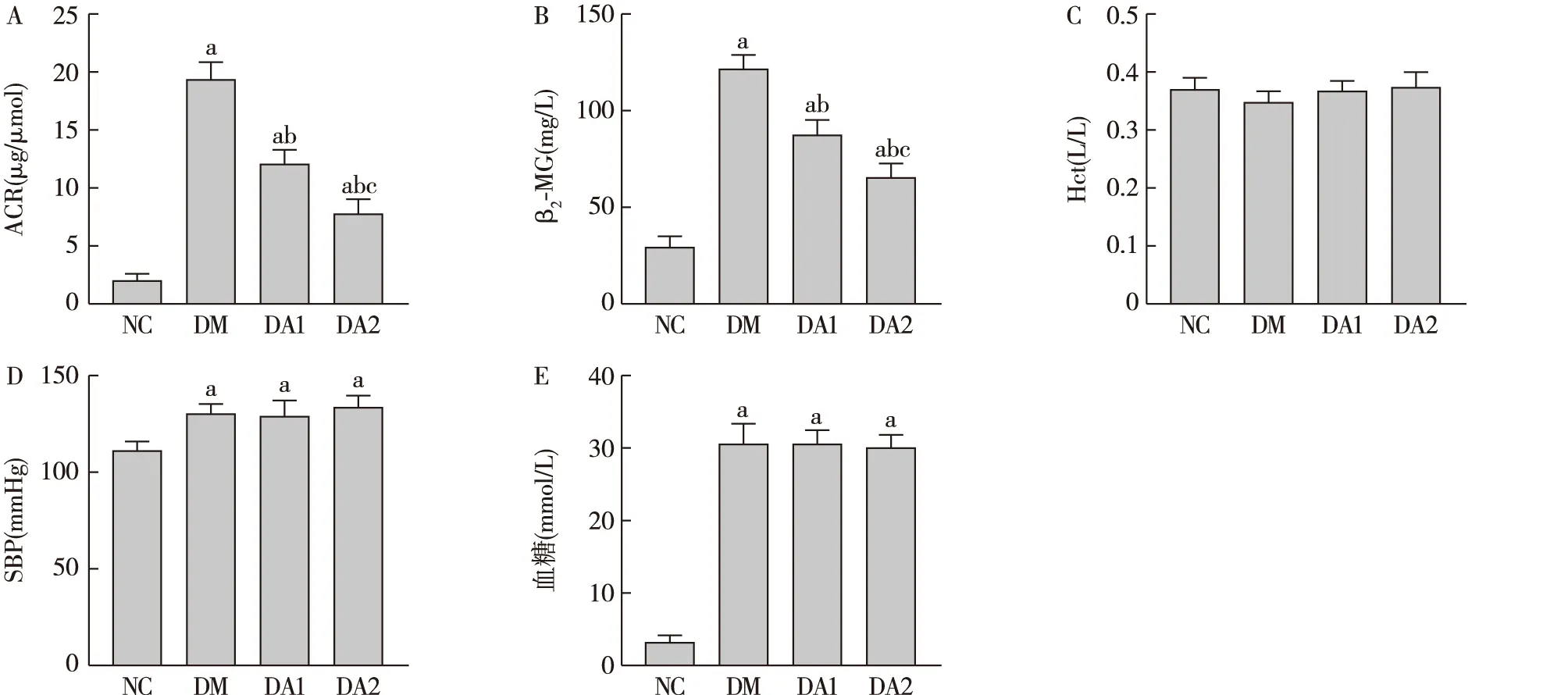
图1 各组大鼠一般指标ACR:尿白蛋白/尿肌酐;β2-MG:尿β2微球蛋白;Hct:红细胞比容;SBP:尾动脉收缩压;NC:正常对照组;DM:糖尿病模型组;DA1:糖尿病模型+ARA290 50 U/kg治疗组;DA2:糖尿病模型+ARA290 100 U/kg治疗组;a:与NC组比较,P<0.05;b:与DM组比较,P<0.05;c:与DA1组比较,P<0.05
肾脏EPOR和CD131表达免疫荧光显示各组大鼠肾小管上皮细胞和肾小球均表达EPOR和CD131,且主要表达于胞膜,两者在大鼠肾脏内存在共定位表达。与NC组相比,DM组肾脏EPOR、CD131表达增高。与DM组相比,ARA290治疗组肾脏EPOR、CD131表达降低。采用抗CD131抗体行免疫沉淀后行Western印迹可检出EPOR,表明EPOR和CD131在大鼠肾脏内存在相互结合(图2、3)。
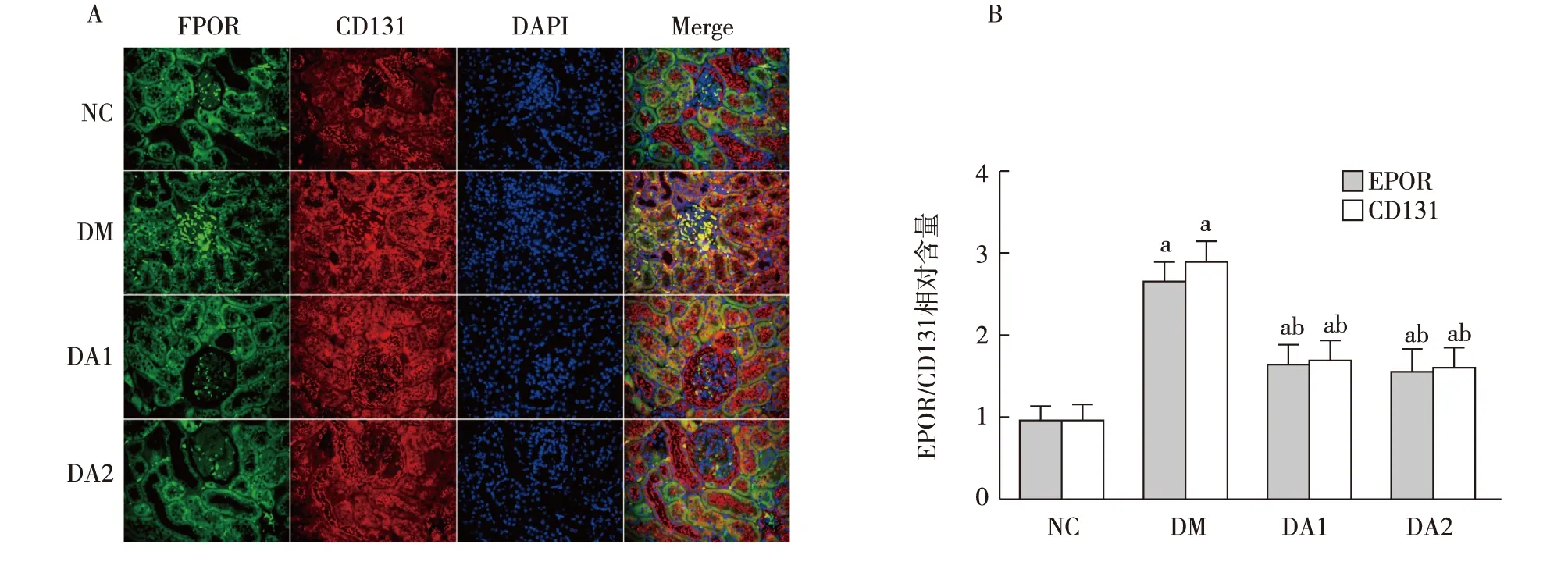
图2 各组大鼠肾脏EPOR、CD131的表达(IF,×400)A:免疫荧光检测EPOR、CD131表达;B:EPOR、CD131半定量分析;NC:正常对照组;DM:糖尿病模型组;DA1:糖尿病模型+ARA290 50 U/kg治疗组;DA2:糖尿病模型+ARA290 100 U/kg治疗组;DAPI:4′,6-二脒基-2-苯基吲哚;a:与NC组比较,P<0.05;b:与DM组比较,P<0.05

图3 大鼠肾脏EPOR、CD131的表达(免疫共沉淀)NC:正常对照组;Input:阳性对照;IgG:阴性对照;IP:免疫沉淀;IB:免疫印迹;EPOR:促红细胞生成素受体
ARA290改善糖尿病大鼠肾脏病理改变肾脏PAS染色结果显示,与NC组相比,DM组肾小球体积增大,毛细血管袢扩张,系膜基质增多,系膜面积占毛细血管丛面积百分比增加,肾小管部分上皮细胞空泡变性、刷状缘脱落。ARA290治疗后糖尿病大鼠上述肾脏病理改变减轻(图4)。
ARA290抑制糖尿病大鼠肾脏NOX4表达RT-PCR和Western印迹检测结果显示,与NC组相比,DM组肾脏NOX4 mRNA及蛋白表达显著增高。与DM组相比,ARA290治疗组肾脏NOX4表达降低,且高剂量ARA290治疗组NOX4表达降低更显著(图5)。
ARA290抑制糖尿病大鼠肾脏ROS产生与NC组相比,DM组肾脏ROS水平显著增高。与DM组相比,ARA290治疗组肾脏ROS水平降低,且高剂量ARA290治疗组肾脏ROS下降更明显。高剂量ARA290治疗组肾脏ROS水平较DM组降低了54%(图5)。
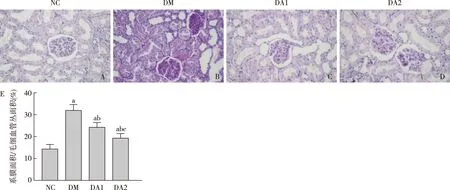
图4 各组大鼠肾脏病理改变(PAS,×400)A~D:与NC组相比,DM组肾小球体积增大,毛细血管袢扩张,系膜基质增多,肾小管部分上皮细胞空泡变性、刷状缘脱落。与DM组相比,DA1、DA2组上述肾脏病理改变减轻;E:肾小球系膜面积/毛细血管丛面积;NC:正常对照组;DM:糖尿病模型组;DA1:糖尿病模型+ARA290 50 U/kg治疗组;DA2:糖尿病模型+ARA290 100 U/kg治疗组;a:与NC组比较,P<0.05;b:与DM组比较,P<0.05;c:与DA1组比较,P<0.05
ARA290降低糖尿病大鼠肾脏MDA及8-OHdG水平免疫组化结果显示,DM组MDA、8-OHdG阳性细胞分布于肾小球及肾小管间质。与NC组相比,DM组肾脏MDA及8-OHdG表达显著增高。与DM组相比,ARA290治疗组肾脏MDA及8-OHdG表达降低(图6)。
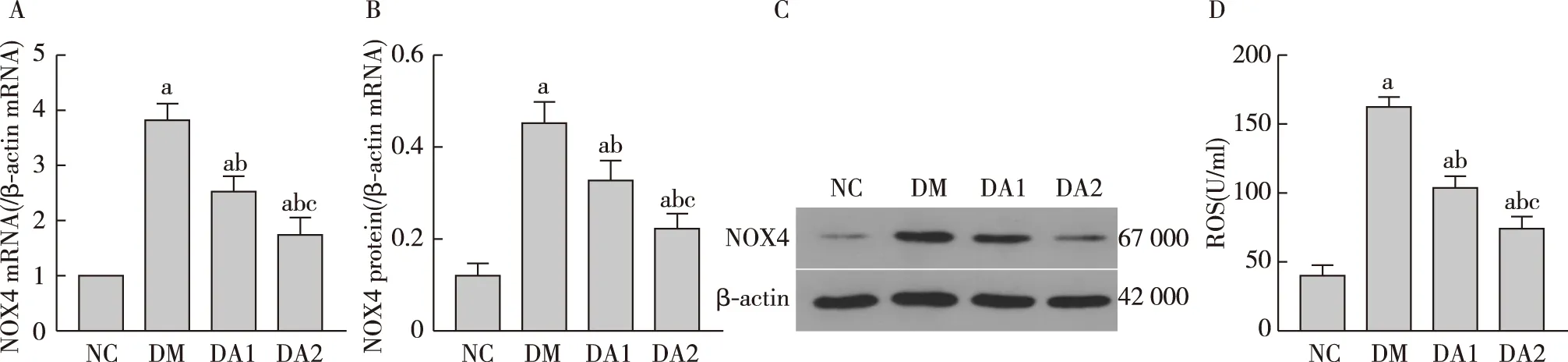
图5 各组大鼠肾脏NOX4、ROS表达水平A:NOX4 mRNA相对表达量;B、C:NOX4蛋白相对表达量;D:ROS含量;NOX4:还原型烟酰胺腺嘌呤二核苷酸磷氧化酶4;ROS:活性氧;a:与NC组比较,P<0.05;b:与DM组比较,P<0.05;c:与DA1组比较,P<0.05
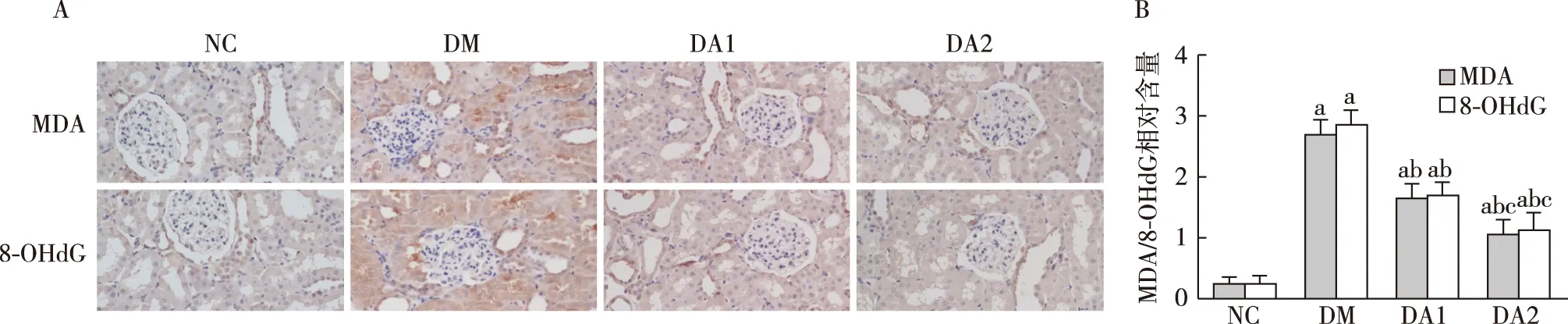
图6 各组大鼠肾脏MDA、8-OHdG表达水平(IH,×400)A:免疫组化检测MDA、8-OHdG表达;B:MDA、8-OHdG半定量分析;NC:正常对照组;DM:糖尿病模型组;DA1:糖尿病模型+ARA290 50 U/kg治疗组;DA2:糖尿病模型+ARA290 100 U/kg治疗组;MDA:丙二醛;8-OHdG:8-羟基脱氧鸟苷;a:与NC组比较,P<0.05;b:与DM组比较,P<0.05;c:与DA1组比较,P<0.05
讨 论
EPO主要由成人肾脏Ⅰ型间质细胞分泌,鉴于EPO主要分泌细胞与肾脏的解剖学关系,我们有理由相信EPO在肾脏内更有利于发挥其内分泌或旁分泌作用。此外,在一些糖尿病的临床研究中发现,不管患者是否合并贫血,其血浆EPO水平较低[10-11]。这提示糖尿病患者往往存在着EPO生成或应答受损,为给予糖尿病患者外源性EPO治疗提供了理论依据。然而,为了研究EPO的非血液学组织保护作用,大剂量的EPO制剂已用于临床研究和动物实验。由于EPO对骨髓系统过度刺激,部分研究在取得一定疗效的同时也带来了血栓栓塞等一系列并发症。为了避免大剂量EPO治疗带来的血栓生成等副作用,研究者们一直致力寻求将EPO造血作用和非血液学组织保护作用分开的EPO衍生物。通过模拟EPO的helix B结构,研究者们合成了最新的EPO衍生肽——ARA290。ARA290具有与EPO相同的组织保护效应,同时无造血活性。目前,已有研究报道ARA290可通过抗氧化机制对心脏、大脑缺血再灌注损伤发挥保护作用[12-13]。本研究发现,高盐高脂饮食饲养3个月后,糖尿病大鼠出现尿ACR、β2-MG增加,肾小球体积增大、细胞外基质增多等早期DKD肾脏病变表现,而ARA290治疗抑制了ACR增加等上述病变,同时对糖尿病大鼠的Hct、血压、血糖无明显影响。这证实了ARA290可对早期的DKD大鼠发挥非血液学的肾脏保护作用。
糖尿病时的高血糖状态下,肾脏的足细胞、系膜细胞、肾小管上皮细胞等固有细胞可产生过量ROS,导致肾脏氧化应激水平增高。过量的ROS可直接氧化损伤核酸、脂质等大分子物质,使其发生结构改变。此外,ROS还可作为信号分子,激活一系列细胞应激敏感性通路导致细胞损伤。目前的研究认为,NADPH氧化酶是DKD时肾脏ROS的关键来源,所以在本研究中我们检测了NADPH氧化酶在肾脏主要亚型NOX4的表达情况。本研究发现,与NC组相比,DM组大鼠肾脏NOX4表达显著增高,ROS产物增多。ARA290治疗后,糖尿病大鼠肾脏NOX4表达降低,ROS产物减少。此外,我们还检测了反映肾脏脂质和DNA氧化损伤的指标MDA和8-OHdG。结果显示,与NC组相比,DM组大鼠肾脏MDA和8-OHdG均增高。经ARA290治疗后,糖尿病大鼠肾脏MDA和8-OHdG水平降低。这证实ARA290可通过抑制NOX4的表达降低肾脏ROS的产生,抑制氧化应激导致的肾脏损伤。
在血液系统,EPO可通过经典的EPOR2同二聚体受体介导,调节红系祖细胞bcl-2抗凋亡基因家族相关基因的表达,从而维持它们继续发育为成熟的红细胞。目前的研究认为,EPO及其衍生物发挥非血液学组织保护作用可能需要一种新的组织保护受体(Tissue protective receptor,TPR)介导,并激活一系列与经典的EPOR2同二聚体途径不同的信号通路,但目前TPR的结构并不明确。有研究发现,通过基因敲除抑制CD131表达后EPO的组织保护作用消失,而对其血液学效应无明显影响[14],这提示CD131可能是介导EPO组织保护作用的TPR的有效构成成分。CDl31是I型细胞因子受体超家族中白细胞介素3(IL-3)、IL-5、粒细胞-巨噬细胞集落刺激因子等细胞因子受体的共享亚基,具有重要的信号转导功能。Ⅰ型细胞因子受体存在受体亚基共享,而EPO亦属于Ⅰ型细胞因子超家族。在神经系统和心血管系统,已有研究证实EPOR和CD131存在共表达,且两者可形成异二聚体,介导EPO的组织保护作用[14-15]。随着对 CD131在EPO及其衍生物发挥非血液学组织保护效应中潜在作用的认识,研究者们推测表达EPOR的非造血组织可能存在EPOR-CD131蛋白复合物,在上述组织发生损伤时作为TPR介导EPO及其衍生物潜在的组织保护作用。本实验中,我们发现大鼠肾脏表达EPOR和CD131,且免疫荧光显示两者存在共定位表达。此外,免疫共沉淀也证实了两者在肾脏内存在相互结合。这提示肾脏细胞存在EPOR-CD131蛋白复合物,ARA290发挥肾脏保护作用可能需要通过这一受体系统介导。
总之,本研究证实ARA290可抑制糖尿病大鼠肾脏氧化应激损伤,发挥肾脏保护作用。此外,我们还发现大鼠肾脏表达EPOR、CD131,且两者在体内可形成EPOR-CD131蛋白复合物,其可能作为TPR介导了ARA290的肾脏保护作用。
