氧化三甲胺对慢性肾脏病的影响和对策
2019-12-31综述王金泉审校
杨 柳 综述 王金泉 审校
近年来,肠道菌群在慢性疾病发生发展过程中的作用日益受到重视。肠道菌群代谢产物之一——饮食来源氧化三甲胺(TMAO)是充血性心力衰竭、慢性肾脏病、动脉粥样硬化等疾病长期全因死亡率的独立危险因素[1-3]。 TMAO分子量为75.1道尔顿,合成依赖于饮食中摄入的左旋肉碱、卵磷脂、胆碱等,95%以上以原型经肾脏排出[4]。 进食肉碱、甜菜碱、磷脂酰胆碱含量增加可导致血浆TMAO水平升高,口服环丙沙星、甲硝唑等广谱抗生素可通过调节肠道微生态使TMAO产生减少[3]。TMAO不仅参与造成肾脏纤维化,还通过促进动脉粥样硬化、高血压、糖尿病、炎症等病理过程,加重肾脏损害,是影响肾脏预后的重要尿毒症毒素之一[2-3,5-6]。 本文拟针对TMAO的生物学特性、作用机制、对慢性肾脏病(CKD)及心血管事件的影响和抑制TMAO合成治疗CKD的研究进展进行综述。
TMAO的代谢及作用机制
TMAO是肠道菌群依赖性代谢产物,其生物合成受饮食、肝酶代谢、肠道菌群等多因素影响。饮食中胆碱、左旋肉碱、甜菜碱、磷脂酰胆碱等均可经肠道菌群代谢产生TMAO,其中胆碱是最重要来源。红肉、肝脏、鱼、贝、蛋、奶等食物均富含胆碱,其中以红肉含量最高。进食摄入富含胆碱、左旋肉碱、磷脂酰胆碱的食物后,肠道菌群将其代谢形成中间产物三甲胺(TMA),TMA吸收入血并转运至肝脏,被含黄素单氧酶(FMO)迅速氧化为TMAO[2]。雄激素、胆汁酸均可通过调节FMO表达影响TMAO水平[3]。研究表明多种肠菌参与代谢产生TMAO,如肠杆菌属、埃希菌属、爱德华菌属、脱硫弧菌、梭菌属、肠球菌属、链球菌属、放线菌属、沙雷氏菌属、不动杆菌等[7]。而饮食结构亦参与调节肠道菌群组成,共同影响TMAO产生[3]。
正常情况下TMAO经循环清除,主要依靠肾小球滤过排出,人体内TMAO水平波动于2.4~6.2 μmol/L[8]。可见饮食成分、肠道菌群分布特点、肝脏及肾脏功能等因素均可影响TMAO血清浓度。与正常人相比,CKD患者肠道菌群分布存在明显异常:十二指肠及空肠内肠杆菌科、短状杆菌属、粪球菌属、盐单胞菌科等多种菌属数量明显增多,结肠需氧菌过度生长,导致TMAO产生增多[7,9]。伴随肾小球滤过率下降,血清TMAO水平逐渐升高,终末期肾病(ESRD)患者体内TMAO平均水平高达94.4 μmol/L,肾脏替代治疗可以迅速有效清除TMAO[8,10]。
目前对于TMAO影响细胞代谢的详细机制尚不清楚,相对明确的是TAMO诱导吞噬细胞在粥样斑块处聚集,上调清道夫受体及促炎因子表达,促进胆固醇转运,可通过调节CD36/MAPK/JNK通路加速动脉粥样硬化发生发展[11]。 NLPR3炎性小体感受内源性或外源性毒性物质后,促进促炎因子形成及分泌,影响动脉粥样硬化发展。TMAO可诱导NLPR3炎性小体在动脉内皮细胞形成并活化,影响内皮细胞紧密连接,介导炎症反应,加重氧化应激,导致内皮功能障碍,减少循环内皮细胞数量,与心血管事件危险因素有关[12-13]。
TMAO与CKD
肠道内尿素经细菌尿素酶代谢产生氨,后者导致肠黏膜屏障结构广泛破坏,造成肠源性尿毒症毒素、抗原、内毒素、肠道微生物组分及其产物等吸收入血。CKD患者肠道菌群细菌总量减少、菌种分布异常可致硫酸吲哚酚、甲基吲哚酚、TMAO等尿毒症毒素增加,上述毒素通过损伤肾小管上皮细胞,介导肾脏间质纤维化相关基因表达,促进CKD进展,加重血管硬化、动脉钙化、内皮细胞氧化应激,在CKD心血管事件中发挥重要作用[6,14](图1)。
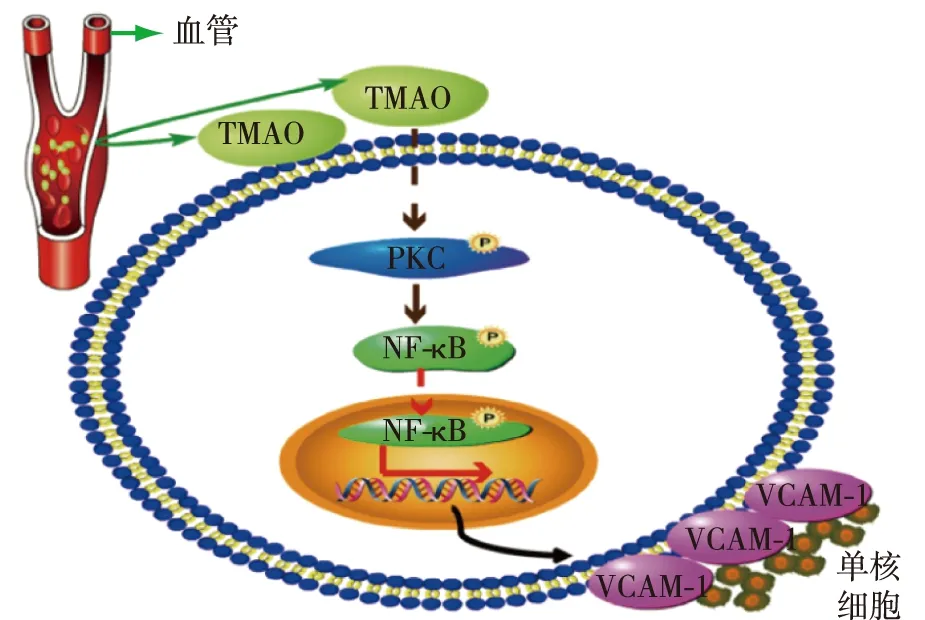
图1 TMAO诱导单核细胞黏附的分子机制[15]TMAO:氧化三甲胺;PKC:蛋白激酶C;NF-κB:核因子κB;VCAM-1:细胞间黏附因子1;TMAO影响血管内皮细胞,继而激活PKC,促进NF-κB磷酸化后入核,诱导VCAM-1表达和单核细胞向血管壁黏附
目前针对TMAO影响CKD的分子基础研究十分有限。以TMAO处理C57BL/6J小鼠的实验表明,高胆碱或富含TMAO饮食可造成小鼠肾小管损伤标志物肾损伤分子1(KIM-1)水平升高,且血清TMAO水平升高与肾小管间质纤维化加重、胶原沉积增多、Smad3磷酸化增加呈正相关,提示TMAO通过调节TGF-β/Smad3信号通路促进肾间质纤维化[2]。经上述多重机制,TMAO蓄积最终导致CKD患者的人、肾存活率下降,全因死亡率升高[16]。
TMAO主要经尿液清除,故肾小球滤过率下降者血清TMAO水平明显升高。CKD患者血清TMAO浓度与白细胞介素6(IL-6)、纤维蛋白原、超敏C反应蛋白等炎症介质水平具有正相关性,移植过程中缺血性肾脏损伤可导致血清TMAO水平异常升高,而肾移植后血清TMAO水平明显下降[17]。动物研究显示,将CKD患者粪便样本植入已实行肠菌清洁的大鼠肠腔后,大鼠外周血TMAO水平明显升高[18]。此外,CKD患者参与胆碱、左旋肉碱、TMA等代谢的8个基因出现异常,K07271、K01004、K00130、K00499、K00540等胆碱及左旋肉碱代谢相关基因和K07811、K07821、K03532等TMA代谢相关基因表达异常均可导致TMAO产生增多[18]。
Tang等[2]检测521例CKD患者血清TMAO水平,分析其与5年全因死亡率的关系,发现CKD患者TMAO水平明显高于非CKD患者,TMAO水平升高可直接导致死亡风险增加2.8倍;且TAMO水平是独立于C反应蛋白、肾小球滤过率等传统风险因素的死亡预测指标。综上所述,TMAO对于CKD进展及预后有直接影响,而肾功能不全进展也会进一步升高血清TMAO水平,形成恶性循环。
TMAO与CKD心血管事件
TMAO与动脉粥样硬化、心功能不全、糖尿病、慢性炎症等心血管事件高危因素密切相关,间接影响CKD发展和结局。目前已知的TMAO影响CKD心血管事件的分子机制包括:上调肿瘤坏死因子α(TNF-α)和IL-1β等促炎因子表达、下调抗炎因子IL-10表达;通过PKC/NF-κB通路促进VCAM-1表达,造成内皮细胞功能障碍;通过MAPK/NF-κB通路促进白细胞黏附;过表达超氧化产物,加重氧化应激;下调胆固醇代谢限速酶—Cyp7a1和肠道胆固醇转运蛋白(Npc1L1和Abcg5/8)表达,干扰脂质稳态,促进动脉粥样硬化形成;增加巨噬细胞清道夫受体CD36和SR-A1表达,促进脂质聚集和泡沫细胞形成[15,19]。
Senthong等[20]研究外周血管病患者TMAO水平与死亡风险的关系,结果显示血清TMAO水平最高组患者全因死亡率较TMAO水平最低组增加2.7倍,校正心血管病史、炎症指标、超敏C反应蛋白、脂蛋白等传统危险因素后,血清TMAO升高仍是5年全因死亡率的重要预测因子。除直接血管毒性外,TMAO与其他代谢因素存在复杂相互影响,血清TMAO和胆碱浓度与年龄、低密度脂蛋白胆固醇水平及血清肌酐数值呈正相关。TMAO水平高者磷脂浓度和甲基化水平更低,目前无法明确三者之间因果关系[21]。
红肉、鸡蛋等高胆碱饮食及高TMAO水平与心脏代谢性风险因素增加有关。Wang等[22]发现胆碱或添加TMAO饮食可增加主动脉根部粥样斑块面积,血清TMAO水平与斑块面积正相关,以广谱抗生素清洁肠道后,胆碱则无法启动动脉粥样硬化形成。循环TMAO水平与冠状动脉粥样斑块的发展速度呈正相关,与未发生斑块破裂患者相比,斑块破裂者血清TMAO升高2倍,提示TMAO可能成为冠状动脉粥样斑块进展的生物标志物[23]。Stubbs等[9]观察220例CKD患者,分析血清TMAO水平对冠状动脉粥样硬化病变的影响,以及基线TMAO水平与长期人存活率的关系,结果表明血清TMAO水平是CKD患者发生冠状动脉粥样硬化的独立预测指标,TMAO有望成为降低CKD心血管死亡率的治疗靶点。
TMAO对于心功能不全、糖尿病等CKD心血管事件高危因素有明确影响。肠道缺血引起肠道菌群易位、代谢产物增加,促进炎症反应和氧化应激,造成心功能不全。TMAO水平升高与心肌扩张功能障碍、患者生存率下降有关,可直接加重心功能不全[24-26]。动物实验结果显示,饮食中补充TMAO或富含胆碱饮食可导致循环TMAO水平升高,且饮食干预组小鼠脑钠肽水平升高,心脏扩大、心室重构、射血分数下降、肺水肿等表现均较对照组加重[27]。 现有数据表明随着糖尿病病程进展,患者循环TMAO水平渐进性升高,但目前尚无针对血清TMAO与糖尿病发生发展因果关系的动物实验研究结果。临床研究显示相比于健康个体,2型糖尿病患者进食富含磷脂酰胆碱饮食后全因死亡率及心血管疾病死亡率明显升高[28]。Dambrova等[29]检测糖尿病db/db小鼠和非糖尿病db/L小鼠体内TMAO水平,发现糖尿病小鼠较非糖尿病小鼠血清TMAO水平升高10倍,且与左旋肉碱浓度无关。临床观察结果提示TMAO与糖尿病独立相关,不受左旋肉碱水平影响[29]。一项观察性研究显示TMAO水平升高是糖尿病患者全因死亡及心肌梗塞、心功能不全、不稳定性心绞痛等心血管事件的有效预测因子[30]。TMAO对于糖尿病的影响有待深入探讨。
抑制TMAO合成与CKD治疗
干预饮食、限制胆碱或左旋肉碱摄入有助于减少TMAO生成。高纤维、低蛋白膳食使素食者循环TMAO、甲基吲哚酚、硫酸吲哚酚等毒素水平明显低于正常饮食者[3]。近年来,研究发现靶向性抑制TMAO合成有助于治疗CKD心血管疾病。
3,3-二甲基-1-丁醇(3,3-dimethyl-1-butanol,DMB)具有抑制多种微生物TMA裂解酶的功能,通过减少TMA合成降低血清TMAO水平。研究表明,DMB可抑制胆碱饮食所致内源性巨噬泡沫细胞形成,减轻动脉粥样硬化病变,提示DMB抑制肠道微生物产生TMAO,可以延缓代谢性疾病的心脏病变进展[31]。Li等[32]证实随年龄增加,循环TMAO水平升高,促进前炎症因子及超氧化物产生,造成衰老相关内皮功能障碍,主动脉表达内皮型一氧化氮合酶(eNOS)减少,而饮食添加DMB则有助于改善内皮功能,减轻血管炎症及氧化应激。含DMB饮食可以降低高糖高脂饮食导致的血清TMAO水平升高,降低心脏组织促炎因子TNF-α和IL-1β表达,增加抗炎因子IL-10表达,减轻心脏间质纤维化和收缩舒张功能受损等[33]。在CKD模型鼠,eNOS丝氨酸1177和苏氨酸495位点磷酸化异常,导致eNOS活性下降,经DMB处理后,上述位点磷酸化恢复正常,eNOS活性改善,表明DMB可影响血管eNOS活性,改善一氧化氮生物利用度,有助于维持血管功能[34]。 高脂饮食诱导性肥胖小鼠肾组织烟酰胺腺嘌呤二核苷酸氧化酶4(NOX-4)、TNF-α和IL-1β表达较低脂饮食小鼠明显升高,DMB处理可下调高脂饮食组小鼠肾脏NOX-4和促炎因子表达,减轻肾脏间质纤维化,改善肾功能[35]。 由此可见,低胆碱、低脂饮食有利于下调血清TMAO水平,对CKD患者心血管系统有保护作用,DMB有望成为CKD营养治疗的新策略。
小结:肠道菌群代谢产物TMAO是CKD的重要生物标志物,参与CKD及其伴随心血管事件的发生发展。TMAO是重要的CKD风险预测因子,其合成抑制剂DMB可能成为CKD营养治疗的新方法。
