间充质干细胞治疗糖尿病肾病
2019-12-31张颖超综述王彩丽审校
张颖超 米 焱 综述 王彩丽, 李 礼 审校
全球糖尿病患者总人数将从2010年的2.85亿在2030年激增到4.39亿,糖尿病是危害公众健康的主要病因之一[1],大约有25%~40%的糖尿病患者会最终发展为糖尿病肾病(diabetic nephropathy,DN)。DN是糖尿病的主要微血管并发症,以及终末期肾病的重要病因,伴有严重肾损害及高风险心血管疾病,由肾小球、肾小管和间质的改变和慢性炎症反应组成[2]。虽然严格的血糖和血压控制可以延缓DN的发生,但并不能完全阻止疾病的进展[3]。因此,寻找DN新的、潜在的治疗靶点和治疗方法,一直是临床医师面临的重大挑战,也是国内外的研究热点。
近年来,间充质干细胞(mesenchymal stem cells,MSCs)已经在医疗界被认为是治疗DN有前景的组织再生方法[4]。间充质干细胞可减缓糖尿病动物肾脏细胞损伤,改善微量白蛋白和肾脏病理改变[5]。对DN修复和再生多年的研究发现,MSCs移植后通过三种作用模式发挥作用,包括直接修复肾细胞损伤,调节炎症和免疫反应,以及抗纤维化(图1)。除了再生和分化的潜能外,MSCs的旁分泌功能越来越受到关注,其旁分泌多种营养因子通过调节邻近细胞来发挥生物学功能,如免疫调节和抗凋亡[6],其中最重要的是MSCs来源的细胞外囊泡,主要包括外泌体(exosomes,exo)和微囊泡[7](图2)。 在本文中,将对间充质干细胞在DN中的治疗潜力,主要为MSC旁分泌的营养因子和细胞外囊泡外泌体的作用机制进行了综述。
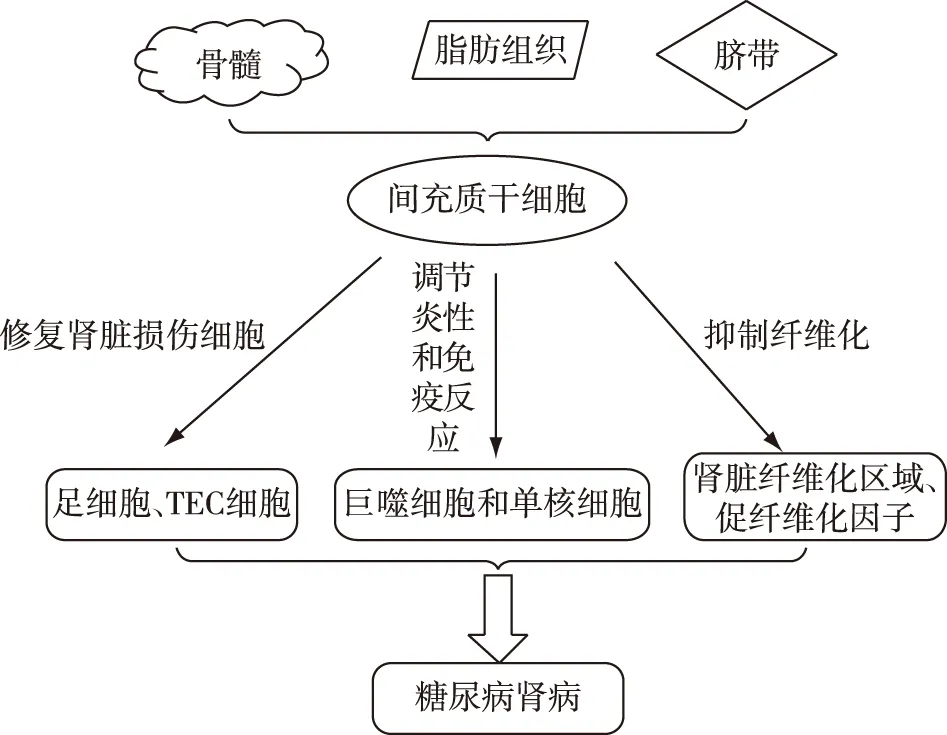
图1 间充质干细胞修复糖尿病肾病的作用方式和机制
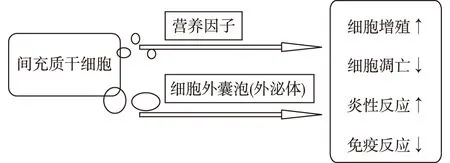
图2 间充质干细胞旁分泌方式治疗糖尿病肾病的机制
MSCs治疗糖尿病的机制
修复糖尿病肾脏细胞损伤众所周知,由肾小球内皮细胞,肾小球基膜(GBM)和足细胞构成的肾小球滤过屏障在DN的发病机制中起着重要作用,其是阻止蛋白尿发生的关键屏障。MSCs具有修复肾细胞损伤的作用,进而减少糖尿病动物白蛋白尿和减轻肾小球损伤。并且MSCs可防止体外高糖诱导培养的足细胞的损伤。Zhang等[8]的研究表明,链脲佐菌素(STZ)诱导的糖尿病大鼠经反复静脉注射MSCs可显著减轻肾小球肥大及降低尿蛋白排泄。据报道,人胎胰腺源性间充质干细胞可抑制DN大鼠足细胞融合和缺损及GMB增厚,维持肾小球滤过屏障的完整性[9]。此外,在体外移植MSCs的DN大鼠体内发现升高的肾增殖指数(Bcl-2、klotho基因等)增高和肾凋亡指数(Bax等)降低,有效的阻止了肾脏损害[10]。
调节炎性和免疫性反应MSCs除了直接促进肾脏损伤的修复外,对调节肾脏再生中的炎症和免疫反应同样发挥重要作用[11]。在DN大鼠模型中,MSCs明显抑制单核细胞来源的树突状细胞的分化和巨噬细胞的活化[12]。而且,MSCs通过抑制巨噬细胞浸润与IL- 6和TNFα等炎症因子的分泌来发挥抗炎作用以减缓DN 的进展[13-14]。此外,越来越多的证据表明,MSCs通过与巨噬细胞、T细胞、NK细胞等免疫细胞直接作用,对机体进行免疫调节[13-15]。
改善肾脏纤维化细胞外基质的沉积可引起肾脏纤维化,糖尿病肾病中肾脏的纤维化与上皮-间质转化(EMT)过程中肾细胞表型的促纤维化改变有关[16]。对DN小鼠的研究中发现,MSCs可以显著改善肾脏纤维化,缩小小鼠肾脏的纤维化区域,同时,这种变化也反映在促纤维化分子的表达水平上,如Ⅰ型胶原蛋白和纤连蛋白表达明减少[17-18]。Jiang等[9]在其研究中也证明,胎儿胰腺祖细胞可能通过减少纤连蛋白的积累而逆转DN的损伤。
通过旁分泌作用改善DN
间充质干细胞分泌营养因子研究证明,MSCs对DN的治疗主要通过MSCs旁分泌的各种营养因子发挥作用,这些因子主要分为三类:生长因子、细胞因子和趋化因子[19]。它们在细胞生长、分化、炎症、迁移、凋亡和信号转导等多种生物学功能中发挥重要作用,如骨形态发生蛋白7(BMP-7)、肝细胞生长因子(HGF)、内皮生长因子(EGF) 及胶质细胞源性神经营养因子(GDNF)等。BMP-7作为抗纤维化细胞因子,能够拮抗转化生长因子β1(TGF-β1)的表达[20]。而MSCs衍生的BMP-7通过在体外和体内抑制TGF-β/Smad信号通路改善糖尿病肾小球纤维化[17]。Lv等[21]发现MSC来源的HGF通过抑制单核细胞趋化蛋白1的表达(MCP-1)减少巨噬细胞浸润,进而下调了糖尿病大鼠肾组织中促炎细胞因子如IL-1β,IL-6及TNF的表达;同时发现HGF通过抑制TGF-β表达的上调来减轻肾小球硬化。脂肪源MSCs可分泌EGF抑制体外高糖诱导的足细胞caspase-3的表达而改善足细胞凋亡或损伤[22]。同样,Zhang等[8]在体外高糖诱导培养的足细胞中发现,MSCs分泌的GDNF通过下调足突调节蛋白(synaptopodin)的表达预防高糖对足细胞的损伤[8]。
分泌外泌体MSCs是一种多能分化的成体干细胞,具有分化为不同组织的潜能以及自我更新能力[23],是治疗疾病最常用的细胞类型之一。人们最初认为MSCs是通过迁移到损伤部位,分化成组织再生所需的细胞来发挥其治疗作用[24],但后来的研究表明MSCs可以经旁分泌多种细胞因子来减少细胞损伤,并促进修复。exo作为MSCs旁分泌的一种重要胞外囊泡,能够改善受损组织功能[25],靶向调控组织内的稳态,使组织细胞能够修复和再生[26],是细胞间信息交流的重要信使。
外泌体是直径为40~150 nm的磷脂双分子层囊泡,含有丰富的生物活性分子,如mRNA、microRNA及蛋白质等成分,来源广泛,几乎存在于所有生物体内。外泌体膜同细胞膜相似,含有许多信号分子和表面抗原,据报道其内存在蛋白质和遗传物质但不具有细胞核或线粒体等细胞器[27]。来源于MSCs的外泌体(MSC-exos)主要通过mRNA、微小RNA(microRNA)和蛋白质的水平转移发挥作用,然后以蛋白质为作用基础通过多种机制改变靶细胞的活性,可以增强与靶细胞间的信息交流,促进细胞的增殖、迁移或抑制细胞的凋亡,从而达到修复组织损伤的目的,是细胞与组织修复的关键调节因子,因此对肾脏的组织结构具有保护作用[28]。
MSC-exos参与DN治疗的机制研究
抑制足细胞凋亡细胞凋亡是DN的一个重要特征,其中足细胞凋亡是最主要的病理变化。足细胞是肾小球脏层细胞,覆盖在肾脏超滤屏障的外层,与肾小球的功能密切相关。近年来,大量研究表明足细胞损伤是糖尿病的早期病理变化,足细胞消退、脱分化和凋亡是DN足细胞损伤的主要类型[29]。DN患者的慢性高血糖和AGEs的积累不断刺激系膜细胞内TGF-β的分泌和足细胞中TGF-β受体(TGF-βR )的表达,以及ROS介导的p38MAPK和caspase-3的激活协同促使足细胞凋亡[30],刺激巨噬细胞活化并释放多种炎性因子,导致肾组织损伤,使炎症微环境和免疫微环境改变[12,25]。
Jiang等[31]经糖尿病大鼠尾静脉注射尿源性干细胞外泌体(USCs-exo),观察到与对照组相比,大鼠尿量和尿微量白蛋白排泄均降低,足细胞和肾小管上皮细胞凋亡减少,肾小球内皮细胞增殖。进一步研究发现这种转变是由MSC-exos抑制caspase-3过表达而实现,而且USCs-exo分泌的分子包括生长因子,TGF-β1,血管生成素和BMP-7等,可抑制足细胞凋亡,促进血管再生和细胞存活预防或缓解DN中发挥关键作用。此研究为MSC-exos治疗DN寻找了一个方向。近期有研究发现,MSC-exos可通过介导miRNA-410、miRNA-495和let-7a的转录而抑制与细胞凋亡相关的几种编码mRNA,以及细胞骨架相关分子如CASP3、SHC1和 SMAD4等的表达,其中SMAD4可编码TGF-β1的蛋白质并介导纤维化的发生[32]。DN小鼠体内移植脂肪源MSCs后尿蛋白、血清肌酐(SCr)、血尿素氮(BUN)和足细胞凋亡水平均降低;在体外实验中,MSCs逆转了高糖诱导的MPC5细胞活力的降低和细胞凋亡的增加。研究发现由MSC-exos包含的miR-486在体外细胞凋亡和体内DN症状改善过程中起着至关重要的作用。miR-486通过靶向调节Smad1降低Smad1表达,进而抑制Smad1/mTOR信号通路的活化,逆转了足细胞凋亡,改善肾小球的高滤过,从而减少蛋白尿生成,发挥肾保护的功能,延缓DN的发展[33]。
通过mTOR信号通路增强自噬作用mTOR(雷帕霉素靶蛋白)存在两个独立的信号复合物,mTOR复合物1 (mTORC1)和mTOR复合物2(mTORC2),二者共同调节自噬活性[34]。m TORC1主要是促进细胞的生长与增殖的作用,m TORC2则主要是调节细胞的极性、细胞骨架蛋白和肌动蛋白。自噬作用是通过溶酶体来降解消除细胞毒性蛋白聚集物和受损的细胞器,使细胞回收线粒体能源并存活,在维持生物体正常功能以及抵御外界刺激中发挥着重要作用,是维持机体稳态的重要途径,也是肾脏维持正常功能的重要途经。LC3是自噬体的常见指示蛋白,自噬作用一旦被下调,LC3 II/LC3 I的表达随即被抑制,进而参与到足细胞凋亡的过程中加重DN[34]。
足细胞和肾小管细胞的自噬功能受损,导致肾小球的滤过及肾小管的重吸收出现障碍,这与DN的发生密切相关。DN患者体内mTOR由于高血糖刺激而处于过度激活状态,抑制细胞自噬,导致足细胞受损,从而促使系膜外基质沉积及蛋白尿出现[34]。Ebrahim等[34]将实验大鼠分为五组,即对照组、DN、外泌体处理DN、用3-甲基和氯喹(自噬抑制剂)处理DN、用3-甲基和氯喹及外泌体处理DN,处理组经尾静脉注射给药后观察首次发现,在糖尿病大鼠肾脏中,骨髓MSC-exos可通过mTOR信号通路在体内调节自噬来改善DN,表现为mTOR和纤维化标志物表达显著降低,从而减少蛋白尿、抑制纤维化。脂肪MSC-exos能够提高miR-486的表达,通过下调靶基因Smad1的表达,抑制Smad1/mTOR的激活,从而增强自噬,减少足细胞凋亡,改善DN[33]。
小结:MSCs作为DN治疗策略被越来越多研究者关注。对MSCs作用途径的研究更多聚焦于其旁分泌机制对DN发挥治疗作用,由MSCs旁分泌的分子如营养因子和囊泡介导和调节DN的病理生理学变化,包括氧化应激,ECM重塑,细胞凋亡和增殖,以及免疫应答和炎性反应。特别是MSC-exos这种治疗方法,因其多效性、安全性等优势,成为DN的候选治疗方法,有望给DN患者带来实质性的好处。虽然该技术尚未成熟,但是具有巨大的临床应用价值。
