中枢神经系统mTOR信号通路与药物成瘾关系的研究进展
2019-12-31黄兆奎赵永娜吴亚梅李利华洪仕君
黄兆奎,赵永娜,2,吴亚梅,李利华,洪仕君
(昆明医科大学1.药学院暨云南省天然药物药理重点实验室,2.国际教育学院,3.法医学院,云南 昆明650500)
药物成瘾是一种具有高复发性和强迫性觅药特征的慢性脑疾病。滥用药物可能导致神经结构和功能可塑性的改变,进而导致产生强迫性觅药行为,这是药物成瘾性的主要原因之一[1],但其具体机制尚未完全清楚。迄今对药物成瘾,尤其是针对毒品的高复吸率尚无有效的戒断治疗对策。多数学者认为,中脑边缘多巴胺系统包括腹侧被盖区及其主要投射区伏隔核(nucleus accumbens,NAc)和额叶皮质(prefrontal cortex,PFC)以及与记忆密切相关的海马和杏仁核等区域,在滥用药物的奖赏和成瘾等方面发挥极其重要的作用[2]。研究表明,在奖赏通路中,从PFC和其他边缘区向NAc投射的哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)信号通路也介导了药物成瘾的发生和发展[3]。mTOR是通过天然抑制剂雷帕霉素药物活性发现的一类非典型的丝氨酸/苏氨酸激酶。诸多研究表明,mTOR 属于一个真核细胞信号,会对转录和蛋白质的合成产生影响,并且还可能调节细胞凋亡和自噬等。研究发现,mTOR信号通路的主要途径有上游肝激酶B1(liver kinase B1,LKB1)、AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)及下游效应因子核糖体蛋白质S6 激酶1(ribosomal protein S6 kinase 1,S6K1)和真核起始因子4E 结合蛋白1(eukaryotic initiation factor 4E-binding protein 1,4EBP1)等。本文就mTOR信号通路与药物成瘾关系的研究进展进行综述。
1 mTOR信号通路的组成
1.1 mTOR
mTOR 以抗真菌大环内酯类抗生素雷帕霉素(西罗莫司)命名,是广泛存在于真核细胞中的磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases,PI3K)相关蛋白激酶家族,具有对蛋白底物丝氨酸/苏氨酸(Ser/Thr)残基产生磷酸化作用的Ser/Thr蛋白激酶活性[4]。细胞内的mTOR 有2 种不同形式的复合体,mTOR 复合体1(mTOR complex 1,mTORC1)和mTORC2。其中,mTORC1 主要由mTOR、mTOR调节相关蛋白(regulatory-associated protein of mTOR,Raptor)、哺乳动物致死sec-13蛋白8(mammalian lethal with sec-13 protein 8,mLST8)组成[4],反映营养物质和能量有效性的生长信号,以促进细胞增殖或自噬[5]。mTORC2则由mTOR 雷帕霉素不敏感伴侣(rapamycin insensitive companion of mTOR,Rictor)、哺乳动物应激蛋白激酶相互作用蛋白1(mammalian stress protein kinase interacting protein 1,mSIN1)和mLST8 等组成[6]。
1.2 mTOR信号通路的主要上游因子
1.2.1 肝激酶B1
LKB1属于Ser/Thr 蛋白激酶,通过N端核定位信号序列定位于细胞核内或通过LKB1相互作用蛋白1(LKB1 interacting protein-1,LIPI)锚定在细胞质[7]。LKB1 存在STE20相关衔接蛋白(STE20-related adaptor protein,STRAD)和小鼠蛋白质25(mouse protein 25,MO25)2 种重要蛋白,STRAD可促进LKB1从细胞核内移位到细胞浆[8];MO25结合到STRAD 的羧基端而增加LKB1-STRAD 复合物在细胞浆中的空间定位和构象,使LKB1 的活性提高了近10倍[9];另外,LKB1是极其重要的蛋白激酶,它的直接底物包括AMPK[8],LKB1可对AMPKɑ亚基上Thr172位点的磷酸化并激活AMPK;同时,LKB1 也是细胞生长的负调控因子,通过激活AMPK 后对真核细胞生长正调节因子mTORC1 的活性产生抑制作用。
1.2.2 腺苷-磷酸活化蛋白激酶
AMPK即AMP依赖蛋白激酶,是生物能量代谢调节的关键因子,是由ɑ,β 和γ 亚基组成的异源三聚体复合物[10]。AMPK 属于高度保守的蛋白质,被称之为细胞的“代谢和能量感受器”。当受到诸如缺氧、缺血、营养物质缺乏和运动等应激刺激后,细胞内部的AMP/ATP 比值会增加,AMPK 被活化;同时,还可下调合成代谢过程(如蛋白质、脂肪酸和胆固醇的合成),达到降低ATP消耗的目的;同时促进氧化过程(如脂肪酸氧化和糖酵解等),以生成更多的ATP 来缓解应激维持机体的正常代谢[11]。LKB1-AMPK信号通路除了在调节能量代谢方面起重要作用外,被活化的AMPK还可活化结节性硬化复合物(tuberous sclerosis complex,TSC),而TSC是脑中Ras 同源类蛋白(Ras homology enriched in brain,Rheb)的抑制剂,在缺氧、营养匮乏等应激下,LKB1 通过激活AMPK 提高TSC 活性,并抑制Rheb的活性,负向抑制mTOR的活化[12]。
2 mTOR主要效应因子及调控
S6K1 和4EBP1 是mTORC1 下游的主要效 应因子,是蛋白翻译的关键调节因子和细胞生长的正调节剂[13]。S6K1 与真核起始因子3(eukaryotic initiation factor 3,eIF3)结合时处于失活状态。当在受到生长因子刺激后,mTOR与eIF3结合后磷酸化S6K1,进而使S6K1 从eIF3 上释放,活化的S6K1 可磷酸化p70 核糖体蛋白S6 激酶(p70 ribosomal protein S6 kinase,p70S6K)等细胞底物,最终启动mRNA 5′端的翻译及刺激蛋白质合成的核糖体蛋白和延长因子lα(elongation factor-lα,EF-lα)的编码[14](图1)。4EBP1在低磷酸化状态下与真核翻译启动因子4E(eukaryotic translation initiation factor 4E,eIF4E)结合,并对其活性产生抑制作用,进而达到对依赖eIF4E 转录的起动及蛋白质的表达产生抑制作用。当mTOR 磷酸化4EBP1后,活化的4EBP1 与eIF4E 分离,解除了对转录的抑制作用[15]。此外,mTORC1 可直接对4EBP1 第37位和46位苏氨酸产生磷酸化作用(图1)。
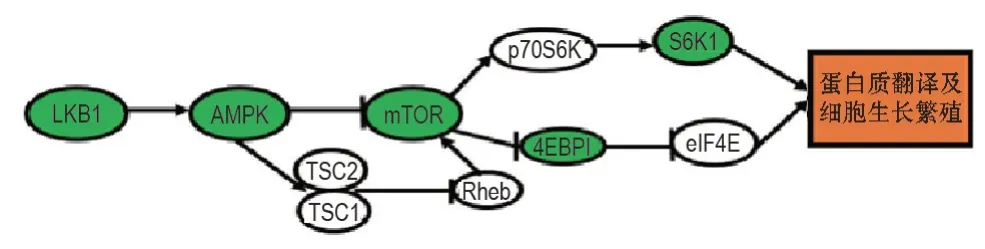
图1 mTOR 信号通路传导途径. LKB1:肝激酶B1;AMPK:AMP 活化蛋白激酶;TSC1/2:结节性硬化复合物1/2;mTOR:哺乳动物雷帕霉素靶点;Rheb:脑中Ras 同源类蛋白;p70S6K:40 S 核糖体蛋白S6 激酶;4EBP1:真核起始因子4E 结合蛋白1;S6K1:核糖体蛋白质S6激酶1;eIF4E:真核翻译启动因子4E. →:激活;⊥:抑制.
当能量短缺时,LKB1 能通过磷酸化激活AMPK-TSC2 进而对mTOR 产生抑制作用,抑制S6K和4EBP1的磷酸化[16-17]。同时,AMPK活性也会对mTOR的调节作用产生影响。Zhou等[18]采用AMPK抑制剂复合物C(Compound C)处理非小细胞肺癌细胞株H1299 细胞后有效阻止了2-脱氧葡萄糖所引起的S6K磷酸化水平减低现象。此外,有研究采用AMPK 激动剂阿卡地新(acadesine,AICAR)处理前列腺癌细胞株C4-2细胞后,p-S6KThr389明显被抑制;而在敲除AMPKa1亚基使AMPK活性丧失后,p-S6K-Thr389又呈现出增加趋势[19]。这些研究进一步说明AMPK 的活性会对mTOR 的调节产生影响。同时,AMPK 活性丧失会失去其针对mTOR的负性调节作用。
有研究发现,当细胞AMP/ATP 比例上升时,AMPK的γ和α亚基分别与AMP和LKB1结合引起构象改变,使AMPK的Thr172磷酸化而激活,进一步使mTOR 的Thr2446磷酸化而抑制其活性。也有研究认为,AMPK 使TSC2 磷酸化,TSC1/TSC2 复合物发生解聚,失去了对mTOR的抑制作用[20](图1)。
3 mTOR信号通路与药物成瘾
药物成瘾分为生理性成瘾和心理性成瘾。生理性成瘾是指成瘾后,对药物进行戒断,初期主要表现以身体不适的戒断症状(withdrawal symptom);而心理性成瘾是指长期戒断主要激发对使用药物的心里渴望或压力诱导下的复发。药物成瘾者针对药物的反复渴求也在一定程度上表明,药物成瘾会对大脑形态及功能产生持久性的影响,进而形成稳定的药物相关记忆。因此,成瘾尤其是心理成瘾也被认为是一种异常牢固病态的学习记忆,即成瘾记忆(addiction memory)[21]。细胞内的2 种mTOR复合体中,mTORC1 在成瘾记忆形成过程起关键作用[22]。本文重点阐述CNS的mTORC1与药物成瘾的关系。
3.1 中枢神经系统中的mTORC1
CNS 中mTORC1 是突触可塑性的关键介体,促进局部树突状蛋白合成,引起激酶参与神经传递,该通路的异常在成瘾等精神疾病的形成中起关键作用[23]。mTORC1 在突触前和突触后调节着突触传递,虽然其过程的分子机制仍不清楚,但它可能依赖于自噬或突触的形成。此外,mTORC1调节谷氨酸能、GABA 能和多巴胺能等神经元的突触功能,表明mTORC1 是控制神经传递的关键[24]。突触可塑性和记忆性的形成需要树突特异性等新的蛋白质合成。mTORC1 在突触处控制mRNA 翻译,在各种学习记忆过程中起重要作用[25]。例如,雷帕霉素对大鼠内侧PFC中mTORC1的局部抑制作用,导致在条件反射训练后的几天内观察到的长期记忆缺乏,而短期药物成瘾记忆不受影响[26]。雷帕霉素对小鼠的空间记忆恢复也有一定影响,当注入大鼠基底外侧杏仁核或背侧海马时,会损害小鼠对新的物体识别功能[27]。此外,mTORC1的激活还与巩固重塑性记忆及药物成瘾有关[28]。上述研究表明,mTORC1在脑的记忆的巩固、重塑性、存储等过程中至关重要。
3.2 mTORC1与药物成瘾研究进展
3.2.1 mTORC1 磷酸化下游效应因子与药物成瘾有关
有研究表明,大鼠单次注射可卡因后1 h,CNS核心脑区NAc,PFC 和腹侧被盖区内S6K1 磷酸化水平提高,而mTORC1 抑制剂雷帕霉素的预处理则降低了S6K1 的磷酸化水平[29]。上述研究表明,mTORC1 信号通路在可卡因药物成瘾脑边缘系统的核心脑区中被激活。mTORC1 的激活似乎是短暂的,因为NAc的S6K1在注射可卡因24 h后并未被磷酸化[30],这与单次腹腔注射四氢大麻酚(tetrahydrocannabinol,THC)后,导致海马中mTORC1活性在药物治疗后4~6 h内迅速增加的实验结果相类似[31]。有趣的是,THC 介导的对mTORC1 的刺激并不局限于海马,因为在纹状体、额叶皮质和杏仁核中也检测到了mTORC1 活性增加[31]。还有文献报道,单次全身给予(腹腔注射)非催眠剂量的酒精可诱导NAc 中mTORC1 的快速激活,表现为其底物S6K1 和4EBP1 的磷酸化水平提高[32]。与先前的发现不同,Gonçalves 等[33]观察到小鼠在急性毒性剂量(30 mg·kg-1)甲基苯丙胺(methamphetamine,MA)给药24 h后,海马mTORC1 活性下降。值得注意的是,可卡因、THC 和酒精3 种依赖性药物虽具有不同的作用靶点,但其在mTORC1 介导的信号通路上似乎有类似作用[34]。因此,这一结果提出了一种可能性,即重复接触滥用药物后产生的一些有害行为可能是通过关键成瘾相关脑区的mTORC1 激活而介导的。如戒酒后NAc 中mTORC1 被激活[33];同样的,在SD 大鼠中,MA 给药后NAc也检测到S6K1磷酸化[34];长期服用THC的小鼠海马中mTORC1 活性也有轻微增加[31]。还有报道,皮下注射吗啡,大鼠NAc 的mTORC1 被激活[35]。
3.2.2 mTORC1与药物成瘾记忆的形成
大量研究表明,多种药物都会使mTORC1 信号通路激活,暴露在药物环境或药物相关线索中也会激活这一途径。有研究表明,在吗啡条件性位置偏爱形成后暴露于吗啡给药箱的大鼠纹状体中mTORC1被激活[36],表明仅仅将动物重新暴露在与药物相关的环境中就会导致mTORC1 激活。Wang 等[37]发现,暴露于可卡因相关线索的动物会在NAc 激活mTORC1 信号通路,与上述研究一致。最近有研究发现,有过量饮酒史的大鼠,在杏仁核中央核、前边缘区和PFC 区域,在酒精相关记忆恢复后,mTOR1被激活[38]。有趣的是,当记忆完全由气味(味觉线索)恢复时,mTORC1只在杏仁核中央核中被激活,而在PFC 及前边缘区并没有激活[38],表明PFC 和前边缘区中mTORC1 的激活在酒精依赖形成的记忆中起重要作用。通过记忆恢复后立即抑制mTORC1 的激活来对抗这种记忆恢复所引起的mTORC1 激活,破坏酒精相关记忆的重新获取,可导致长期抑制复发的结果[38]。这些研究表明,mTORC1在药物成瘾记忆的恢复和再巩固中起着关键作用。
由于觅药行为经常是由药物相关记忆的重摄取导致的,因此,成瘾记忆是药物依赖性明显的特征且是其重要的诱因。在神经元中,S6K1 和4EBP1在细胞体和突触中表达[39],在突触中新蛋白的合成是参与长期神经适应分子机制的一个关键过程[25]。因此,mTORC1可能通过刺激突触5′端聚嘧啶mRNA 的翻译启动而参与药物效应的机制。THC 介导的海马区翻译起始机制的激活部分依赖于mTORC1 的激活[40]。在大量摄入酒精的啮齿动物的NAc 中,mTORC1 表达蛋白水平上调,即使在戒断后24 h 内也能检测到其含量增加;更重要的是,在雷帕霉素预处理后,没有观察到酒精介导其含量增加[33]。这些研究表明,mTORC1介导药物相关的不良神经适应,至少在一定程度上是通过增加特定mRNA的翻译率,从而增加在突触可塑性中起关键作用蛋白质的表达水平。
在吗啡成瘾纳洛酮戒断建立小鼠条件性位置厌恶模型中,针对小鼠进行厌恶记忆再巩固训练活动后,与空白组对比,厌恶记忆模型组小鼠的海马内mTOR、p-mTOR 及其下游S6K1、p-S6K1 蛋白表达量未发生明显改变;而在厌恶记忆再巩固组小鼠海马内mTOR 和S6K1 表达虽未发生明显改变,但p-mTOR 和p-S6K1 蛋白显著升高。同时,该研究还提示,海马中mTOR相关通路会参与到吗啡成瘾戒断后厌恶记忆再巩固的这一具体过程[40]。
在大鼠可卡因自身给药模型,经过消退后给予药物相关线索暴露诱导复燃行为,在大鼠伏隔核微量注射雷帕霉素观察对大鼠复燃行为所产生的影响。实验结果提示,药物线索暴露大鼠伏隔核S6K1 磷酸化水平与未暴露大鼠比较有明显上升,说明药物线索暴露诱导的复燃能有效激活伏隔核的mTOR 信号通路。与此同时,该实验也证实,在伏隔核给予一定的雷帕霉素,能对大鼠自身给药戒断后由药物点燃与药物相关线索诱导的复燃行为产生较明显的抑制作用,这进一步表明mTOR信号通路脑区特异性在自身给药戒断后的复燃行为中也发挥了一定作用[41]。
还有研究通过可卡因诱导的条件位置偏爱模型训练大鼠后,大鼠暴露于训练环境进行消退,并检测相关脑区的mTOR 和S6K1 因子的表达,观察可卡因奖赏性记忆的消退对mTOR 信号通路分子的影响[42],证实了mTOR信号通路在药物奖赏性记忆中的重要作用。
总结上述研究结果发现,首先,可卡因等滥用药物触发不同或交叉的信号通路,但似乎都激活了不同脑区的mTORC1;其次,mTORC1抑制剂雷帕霉素介导抑制小鼠和大鼠多种药物相关行为的形成,表明中枢神经边缘系统中mTORC1 及其介导的通路可能是成瘾药物与其靶点结合的不同信号级联的焦点。mTORC1 信号通路关键调控因子有可能成为治疗药物成瘾有价值的作用靶点。
4 展望
越来越多的研究表明[38-41],mTOR 信号通路参与了各种滥用药物产生欣快和强烈负性情绪的传导机制,使生物体发生适应性的改变,是药物成瘾持续存在的关键因素。调控mTOR 信号转导的具体机制又不甚清楚,需要进一步探索和阐明。因此,深入研究药物成瘾诱导的mTOR信号转导中的详细分子机制是十分必要的,探索mTORC1 及其信号转导功能的变化及其与药物成瘾的相关性具有重要意义。未来的研究可聚焦于彻底阐明mTOR信号通路在药物成瘾中的分子机制,为探索药物成瘾的治疗策略提供理论基础和新的方向。
