SD大鼠胚胎-胎仔发育毒性试验背景数据的建立
2019-12-31贾玉玲崇立明孙祖越
贾玉玲,姜 娟,杨 阳,崇立明,周 莉,孙祖越
(1.上海市计划生育科学研究所药理毒理学研究室,中国生育调节药物毒理检测中心,上海200032;2.国家卫生健康委员会计划生育药具重点实验室,上海200032;3.复旦大学生殖与发育研究院,上海200032)
在药物非临床安全性评价研究中,生殖毒性研究是新药评价重要的一个环节,其中胚胎-胎仔发育毒性实验(即Ⅱ段)是妊娠动物自胚胎着床至硬腭闭合给药,评价药物对妊娠动物、胚胎及胎仔发育的影响。根据人用药物注册技术要求国际协调会(International Council for Harmonization,ICH)(S5)[1]和国家食品药品监督管理总局(China Food and Drug Administration,CFDA)[2]的指导原则,该研究推荐的啮齿类动物为大鼠,但由于大鼠品系、个体差异、来源、实验室条件和测定方法及测量仪器不同等因素,其基本生物学数据有一定的差异,为使我们的实验数据解释建立在客观、可靠、准确的基础上,可以为药物生殖毒性非临床安全性评价提供科学的依据,故各实验室在研究开展前需要具备一套完整、清晰的背景数据,以保证实验系统的正确和数据的可靠。为此,本文总结了2010-2018年在上海市计划生育科学研究所(中国生育调节药物毒理检测中心)完成的10项SD大鼠胚胎-胎仔发育毒性试验,对溶媒对照组在内的共计217 只孕鼠和2506只胎仔的数据进行收集和统计分析,初步建立了本中心大鼠胚胎-胎仔发育指标的背景数据,为药物生殖毒性安全评价的开展和结果判断提供重要数据支持。
1 材料与方法
1.1 动物和仪器
Sprague-Dawley(SD)雌性大鼠,SPF 级,60~80 日龄,健康性成熟未经交配生育的大鼠,体质量180~250 g(为开始交配时体质量),由上海市西普尔-必凯实验动物有限公司提供,动物生产许可证号SCXK(沪)2008-0016 和SCXK(沪)2013-0016。SD 大鼠在上海市计划生育科学研究所(中国生育调节药物毒理检测中心)SPF 级动物房内饲养(SYXK[沪]2008-0027 和SYXK(沪)2013-0027)。室温20~26℃,相对湿度40%~70%,光照12 h,黑暗12 h;实验开始前动物适应性饲养至少5 d;塑料笼大小为400 mm×350 mm×200 mm,妊娠期间单笼饲养;自由饮水、摄食。PL-1501/S-01 电子天平和MS4002TSDR/00 电子天平(Mettler Toledo,瑞士);Motic 体视显微镜(Olympus Corporation,日本)。
1.2 动物交配
大鼠接收后检疫并适应性饲养5 d。在达到交配体质量要求后,雌鼠、雄鼠按2∶1(或1∶1)合笼交配,于当日下午16∶00 合笼,次日上午8∶00 以后阴道涂片检查,查到精子或阴栓确定为妊娠当天(gestation day 0,GD0),第2 天为妊娠GD1,以此类推。
1.3 体质量和摄食量测定
孕鼠于GD0,GD3,GD6,GD10,GD13,GD15,GD18和GD20测定 体 质量并 记录;记 录GD0-1,GD6-7,GD13-14和GD19-20的摄食量。
1.4 剖宫检查孕鼠
GD20安乐死母鼠取出胎仔,检查黄体数、胎重(连子宫)、胎盘重、活胎数、死胎数(含吸收胎)、胎仔性别、胎重、身长、尾长及每只胎仔的外观、内脏和骨骼,并数出着床数;将每窝1/2 胎鼠放入Bouin液固定,进行内脏检查。另1/2进行骨骼检查,首先将胎鼠去皮、去脂、去内脏,分别放入阿利新蓝和茜素红染液中染色,透明液Ⅰ和透明液Ⅱ分别透明胎仔骨骼。
1.5 胎仔的外观检查
对每只胎仔先经肉眼检查,肉眼不能确定的畸形,在体视显微镜下确定。观察指标包括:脑积水、露脑、脑疝、脑膜膨出、无眼、小眼、无耳和腭裂;多趾、并趾、少趾、无趾、足内翻和短趾;脐疝、腹裂、脊髓膨出、脊柱裂和脊柱侧突;短尾、卷尾、无尾和尾分叉;肛门闭锁。
1.6 胎仔的骨骼检查
头颅完整程度和骨化程度;胸骨节缺失、骨化不全、双骨化点、胸骨节错位、多肋、少肋、肋骨分叉、肋融合、波状肋;四肢骨骨化不全、粗短、畸形、多趾和少趾等。
1.7 胎仔的内脏器官检查
腭裂、舌异常、鼻道扩大、单鼻道、脑水肿、肾积水;眼球是否正常;心、肝、脾、肺、肾和子宫等脏器大小和位置。
1.8 统计学分析
采用SPSS19.0统计软件对各项指标数据进行正态性分布检验,计算,确定95%可信区间和变异系数(coefficient of variation,CV)CV=s/x×100%。
2 结果
2.1 孕大鼠妊娠期体质量和摄食量的变化
妊娠期间母体的状况如体质量和摄食量异常会直接影响胚胎的发育,因此母体的体质量和摄食量数据可以提供最直接和清晰的关于母体毒性的评估。对妊娠动物,宫外增重是比体质量更加敏感的指标。在大鼠胚胎-胎仔发育毒性试验中,测得孕大鼠妊娠各时期的体质量和摄食数据见表1 和表2。孕大鼠GD0的体质量为(222±22)g,GD20为(353±30)g。GD0-1为每只(18.9±3.8)g·d-1,GD19-20为每只(26.2±4.0)g·d-1。妊娠期体质量和摄食量随妊娠时间的增加而稳定增加。孕大鼠宫外增重GD20-GD6-胎重(连子宫)为(35.2±10.7)g。
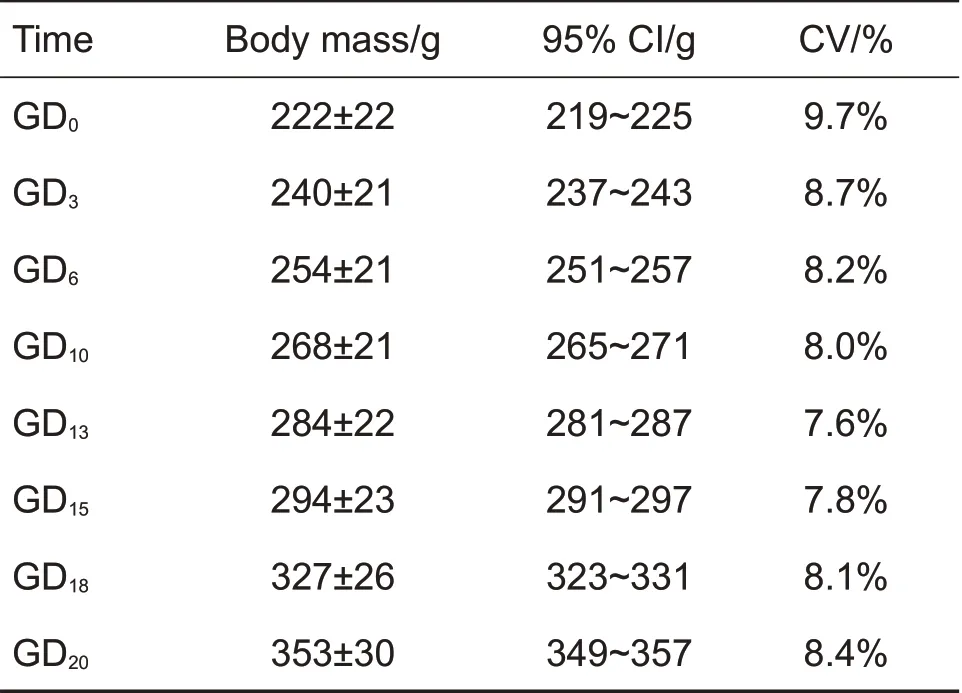
Tab.1 Body mass of pregnant rats on different gestation days(GD)
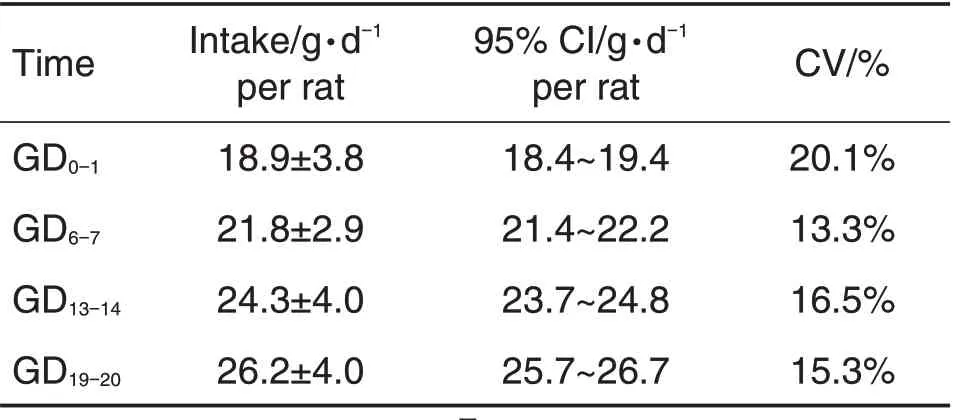
Tab.2 Food consumption of pregnant rats on different GD
2.2 SD孕鼠生殖功能和胎仔的生长发育指标
GD20处死孕大鼠后,取出胎仔,检查黄体数、胎重(连子宫)、胎盘重、活胎数和死胎数(含吸收胎),测量胎仔身长和尾长,检测各项指标的数据见表3和表4。研究中有228 只雌鼠交配成功,有效妊娠数为217 只,妊娠率为95.2%;剖检结果显示,2561 例着床成功,其中活胎2506 例,吸收胎54例,死胎1 例。胎仔的发育指标中,胎盘重为(0.5±0.1)g,变异系数偏高为16.4%,由于个别孕大鼠妊娠的胎仔数少,导致宫内的胎仔发育较好,胎盘较大;胎仔体质量为(3.6±0.3)g,身长为(35.7±1.5)mm和尾长为(12.9±0.4)mm,变异系数较低,表明胎仔的发育比较稳定。
2.3 胎仔外观、内脏和骨骼检查指标
在本中心检查胎仔的外观、内脏和骨骼发现,有4只胎仔出现外观异常,分别为皮下出血(2例)、头部淤血(1例)和细尾短小(1例);胎仔的内脏检查发现6 只胎仔的肾皮质和肾髓质出现棕色;胎仔的骨骼检查主要表现为顶骨骨化不全33例,枕骨异常11例(其中枕骨骨化不全3例,枕骨Ⅰ级7例和枕骨Ⅱ级1例),胸骨异常4例(其中胸骨轻度裂开2例,胸骨发育不全偏位2 例),肋骨异常3 例(其中双侧肋骨与胸骨连接处不对称2 例,与胸骨相连肋软骨缺失1例),胸椎异常2例(其中第10胸椎点状缺失1 例,第5-13 胸椎部分缺失1 例),腰椎部分缺失1例,骶椎异常2例(其中第4骶椎骨化不全1例,部分缺失1例),尾椎异常3例(其中第2尾椎不对称骨化1例,第1尾椎左右侧多骨化点2例)(表5和图1)。
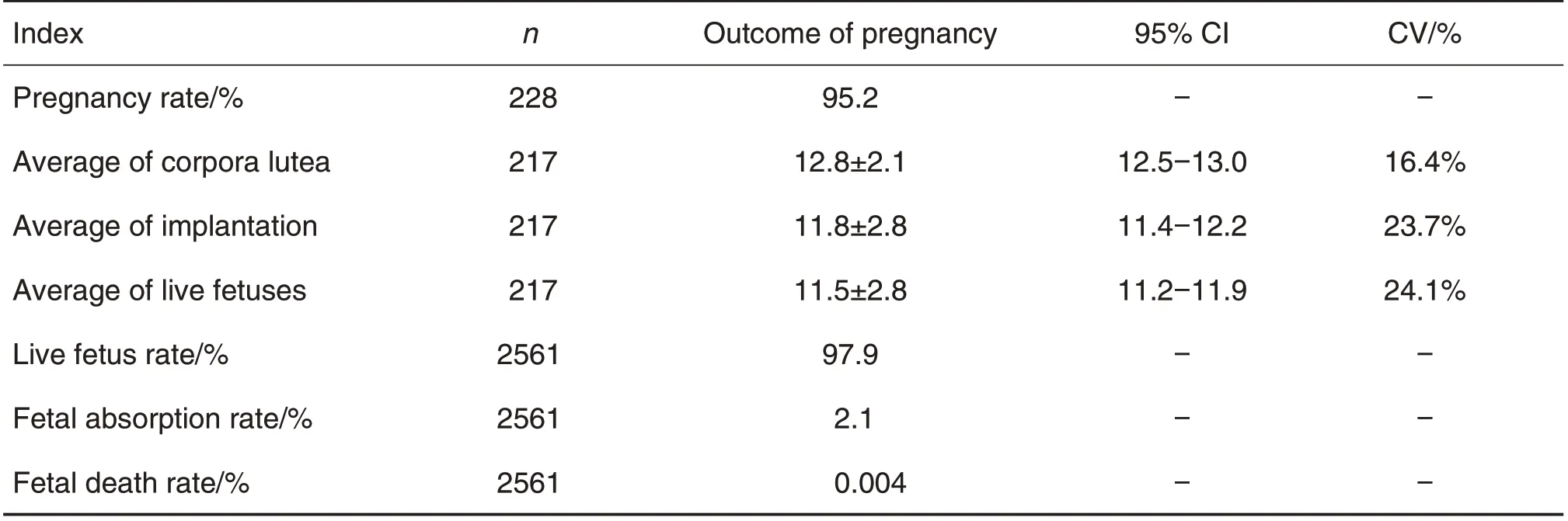
Tab.3 Reproductive index of pregnant rats at endpoint of experiment
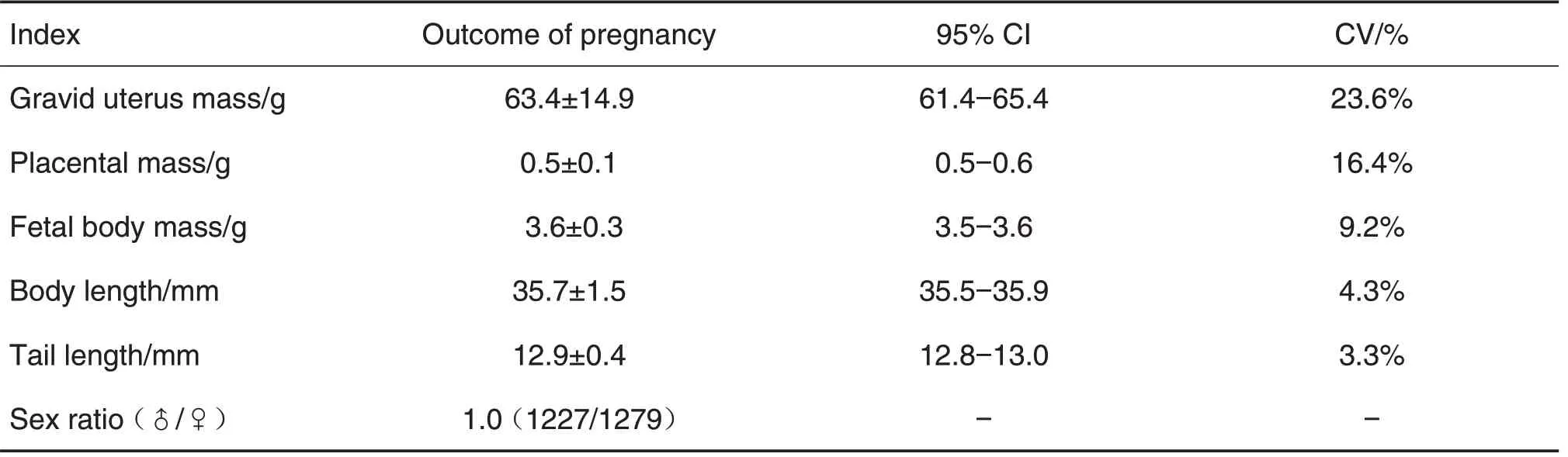
Tab.4 Growth and development index of fetuses on cesarean section day
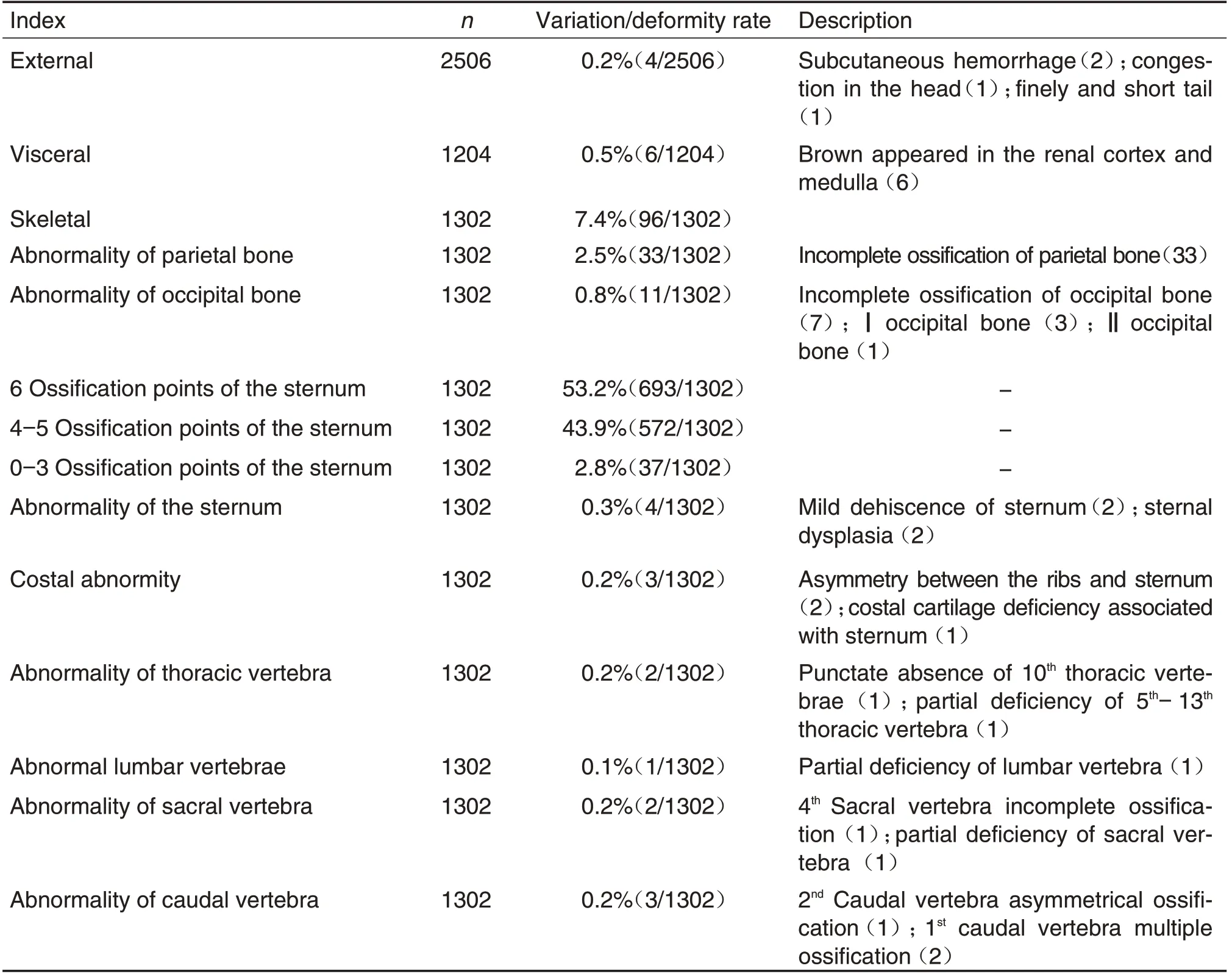
Tab.5 Examination of fetal appearance,viscera and skeleton
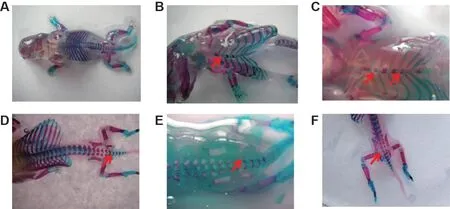
Fig.1 Variation of skeletal development in fetuses. A:normal rat fetus;B:sternebra incomplete ossification;C:2nd and 5th sternebra asymmetrically dumbbell-shaped;D:2nd caudal vertebra asymmetrical ossification;E:1st caudal vertebra multiple ossification;F:4th sacral vertebra incomplete ossification.
3 讨论
在药物开发过程中,生殖毒性研究的目的是通过动物试验反映受试物对哺乳动物生殖功能和发育过程的影响,预测其可能产生的对生殖细胞、受孕、妊娠、分娩和哺乳等亲代生殖功能的不良影响,以及对子代胚胎-胎儿发育、出生后发育的不良影响。其中胚胎-胎仔发育毒性实验(即Ⅱ段)是妊娠动物自胚胎着床至硬腭闭合给药,评价药物对妊娠动物、胚胎和胎仔发育的影响。
实验动物被称为“活的试剂”,国内外公认其质量标准化直接影响科学研究水平的高低。药物安全性评价中,药物对SD大鼠胚胎-胎仔发育毒性实验的评价是通过实验组与对照组的妊娠体质量、摄食量、妊娠大鼠的生殖功能、胎仔的生长发育、胎仔的内脏和骨骼发育以及子宫平滑肌张力等指标的对比来研究毒性的作用部位、方式、损害性质与程度。而获得正常的妊娠条件下的相关背景数据对实验数据分析非常重要。
胚胎-胎仔发育毒性试验中,在缺乏解剖学、组织病理学评估和器官重量测量的情况下,妊娠体质量和摄食量数据可以提供最直接和清晰的关于母体毒性的评估。本GLP实验室的SD孕大鼠GD0体质量为(222±22)g,GD20为(353±30)g,而孔卫青[3]和叶向峰等[4]研究的SD 孕大鼠GD0体质量分别为229±20 和(248±25)g,GD20分别为380±34和(400±35)g。体质量的测量结果可以用来区分其是来自给药操作、应激还是药物毒性的影响。由于灌胃等适口性改变而引起的摄食降低,继发体质量降低现象[5]需要与摄食指标结合,以及自身实验室建立的背景数据进行综合分析。本GLP 实验室也测量了孕大鼠每周的摄食量,观察到摄食量随孕期增长而逐渐增加,这与孔卫青等[3]研究一致。对于妊娠动物来说,增重相比体质量来说是更加敏感的指标,可以发现早期短暂性的体质量减轻以及停药后可能的恢复性增加现象。
黄体数、着床数、活胎数、吸收胎数和死胎数等指标是衡量胚胎早期和晚期发育毒性的重要指标,本GLP实验室SD孕大鼠平均黄体数为(12.8±2.1)个,平均着床数为(11.8±2.8)个,平均活胎数为(11.5±2.8)只,活胎率为97.9%,而孔卫青[3]和叶向峰等[4]的研究SD 孕鼠平均黄体数分别为15.6±2.8和(15.5±2.5)个,平均着床数分别为13.6±3.7 和(14.2±3.2)个,平均活胎数分别为12.8±3.7 和(13.4±3.5)只,活胎率分别为93.96%和97.8%。通过对比发现,各研究机构孕大鼠的平均黄体数、着床数和活胎数未见明显差异。
胎仔、胎盘重、体长和尾长是评价药物对胎仔的生长发育是否产生毒性的指标[6]。本GLP 实验室胎仔发育指标中体长为(35.7±1.5)mm,尾长为(12.9±0.4)mm;而孔卫青[3]和叶向峰等[4]的研究报道,胎仔体长分别为37.17±1.14和(33.8±2.4)mm,尾长分别为13.17±0.79 和(13.6±1.2)mm。对比发现,本实验室与孔卫青[3]和叶向峰等[4]的研究有轻微的差异,因为实验动物品系、个体差异、来源、实验室条件和测定方法及测量仪器不同等影响因素,均会产生不同的测量结果,故需不断地动态观察以积累数据。因此,建立实验室内部的实验背景数据可有效确保实验系统的可靠性,为数据分析提供有力证据。
对胎仔进行外观、内脏及骨骼检查是进一步评价药物对胎仔是否产生毒性的方法。本GLP 实验室活胎仔检查中,外观变异率为0.2%,内脏变异率为0.5%,骨骼变异率为7.4%。对所有胎仔进行外观检查时应按一定顺序,如从头部到尾部的顺序,必要时可使用辅助工具如放大镜或显微镜。至少应对50%大鼠胎仔进行内脏检查,应按照一定顺序,一般从胸腔器官开始依次检查至尾端。骨骼检查前为了便于观察应使骨骼或软骨染色,常用染色方法有茜素红单染法和茜素红-阿利新蓝双染法,因茜素红主要对骨化骨进行染色,阿利新蓝主要对软骨进行染色,因此双染法对于评价骨化骨和软骨来说是最佳选择[7]。
胚胎-胎仔发育毒性试验各指标背景数据的建立是药物非临床安全性评价的重要积累和评价基础,通过自身实验室需要不断扩大自身的背景数据库,使实验数据解释建立在客观、可靠、准确的基础上,从而可以更加准确地判定药物毒性反应,为生殖毒性安全性评价提供更多参考。
