六价铬激活mTOR蛋白诱导大鼠急性肾损伤
2019-12-31张英进宋梅芳易宗娓张在其申向东
张英进,宋梅芳,易宗娓,张在其,申向东,费 嫦,杨 渊
(1.中南大学湘雅二医院中西医结合科,湖南 长沙410011;2.湖南医药学院检验医学院,侗医药湖南省重点实验室,湖南 怀化418000;长治医学院附属和平医院3.肾内科,4.病理科,山西 长治046000)
六价铬〔hexavalent chromium,Cr(Ⅵ)〕是一种强上皮刺激物和致癌物,广泛存在于铬冶炼、电镀、染料、油漆颜料和皮革鞣制的工业废水中,可转移到土壤或农作物[1]。研究表明,肾上皮细胞对Cr(Ⅵ)的毒性反应比肝上皮细胞更为敏感,肾可能是Cr(Ⅵ)致机体中毒的主要作用靶点[2]。动物实验表明,Cr(Ⅵ)可诱导成年大鼠急性肾损伤(acute kidney injury,AKI),表现为肾小管上皮细胞损伤、细胞凋亡、氧化应激和炎症因子水平升高[3]及AKI生物标志物如中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)[4]和肾损伤分子1(kidney injury molecule 1,Kim-1)[5]升高。AKI 如未得到及时治疗,可快速进展至终末期肾病,具有高死亡的潜在风险[6]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路是调节细胞生长和增殖的重要信号通路,可于AKI后激活,参与肾组织炎症及纤维化进程[7]。近来发现,mTOR通路的激活与Cr(Ⅵ)的毒性效应有关。例如,Cr(Ⅵ)可诱导小鼠肺组织中mTOR 信号通路上游信号丝氨酸/苏氨酸蛋白激酶(serine/threonine kinase,Akt)的磷酸化激活[8];雷帕霉素(rapamycin,Rap,西罗莫司)可诱导自噬,减轻Cr(Ⅵ)诱导的肝细胞线粒体损伤[9]。研究表明,Rap在缺血性AKI中具有抑制肾小管细胞增殖、延迟肾损伤修复的作用,在顺铂诱导的AKI 中具有诱导细胞自噬和减轻肾损伤的双重效应[10]。迄今,Cr(Ⅵ)诱导AKI 与mTOR 信号通路的关系研究报道较少,而Rap 作为mTOR 信号通路抑制剂,是否可对Cr(Ⅵ)诱导的AKI 产生拮抗效应尚不清楚。另外,N-乙酰基-L-半胱氨酸(N-acetyl-L-cysteine,NAC)是一种常用的抗氧化剂,研究证实,NAC 可清除体内活性氧自由基,发挥肾保护效应[11]。本研究拟探讨Cr(Ⅵ)诱导的大鼠AKI 作用、mTOR 通路变化特征以及Rap 或NAC 对大鼠AKI 的干预效应。
1 材料与方法
1.1 药物、主要试剂和仪器
Cr(Ⅵ)化合物铬酸钠(Na2CrO4)〔简称Cr(Ⅵ)〕(天津风船化学试剂有限公司,纯度≥99.7%);Rap和NAC(大连美仑生物技术有限公司);血清肌酐(serum creatinine,Scr)和NGAL ELISA 试剂盒(上海酶联生物科技有限公司);谷胱甘肽(glutathione,GSH)和丙二醛(malondialdehyde,MDA)测定试剂盒(南京碧云天生物技术有限公司);兔抗大鼠磷酸化mTOR(phospho-mTOR,p-mTOR)多克隆抗体(PAB25827,英国Abnova 公司);兔抗大鼠磷酸化-p70 核糖体蛋白S6 激酶(phosphorylated p70 ribosomal protein S6 kinase,p-p70S6K)多克隆抗体(MBS462099,美国MyBioSource 公司);兔抗大鼠活化的胱天蛋白酶3 多克隆抗体(AB3623,德国Merck Millipore公司);抗大鼠β肌动蛋白单克隆抗体和山羊抗兔辣根过氧化物酶IgG 抗体(K200058M,北京索莱宝科技有限公司)。Chemi-Doc Touch Imaging 蛋白电泳免疫印迹系统(美国Bio-Rad 公司);M200 PRO 多功能酶标仪(瑞士Tecan公司);Eppendorf 5810R台式高速冷冻离心机(德国Eppendorf公司)。
1.2 动物
42 只雄性SD 大鼠,10~11 周龄,体质量274~306 g,由湖南长沙斯莱克实验动物有限公司提供,合格证号SCXK(湘)2014-0002,饲养于SPF 级动物实验室,室温20~24℃,相对湿度50%~70%,昼夜明暗交替12 h/12 h,自由摄食饮水。
1.3 动物分组和药物处理
大鼠随机分为7组:正常对照组(单次ip给予生理盐水,2 mL·kg-1);Cr(Ⅵ)处理组〔单次ip给予Cr(Ⅵ)5或10 mg·kg-1〕[12];Rap干预组〔隔日1次(共4次)ip 给予Rap 2 mg·kg-1,末次给药6 h 后,单次ip 给予Cr(Ⅵ)5 或10 mg·kg-1〕[13];NAC 干预组〔连续3 d,每日1次(共3次)ip给予NAC 300mg·kg-1,末次给药6 h后,单次ip给予Cr(Ⅵ)5或10 mg·kg-1〕[14]。Cr(Ⅵ)处理48 h后,收集血液和尿液,乙醚麻醉处死大鼠,称取体质量和肾质量,计算肾系数〔肾系数=肾质量(g)/体质量(g)×100〕;肾组织用PBS冲洗后置于-20℃备用。
1.4 ELlSA法检测大鼠Scr和尿NGAL水平
将尿液样品以4℃,400×g离心5 min,取上清液,按试剂盒说明书步骤检测尿中NGAL水平。血液样品经4℃、1000×g离心10 min取上清液,按试剂盒说明书步骤检测Scr水平。
1.5 HE染色观察肾小管病理损伤
取部分1.3收集的肾皮质,经4%多聚甲醛固定72 h 后,用石蜡包埋,制备5 μm病理切片,常规HE染色。在显微镜下观察肾小管病理变化,每张切片随机选择10个视野,采用AutoCAD软件计算损伤面积百分比(即肾小管损伤面积占视野面积百分比)[15]。
1.6 紫外分光光度法检测肾皮质GSH和MDA含量
将1.3 收集的肾皮质组织以1∶9(m/V)加入PBS 进行匀浆,组织匀浆液经过3 次冻融以裂解细胞后,经1000×g,4℃离心5 min,收集上清液。参照试剂盒说明书操作,用紫外分光光度法测定每克肾组织中GSH或MDA含量。
1.7 Western印迹法检测肾皮质p-mTOR、p-p70S6K和活化胱天蛋白酶3表达水平
将1.3收集的肾皮质加入100 μL细胞裂解液以充分裂解组织细胞,4℃,3000×g 离心5 min 取上清,用BCA 法测总蛋白浓度;总蛋白加上样缓冲液混匀,煮沸变性,SDS-聚丙烯酰胺凝胶电泳,湿法转膜,5%脱脂奶粉室温摇床封闭2 h;加一抗〔p-mTOR(1∶1000)、p-p70S6K(1∶1500)、活化的胱天蛋白酶3(1∶800)、β肌动蛋白(1∶400)〕;4℃下孵育16 h,TBS-T 洗膜3 次,每次10 min;室温下用二抗(1∶10 000)孵育2 h;洗膜后加ECL 化学发光试剂显影,凝胶成像仪采集图像,积分吸光度(integral absorbance,IA)采用LI-COR Odyssey图像处理软件定量分析,以目的蛋白与内参蛋白IA值的比值表示目的蛋白的相对表达水平。
1.8 统计学分析
应用SPSS 21.0统计软件进行数据统计分析,实验结果数据用表示。组间统计学差异比较运用单因素方差分析及t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 Rap和NAC对Cr(Ⅵ)诱导AKl大鼠肾质量和肾系数的影响
如表1 所示,与正常对照组比较,Cr(Ⅵ)10 mg·kg-1组大鼠肾质量和肾系数明显增加(P<0.05),Cr(Ⅵ)5 mg·kg-1组差异无统计学意义。与Cr(Ⅵ)10 mg·kg-1组相比,Rap+Cr(Ⅵ)10 mg·kg-1组肾质量明显降低(P<0.05),肾系数差异无统计学意义;而NAC+Cr(Ⅵ)10 mg·kg-1组体质量、肾质量和肾系数变化均无统计学意义。
2.2 Rap 和NAC 对Cr(Ⅵ)诱导AKl 大鼠Scr 和尿NGAL及肾皮质GSH和MDA含量的影响
如表2 所示,与正常对照组相比,不同剂量Cr(Ⅵ)组大鼠Scr、尿NGAL和MDA水平均明显升高(P<0.05),肾皮质GSH含量明显降低(P<0.05)。分别与同剂量Cr(Ⅵ)处理组相比,Rap干预组Scr、尿NGAL和MDA水平明显下调(P<0.05),GSH含量明显升高(P<0.05);NAC 干预组Scr 和MDA 水平明显下调(P<0.05),GSH含量明显升高(P<0.05),而尿NGAL 水平无明显差异。分别与NAC+Cr(Ⅵ)5 mg·kg-1组或NAC+Cr(Ⅵ)10 mg·kg-1组比较,Rap+Cr(Ⅵ)5 mg·kg-1组或Rap+Cr(Ⅵ)10 mg·kg-1组Scr和GSH水平明显较低(P<0.05),而尿NGAL和MDA水平差异无统计学意义。
2.3 Rap和NAC对Cr(Ⅵ)诱导AKl大鼠肾皮质病理结构的影响
HE染色结果显示(图1),不同剂量Cr(Ⅵ)组大鼠肾小管组织细胞呈空泡样改变、肿胀破裂,管腔内红染等病理改变,肾小管损伤面积百分比分别为(36.5±4.5)%和(46.3±5.2)%,明显高于正常对照组(1.9±0.35)%(P<0.05)。分别与同剂量Cr(Ⅵ)组比较,Rap或NAC干预组肾小管上皮细胞出现颗粒样变或空泡样变性程度均明显减轻,肾小管损伤面积百分比分别显著降低(P<0.05)。与NAC干预组相比,Rap干预组肾小管损伤面积百分比明显降低(P<0.05)。
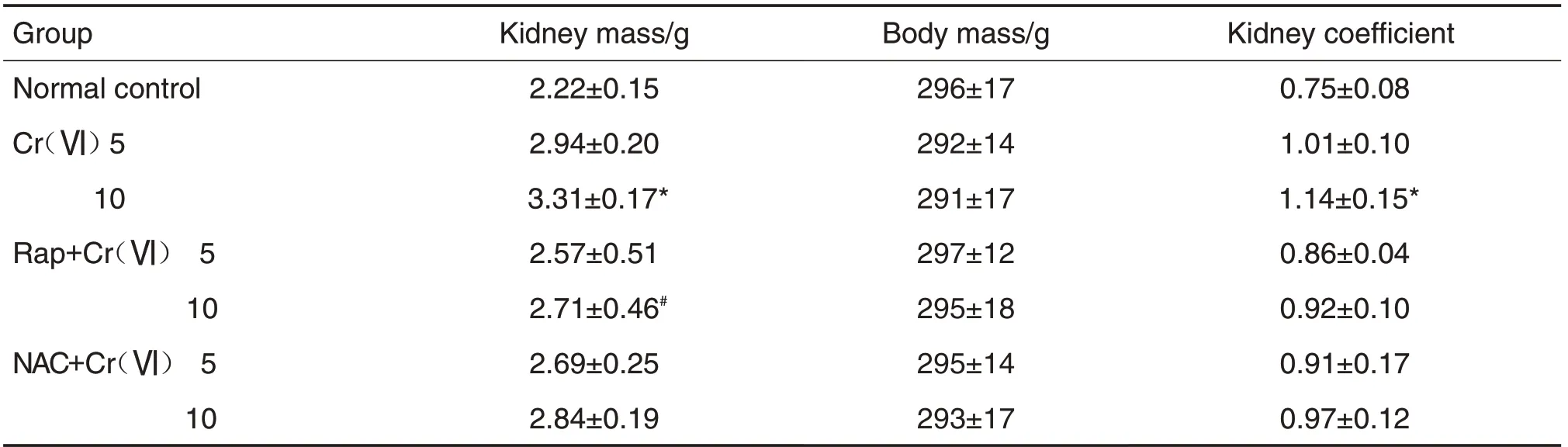
Tab.1 Effect of rapamycin(Rap)and N-acetyl-L-cysteine(NAC)on kidney mass and kidney coefficient of hexavalent chromium〔Cr(Ⅵ)〕-induced acute kidney injury(AKl)in rats

Tab.2 Effect of Rap and NAC on neutrophil gelatinase-associated lipocalin(NGAL),glutathione(GSH),malondialdehyde(MDA)and serum creatinine(Scr)in Cr(Ⅵ)-induced AKl in rats
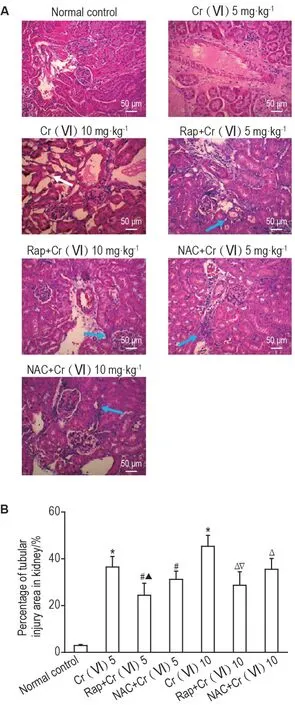
Fig.1 Effect of Cr(Ⅵ)on histopathology and tubular injury areas of renal tissues in rats (HE staining). See Tab.1 for the rat treatment. A:HE staining depicting renal tissue morphology. White arrow indicates the characteristics of vacuolated changes, swelling or rupture occurred in tubular epithelial cell cytosolis; blue arrows indicate the characteristics of granular degeneration or balloon like changes in tubular epithelial cells.Nuclei were dyed blue,cytoplasm and extracellular matrix dyed to different shades of red. B was the semi-quantitative result of A. Percentage of renal tubular injury area (%)=tubular injury area/total area of view fields×100%. n=6. *P<0.05, compared with normal control group;#P<0.05,compared with Cr(Ⅵ)5 mg·kg-1 group;△P<0.05,compared with Cr(Ⅵ)10 group;▲P<0.05,compared with NAC+Cr(Ⅵ)5 mg·kg-1group;▽P<0.05,compared with NAC+Cr(Ⅵ)10 mg·kg-1 group.
2.4 Rap 和NAC 对Cr(Ⅵ)诱导AKl 大鼠肾皮质p-mTOR、p-p70S6K 和活化的胱天蛋白酶3 水平的影响
与正常对照组相比,不同剂量Cr(Ⅵ)组大鼠p-mTOR、p-p70S6K和活化的胱天蛋白酶3表达水平明显升高(P<0.05)。分别与同剂量Cr(Ⅵ)处理组相比,Rap 干预组或NAC 干预组大鼠p-mTOR、p-p70S6K 和活化的胱天蛋白酶3 表达水平均明显降低(P<0.05)。与NAC 干预组相比,Rap 干预组大鼠p-mTOR、p-p70S6K和活化的胱天蛋白酶3表达水平明显降低(P<0.05)(图2)。
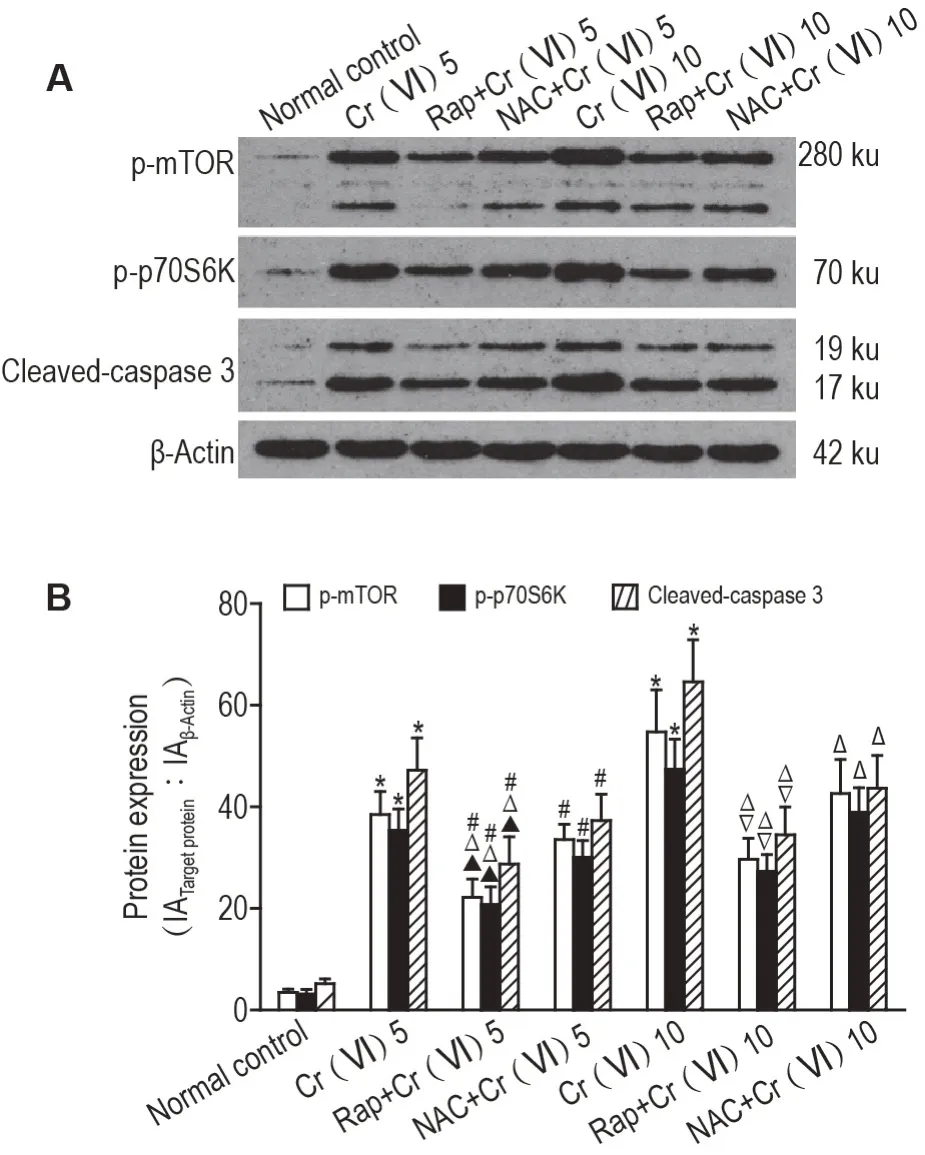
Fig.2 Effect of Cr(Ⅵ)on protein expressions of phosphorylated mammalian target of rapamycin(p-mTOR), phosphorylated-p70 ribosomal protein S6 kinase (p-p70S6K) and cleaved-caspase 3 in renal cortiex. See Tab.1 for the rat treatment.B was the semi-quantitative result of A. IA:integrated absorbance. n=6.*P<0.05,compared with normal control group;#P<0.05,compared with Cr(Ⅵ)5 mg·kg-1 group;△P<0.05,compared with Cr(Ⅵ)10 group;▲P<0.05,compared with NAC+Cr(Ⅵ)5 mg·kg-1 group;▽P<0.05,compared with NAC+Cr(VI)10 mg·kg-1 group.
3 讨论
文献报道,Cr(Ⅵ)可诱导大鼠AKI,主要表现为Scr和血清尿素氮水平升高,抗氧化剂GSH、谷胱甘肽过氧化物酶、过氧化氢酶和超氧化物歧化酶水平降低,以及促凋亡酶胱天蛋白酶3 激活[16]。AKI 肾组织病理特点以肾小管损伤为主,表现为肾小管管腔变小、管型形成,刷状缘微绒毛损坏或脱落,肾小管上皮细胞出现浊肿、变性和坏死等特征[17]。一些研究发现,非特异性β-肾上腺素能受体阻滞剂卡维地洛(carvedilol)[16]和抗氧化剂硒[18]可恢复肾组织抗氧化物和线粒体呼吸酶活性,降低肾组织脂质过氧化水平,从而减轻Cr(Ⅵ)导致的肾毒性。另一些研究发现,mTOR通路抑制剂依维莫司(everolimus)或钙调素依赖性蛋白激酶Ⅳ通过诱导自噬激活,在顺铂、缺血再灌注或内毒素血症导致的AKI中具有保护作用[19-20]。近年来发现,Rap是mTOR信号通路抑制剂,在顺铂诱导的AKI中,Rap可通过增加肾皮质组织中自噬小体标记蛋白LC3-Ⅱ表达水平,激活肾组织细胞自噬而发挥AKI保护作用[21];在衣霉素(tunicamycin)诱导的肾小管上皮细胞内质网应激模型中,Rap 可通过抑制蛋白激酶R 类似内质网激酶、真核起始因子2α 磷酸化激活,抑制CCAAT/增强子结合蛋白同源蛋白和葡萄糖调节蛋白78 的活化,从而抑制肾小管上皮细胞凋亡,促进细胞存活[22]。目前,mTOR信号通路与Cr(VI)诱导急性肾毒性的关系及Rap 在其中扮演的角色尚不清楚。
本研究发现,Cr(Ⅵ)5 和10 mg·kg-1均可诱导大鼠AKI 和mTOR 通路激活,表现为Scr 和尿NGAL 水平、肾小管损伤面积百分比、肾组织p-mTOR、p-p70S6K和活化的胱天蛋白酶3表达水平明显升高。而Rap或NAC预处理均可使Cr(Ⅵ)诱导AKI 程度明显减轻,表现为上述指标明显下调。此外,Rap 干预组与NAC 干预组比较,前者Scr、肾小管病理损伤面积百分比、肾组织p-mTOR、p-p70S6K 和活化的胱天蛋白酶3 表达水平明显低于后者,氧化应激标志物MDA 水平差异无统计学意义。结果提示,Cr(Ⅵ)可诱导大鼠肾组织mTOR通路磷酸化和胱天蛋白酶3依赖的细胞凋亡途径激活,Rap或NAC预处理对上述改变具有明显抑制效应,而相比于NAC,Rap 对Cr(Ⅵ)肾毒性的拮抗效应更明显。
mTOR 通路属于细胞内Akt 信号通路,一些功能蛋白如AMP活化的蛋白激酶、胰岛素样生长因子1和转录因子p53等可诱导mTOR通路激活,从而促进细胞周期G到S期的转化,促进细胞增殖与抑制细胞自噬。而抑制mTOR通路蛋白活性,可抑制下游靶蛋白p70S6K 和真核起始因子4E 结合蛋白1磷酸化激活,导致基因—蛋白质翻译减少,从而抑制细胞增殖和激活细胞自噬[23-24]。有文献报道,Rap 可抑制mTOR 信号通路和激活细胞自噬,对Cr(Ⅵ)诱导的体外肝细胞毒性具有保护作用[10]。本研究发现,Cr(Ⅵ)可诱导AKI和引起mTOR通路激活,Rap 干预可抑制mTOR 通路蛋白磷酸化激活,有效拮抗Cr(Ⅵ)诱导的AKI,且Rap 组的肾损伤改善效应优于NAC干预组。研究还发现,Rap干预组和NAC干预均表现出抗氧化应激效应,可明显逆转Cr(Ⅵ)导致的GSH 减少和MDA 升高。该结果提示,NAC 预处理可明显提高大鼠体内GSH 水平,降低Cr(Ⅵ)导致大鼠肾组织脂质过氧化应激反应,而Rap干预的抗氧化应激可能与细胞内质网应激调控有关。既往研究表明,Rap 干预可通过减少一氧化氮和超氧化物生成,抑制内质网促凋亡分子CHOP 的活性,减少细胞内细胞色素c 释放和保护线粒体功能,对小鼠心肌缺血再灌注损伤具有保护作用[25]。
综上,本研究证实,Cr(Ⅵ)可诱导大鼠AKI 及mTOR通路激活,Rap干预可有效拮抗Cr(Ⅵ)导致的AKI。推测Rap 抑制mTOR 通路激活和调控细胞内质网应激,上调肾组织细胞自噬水平和改善内质网应激诱导的促凋亡效应可能是其拮抗Cr(Ⅵ)急性肾毒性的分子机制。目前,Cr(Ⅵ)诱导大鼠AKI 过程中Rap 对mTOR 通路与细胞内质网应激通路上、下游因子的影响,以及Rap 干预后肾小管组织细胞自噬水平的动态特征有待进一步探讨。
