莱菔硫烷对糖尿病及脂肪肝病的调控作用研究进展
2019-12-31张英春田思聪李宝龙单毓娟
孙 瑶,张英春,田思聪,李宝龙,单毓娟
(1.哈尔滨工业大学化工与化学学院食品科学与工程系,黑龙江 哈尔滨150001;2.黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨150040)
莱菔硫烷(sulforaphane,SFN)是一种异硫氰酸盐类植物化学物,以前体物硫代葡萄糖苷的形式富含于西兰花、卷心菜和甘蓝等十字花科蔬菜中,在西兰花中含量最高[1]。前期研究表明,SFN 在抗癌、抗氧化和抗炎等方面具有显著的调控作用。近年国内外研究提示,SFN对糖脂代谢相关性疾病也有一定改善作用。糖尿病是一种以高血糖为特征的糖代谢紊乱性疾病,可分为1型糖尿病(type 1 diabetes mellitus,T1DM)、T2DM、妊娠糖尿病和其他类型糖尿病,以T2DM 最为普遍。2011 年,世界糖尿性病患者多达3.66 亿人,预计到2030 年将达到5.56亿。糖尿病伴随多种并发症,如糖尿病性肾病(diabetic nephropathy,DN)和心脑血管疾病等,致死率高[2]。脂肪肝病是目前世界上最常见的脂代谢疾病,发病人群趋于低龄化,致病机制复杂,可引发肥胖和T2DM。全球因长期饮酒造成酒精性脂肪肝病,最终导致因肝损伤死亡的人数高达3.8%,因非酒精性脂肪肝导致的肝硬变及肝癌的患病率是20%~30%,在我国,其发病率位于慢性肝病的第二位,仅次于病毒性肝炎[3]。糖尿病和脂肪肝病严重威胁人类健康,甚至危及生命。本文对近年来SFN与糖尿病及脂肪肝病研究的国内外文献进行梳理,旨在挖掘和拓宽食源性生物活性成分的新功能和应用,并为糖尿病和脂肪肝病的防治提供新思路。
1 莱菔硫烷与糖尿病流行病学研究
SFN 对糖脂代谢疾病的营养流行病学研究资料有限,且集中于糖尿病及肥胖。在一项基于前瞻性队列研究的荟萃分析(meta-analysis)中[4],从306 723 名人群队列中筛选出16 544 例T2DM 患者进行随访,时间4.6~24年不等。同比于柑橘类水果,十字花科蔬菜的摄入量与T2DM 的病情呈负相关,提示具有预防作用〔最高与最低分析:总相对危险度(summary relative risks,SRR)=0.84,95%,CI:0.73~0.96〕,且差异显著,而柑橘类水果对T2DM无明显的治疗效果。2007年,日本公共卫生中心在一个前瞻性队列研究中纳入21 269 名日本男性和27 168名日本女性,纳入人群均无T2DM或其他严重疾病史。随访5 年后,共有896 名随访者被诊断为T2DM。分析报告显示[5],同时摄入蔬菜和水果或只摄入水果与T2DM 相关风险无关。然而,蔬菜(仅限男性),绿叶蔬菜(男性和女性)和十字花科蔬菜(仅限男性)摄入使T2DM相关风险降低约为20%,但并无统计学意义。肥胖或吸烟男性的T2DM风险降低程度略高于非肥胖或非吸烟男性。
一项随机双盲临床干预试验发现[6],富含SFN的西兰花芽粉(broccoli sprouts powder,BSP)可以改善T2DM患者的胰岛素抵抗(insulin resistance,IR)。81例T2DM患者被随机分配接受BSP 10 g·d-1(n=27)、5 g·d-1(n=29)和安慰剂(n=25),持续4周。结果发现,高剂量BSP(10 g·d-1)可降低血清胰岛素和稳态模型评价IR指数(homeostasis model assessment-insulin resistance index,HOMA-IR)(P=0.05),可见SFN对人体糖代谢异常有着积极调节作用。在一项有63 例T2DM 患者参与的随机对照试验(randomized controlled trial,RCT)中,摄入BSP 5~10 g·d-14周后,患者血浆胰岛素及HOMAIR 指数均下降。另一项RCT 试验中,97 例T2DM患者摄入BSP(约150 μmol 的SFN)12 周后,糖耐量和糖化血红蛋白改善明显;在肥胖个体中,糖化血红蛋白的改善尤为明显,提示SFN可能具有抑制糖原异生的功能。但受试者的体质量、BMI值、肝脂肪指数、血浆胆固醇(cholesterol,CHO)和甘油三酯(triglycerides,TG)水平并未下降[7]。一项针对“10年心血管疾病发病风险在10%~30%”老年人群的干预结果显示,服用高浓度的SFN 前体物-硫代葡萄糖苷(glucoraphanin,GRP,21.6 μmol·g-1),能降低血浆低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平,而摄入标准含量GRP(6.9 μmol·g-1)对LDL-C 无降低作用[8]。上述研究总体提示,十字花科蔬菜(富含SFN)对糖尿病及脂代谢紊乱患者具有正向调节作用(表1)。
2 莱菔硫烷对糖尿病并发症的调节机制
SFN 对糖尿病及其主要并发症如DN 、糖尿病性心脏病和动脉纤维化均有改善作用;其主要作用机制包括对NF-κB 途径的调控以及对线粒体的保护作用,通过减轻氧化应激以及影响相关因子的调控来实现。在CHO 诱导的胰腺β 细胞线粒体损伤过程中,SFN 可以增强ATP 的生成和利用,并且可以保护电子传递链[9]。同时,SFN还减弱了CHO诱导的NF-κB 活化,调节炎症反应。此外,SFN 还可抑制去乙酰化酶(sirtuin 1,SIRT1)表达,并大大增加小鼠胰岛β 细胞株Min6 细胞中过氧化物酶体增殖物激活受体γ 共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1,PGC-1α)的表达[10]。SFN增加核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)途径下游抗氧化酶的表达,抑制CHO 诱导的脂质过氧化,其抗氧化和抗炎特性,以及对线粒体生物学功能的保护和改善作用,均有助于缓解过量脂类堆积所致的胰腺β细胞功能损伤,并最终控制高血糖[11]。
SFN 在糖尿病引发的心脏病中起着重要的保护作用。SFN 可减弱T2DM 小鼠心肌氧化应激诱导的对肝激酶B1(liver kinase B1,LKB1)/腺嘌呤核糖核苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路的抑制,从而阻止了T2DM诱导的脂毒性心肌病。高脂饲料和链脲佐菌素诱导小鼠T2DM 模型中,SFN 治疗能显著减轻T2DM 诱导的心脏重塑和功能障碍[12]。SFN 通过下调糖尿病诱导的纤溶酶原激活剂抑制剂1(plasminogen activator inhibitor-1,PAI-1)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)(心肌炎症反应)、结缔组织生长因子(connective tissue growth factor,CTGF)、转化生长因子β1(transforming growth factor beta1,TGF-β1)蛋白(纤维化)、神经营养因子3(neurotrophins-3,NT-3)和4-羟基壬烯醛(4-hydroxynonenal,4-HNE)(氧化应激)等因子的表达,明显抑制了心脏的炎症氧化应激和纤维化。SFN 通过上调Nrf2 及其下游基因的表达,减少毒性加合物生成,最终逆转糖尿病诱导的LKB1/AMPK 信号通路。此外,SFN 可上调Nrf2及其下游抗氧化基因转录表达,预防糖尿病引起的主动脉损伤[13]。Miao 等[14]采用多种低剂量链脲佐菌素诱导FVB 小鼠T1MD,SFN 治疗3 个月后,糖尿病引起的主动脉纤维化、炎症和氧化损伤都明显减轻,其保护作用诱导转录因子Nrf2及其下游抗氧化基因表达。成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)是葡萄糖和脂质代谢中的重要调节剂,给FGF21基因敲除(FGF21 knockout,FGF21KO)小鼠注射链脲佐菌素后可诱发T1MD,小鼠早期表现为主动脉管壁增厚,胶原蛋白积聚和纤维化。与野生型(wild type,WT)糖尿病小鼠相比,FGF21缺失可能通过主动脉炎症和氧化应激的恶化加重主动脉重塑和细胞死亡,FGF21 可逆转FGF21KO 糖尿病小鼠的病理学变化[15]。同时,大量的西兰花芽提取物(broccoli sprout extract,BSE)与SFN效果一致,均可通过增加Nrf2核积累及其下游基因显着上调Nrf2转录活性,预防糖尿病性心肌病。分别给予WT 小鼠空白载体(0.01 mL·g-1),BSE 低剂量(估计SFN 可用量为0.5 mg·kg-1),BSE 高剂量(估计SFN 可用量为1.0 mg·kg-1)和SFN(0.5 mg·kg-1),每隔1 天给药1 次,持续3 个月。通过超声心动图、组织病理学检查、Western 印迹和实时PCR 检测表明,高剂量的BSE 和SFN(0.5 mg·kg-1)可显著抑制糖尿病引起的心脏肥大、纤维化、炎症和氧化损伤等[16]。
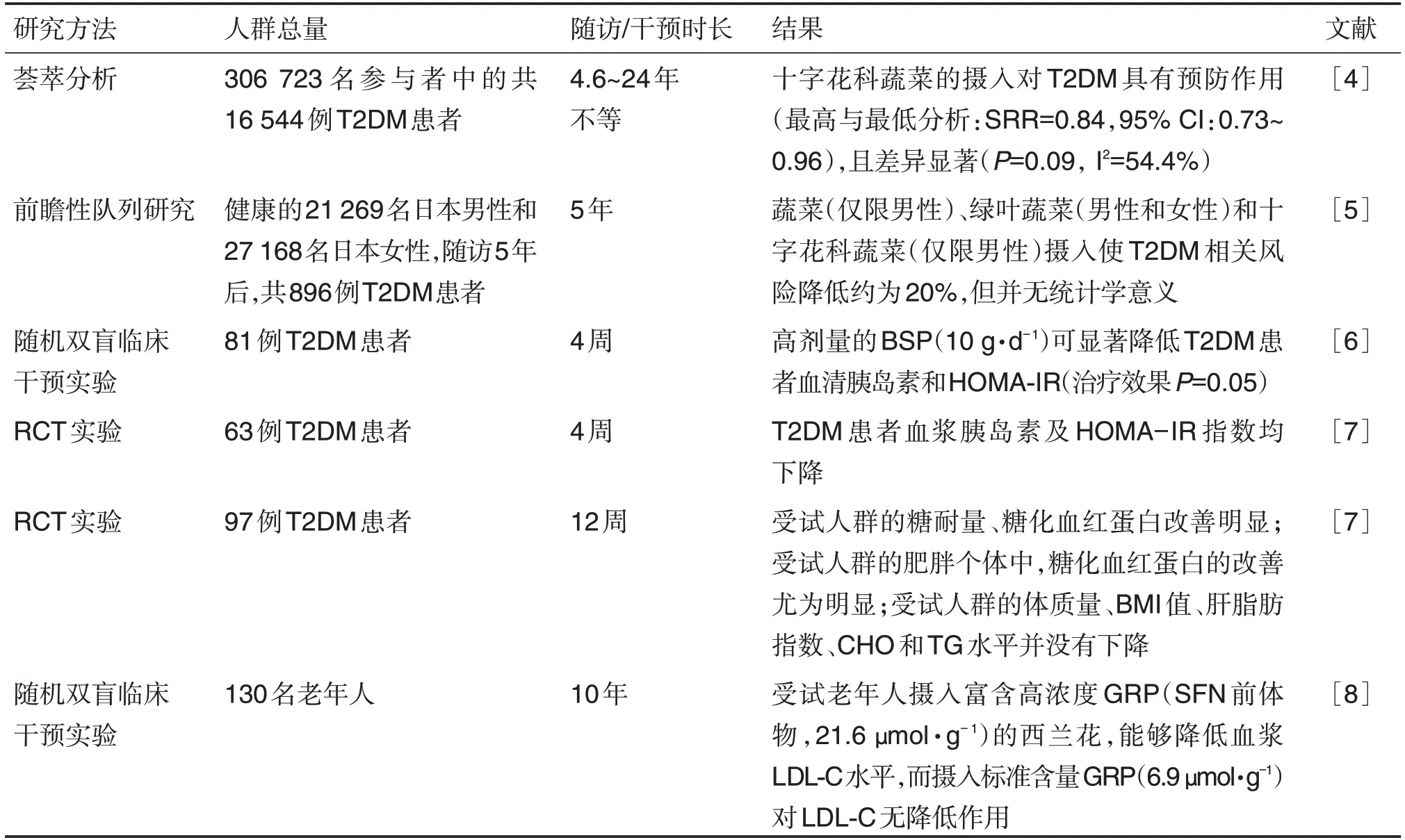
表1 十字花科蔬菜(莱菔硫烷)与糖尿病关联性人群研究资料
在DN 中,SFN 通过调节氧化应激和糖原合酶激酶3β(glycogen synthase kinase 3 beta,GSK3β)的表达,从而改善DN,并对DN 有良好的治疗效果。SFN 可明显抑制DN 大鼠尿白蛋白的增加,抑制肾基质扩张及TGF-β1表达。同时,Nrf2信号通路被激活,8-氧代-脱氧鸟苷水平在SFN治疗后的DN大鼠中明显降低,GSK-3β/酪氨酸蛋白激酶(tyrosineprotein kinase,Fyn)轴活性显著降低。此外,SFN还具有抗纤维化作用,与增强抑制性Ser9-磷酸化GSK3β和Fyn/Nrf2核输出或输入平行,将大鼠系膜细胞(rat mesangial cells,RMC)暴露于高葡萄糖环境中后,SFN 通过抑制GSK3β 的表达,保护细胞免受高糖损伤。综上,SFN通过GSK3β/Fyn/Nrf2信号转导途径改善大鼠DN[17]。
3 莱菔硫烷对脂肪肝病的调节机制
饮酒所导致的酒精性脂肪肝病也是酒精肝、肝硬变、肝纤维化甚至肝癌的早期表现,严重时可危及生命[18]。目前研究表明,SFN对酒精性脂肪肝以及非酒精性脂肪肝均有改善作用。其机制包括激活Nrf2从而减少氧化应激、增加某些蛋白表达以及抑制脂质积累,促进白色脂肪棕色化(browning)。SFN能有效改善酒精引起的急性脂肪性肝损伤,主要表现为肝组织匀浆中TG 和CHO 水平下降。在体外培养的HepG2 E47 肝细胞中,SFN 抑制了酒精诱发的脂质积累,该作用与Nrf2 依赖的细胞色素酶P450 2E1(cytochrome P450 2E1,CYP2E1)活性增加有关[19]。同样,SFN 对急性酒精性肝损伤的C57BL/6 小鼠有着较好的保护作用,SFN通过调节小鼠血清中相关代谢酶,从而降低肝氧化损伤[20]。此外,SFN对肝纤维化有着很好的预防和保护作用。在四氯化氮诱导的化学性肝损伤小鼠模型中,SFN可通过增强过氧化物酶体增殖剂激活受体γ(peroxisome proliferators-activated receptors γ,PPARγ)表达以及Nrf2依赖的抗氧化作用缓解肝纤维化进程[21]。
本课题组[22]利用高脂饮食(猪油20%)喂养大鼠10 周,同时利用混合的饱和脂肪酸诱导人肝HHL-5 细胞5 d,成功建立了异常脂代谢模型。通过对PGC-1α 途径和线粒体膜电位等的分析,发现SFN可通过促进线粒体生物合成,激活线粒体Nrf2来增强异常蓄积于机体内的脂类的利用。此外,还发现SFN通过转录激活脂类降解途径,上调脂肪甘油三酯酶和激素敏感脂肪酶的表达,从而促进脂类降解,减少脂肪堆积。SFN可通过增强解偶联蛋白1的表达,上调Nrf2/SIRT1/PPAR1α 信号,增加脂肪的利用率和葡萄糖摄取,促进脂肪分解和脂肪酸氧化以对抗肥胖以及肥胖相关的脂代谢紊乱。SFN可增加3T3-L1 脂肪细胞线粒体含量和呼吸链酶的活性,使脂肪细胞发生褐变[23]。
4 结语
综上所述,SFN对糖尿病及脂肪肝有着很好的预防和治疗效果,同时对其并发症也有着很好的改善作用。目前,SFN的相关研究主要集中于其对癌症的抑制作用,其对糖尿病和脂肪肝病的改善作用及其调控机制则存在大量空白,有待于研究和阐明。SFN作为一种天然的食源性植物化学物,其作用仍有待开发和利用。
