人支气管上皮HBE细胞中p53相关的放射诱导表达长链非编码RNA的鉴定和生物功能预测分析
2019-12-31黄瑞雪周平坤
胡 赛,黄瑞雪,周平坤,黄 波
(1.南华大学公共卫生学院,湖南 衡阳421001;2.中南大学公共卫生学院劳动卫生与环境卫生学系,湖南 长沙410078;3.军事科学院军事医学研究院辐射医学研究所,北京市放射生物学重点实验室,北京100850)
自1979年首次报道发现p53基因以来,不断研究发现,由P53蛋白介导的细胞信号转导途径可调节细胞的正常生命活动,同时在细胞放射损伤反应中如肺组织上皮细胞向间充质细胞转化的过程中发挥重要作用[1-2]。长链非编码RNA(long noncoding RNA,IncRNA)是长度>200 个核苷酸的非编码RNA[3]。lncRNA 在表观遗传调控、细胞周期调控和细胞分化调控等众多生命活动中发挥作用[4]。近期研究表明,细胞照射后,部分lncRNA 表达上调或下调,上调或下调的lncRNA 分子对被照射细胞的DNA损伤修复、细胞周期进程、凋亡、上皮间充质转化和多种蛋白产生具有调控作用[5]。国内有关实验室前期识别鉴定了正常人支气管上皮细胞BEP2D及其α粒子诱发癌变细胞BERP35T-1和BERP35T-4 细胞之间的差异表达lncRNA[6]。鉴于p53 在肺上皮细胞功能中的重要调控作用,以及前期发现p53 和某些lncRNA 之间存在互相影响、互相调控的关系[7-8],推测受到照射的上皮细胞出现的显著差异表达的lncRNA 中,有一部分可能与p53相关联,参与细胞放射损伤反应如多种与上皮间充质转化的信号通路并发挥作用。因此,本研究使用CRISPR-Cas9技术敲除人肺支气管上皮细胞HBE的p53 表达,进行照射,芯片检测构建lncRNA 差异表达谱,并进行生物信息学分析,以揭示放射诱导上皮间充质转化等细胞放射损伤反应的发生机制,对今后临床放射治疗中避免发生正常组织放射性损伤具有一定意义。
1 材料与方法
1.1 细胞、主要试剂和仪器
正常人支气管上皮HBE细胞(美国模式培养物集存库)。DMEM 培养基(美国Hyclone 公司);胎牛血清(美国Sigma 公司);注射用硫酸链霉素(深圳华药南方制药有限公司);注射用青霉素钠(华北制药股份有限公司);THUNDERBIRD SYBR qRTPCR Mix(CodeNo.QPS-201)(日本东洋纺生物科技有限公司);兔抗人P53 单克隆抗体(美国Cell Signaling Technology 公司);兔抗人GAPDH 多克隆抗体(美国Santa Cruz公司);辣根酶标记山羊抗兔IgG 二抗(北京中杉金桥生物技术有限公司)。紫外分光光度计(NanoDrop 2000)(美国Thermo公司);RT-PCR仪(MyCycler)(美国Bio-rad公司)。
1.2 细胞培养
HBE 细胞用DMEM 培养基(含10%胎牛血清,100 kU·L-1青霉素和100 mg·L-1链霉素)培养,培养条件为饱和湿度、37℃和5%CO2。
1.3 60Co γ射线照射和样品收集
待细胞生长到80%接触密度,设立HBE p53表达野生型(HBEp53-wt)细胞和p53敲除的HBE(HBEp53-/-)细胞,室温下给予4 Gy60Co γ 射线照射,照射前30 min换新鲜培养基。照射后置培养箱继续培养,4 h 后收集细胞,细胞用预冷的PBS 洗2 遍,加Trizol裂解,置于-80℃冰箱保存。
1.4 基因敲除载体构建
由上海合生生物公司完成。HBEp53-/-细胞的构建参考美国麻省理工学院张峰教授实验室CRISPRCas9 基因编辑实验方案[9],利用在线设计工具(http://crispr.mit.edu/)设计针对p53基因的小向导RNA(small guide RNA,sgRNA)并在上、下游引物添加相应的碱基。sgRNA 退火形成双链后与经过BbsⅠ酶切的Lenti-Cas9-gRNA 质粒连接,转化大肠杆菌Stbl3 感受态细胞,经过氨苄青霉素抗性平板筛选,挑克隆,摇菌,提取质粒,测序鉴定并选取正确克隆,获得基因敲除载体。p53 基因敲除细胞HBEP53-/-由北京合生基因科技有限公司构建。
1.5 Western印迹法检测p53敲除效率
HBEp53-/-细胞构建后,使用RIPA裂解液裂解细胞提取蛋白质并定量。采用ECL化学发光检测试剂盒检测HBEp53-wt细胞和HBEp53-/-细胞P53蛋白表达水平。
1.6 lncRNA芯片杂交和基因差异表达分析
lncRNA 芯片杂交反应和分析由欧易生物医学科技有限公司完成。提取样品总RNA,使用试剂盒ribo-zero试剂消化核糖体RNA后,加入切割试剂将RNA 切割成短片段,以切割后的RNA 为模板,用6碱基随机引物合成一链cDNA,然后配制二链合成反应体系合成二链cDNA;在cDNA 二链合成时以dUTP 代替dTTP,然后连接不同接头,再利用UNG酶法将含有dUTP 的1 条链进行消化,只保留连接链不同接头的cDNA 一链;使用试剂盒纯化cDNA一链;纯化的cDNA一链再进行末端修复、加A尾并连接测序接头,然后进行片段大小选择,最后进行RT-PCR 扩增;构建好的文库用Agilent 2100 Bioanalyzer 质检合格后,使用Illumina Hiseg 4000 测序仪进行测序。使用R语言进行lncRNA 差异表达分析、差异基因表达水平聚类分析和火山图分析。
1.7 lncRNA预测靶基因的功能分析
lncRNA 预测靶基因的功能分析包含GO 富集分析和KEGG(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析。GO功能富集分析的方法:将全部蛋白编码基因/转录本作为背景列表,差异蛋白编码基因/转录本列表作为从背景列表中筛选出来的候选列表,利用超几何分布检验计算代表GO 功能集在差异蛋白编码基因/转录本列表中是否显著富集的P 值。利用KEGG 数据库对差异蛋白编码基因进行信号通路分析,并用超几何分布检验的方法计算每个信号通路条目中差异基因富集的显著性。计算的结果会返回一个富集显著性的P值,P<0.05表示差异基因在该信号通路中出现了富集。信号通路分析对实验结果有提示的作用,通过差异基因的信号通路分析,可以找到富集差异基因的信号通路条目,寻找不同样品的差异蛋白编码基因可能与哪些细胞通路的改变有关。
1.8 实时定量PCR检测lncRNA的相对表达水平
按照THUNDERBIRD SYBR qRT-PCR Mix 试剂盒说明进行操作。实时定量RT-PCR 反应完成后,保存实验数据进行分析,以2-ΔΔCt法计算目的相对lncRNA的表达水平。
1.9 统计学分析
2 结果
2.1 p53敲除效率验证
Western印迹法分析结果显示,与HBEp53-wt细胞相比,HBEp53-/-细胞中P53蛋白表达显著降低(图1)。
2.2 lncRNA表达谱的变化
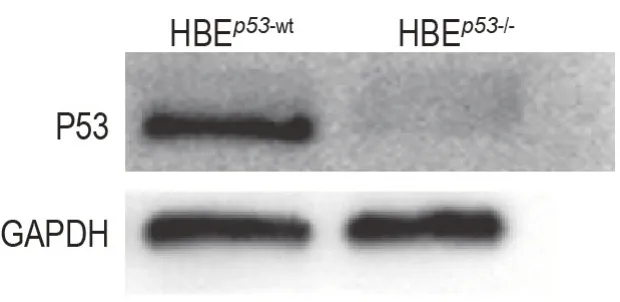
Fig.1 Verification of p53 knockout efficiency in p53 knockout HBE(HBEp53-/-)cells established by CRlSPRCas9. HBEp53-wt:p53 wild type HBE cells.
通过芯片筛选4 Gy 照射后HBEp53-wt细胞和HBEp53-/-细胞中差异表达的lncRNA,发现多个lncRNA 的表达水平出现显著性差异改变,其中有239个上调表达,287个下调表达。
lncRNA 表达谱的聚类分析结果如图2A所示,与HBEp53-wt细胞相比,HBEp53-/-细胞下调表达的lncRNA 数量略多于上调表达的数量(P<0.05)。lncRNA 表达谱分析的火山图结果所示,显著性下调表达的lncRNA数量(绿色)略多于显著性上调表达的数量(P<0.05)(灰色为表达水平无显著性差异)。可见,火山图的结果和聚类分析的结果基本吻合。
与受照射HBEp53-wt细胞相比,受照射HBEp53-/-细胞中显著上调和显著下调表达排名前10的lncRNA分子见表1和表2。从表1可见,ENST00000651681上调倍数最高,达到6.43 倍;其次是NR_037600.1,上调倍数为6.27倍。从表2可见,ENST00000366397下调倍数最大,为6.30倍;其次是ENST00000520590,下调倍数为6.19倍。
2.3 差异表达lncRNA的GO分析
图3 展示了差异表达水平改变在前10 位的lncRNA 调控靶基因的GO 分析结果。GO 分析包含生物学过程、细胞成分和分子功能等3 方面。生物学过程分析结果显示,差异表达的前10 位lncRNA 靶基因主要涉及温度稳态、负调控产热、负调控多细胞生物体的代谢过程、正调控肾上腺素能受体信号通路和正调控泛素-蛋白转移酶活性等;细胞成分结果显示,差异表达的前10 位lncRNA靶基因主要涉及包被蛋白复合体囊泡包被、顺面高尔基体网络和高尔基-内质网中间体成分和第二步骤催化反应拼接体等;而分子功能分类结果显示,主要涉及β3肾上腺素受体结合蛋白、酪氨酸激酶活性蛋白、DNA结合蛋白、锌离子跨膜转运体蛋白、突触融合蛋白结合蛋白和泛素结合蛋白等。
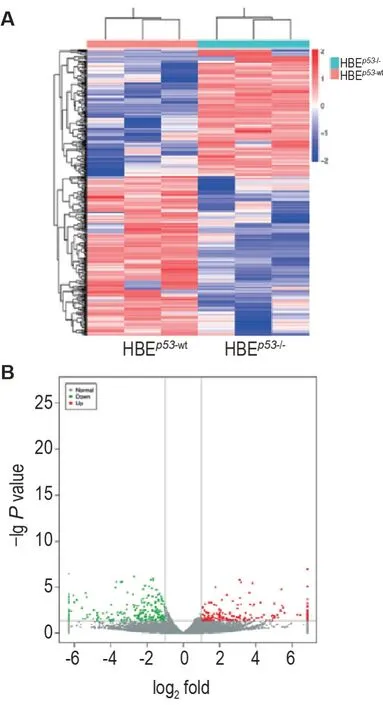
Fig.2 Cluster analysis and volcano maps of differentially expressed long non-coding RNAs(lncRNAs)in irradiated HBEp53-/-cells. Cells were treated with 4 Gy,the expression lncRNAs chip analysis was performed 4 h post-irradiation. A:cluster analysis,pink means up-regulation,purple means downregulation;B:volcano map,red dots mean up-regulation,green dots mean down-regulation,gray dots mean no change.log2fold=log2(expression level of HBEp53-/-/expression level of HBEp53-wt).
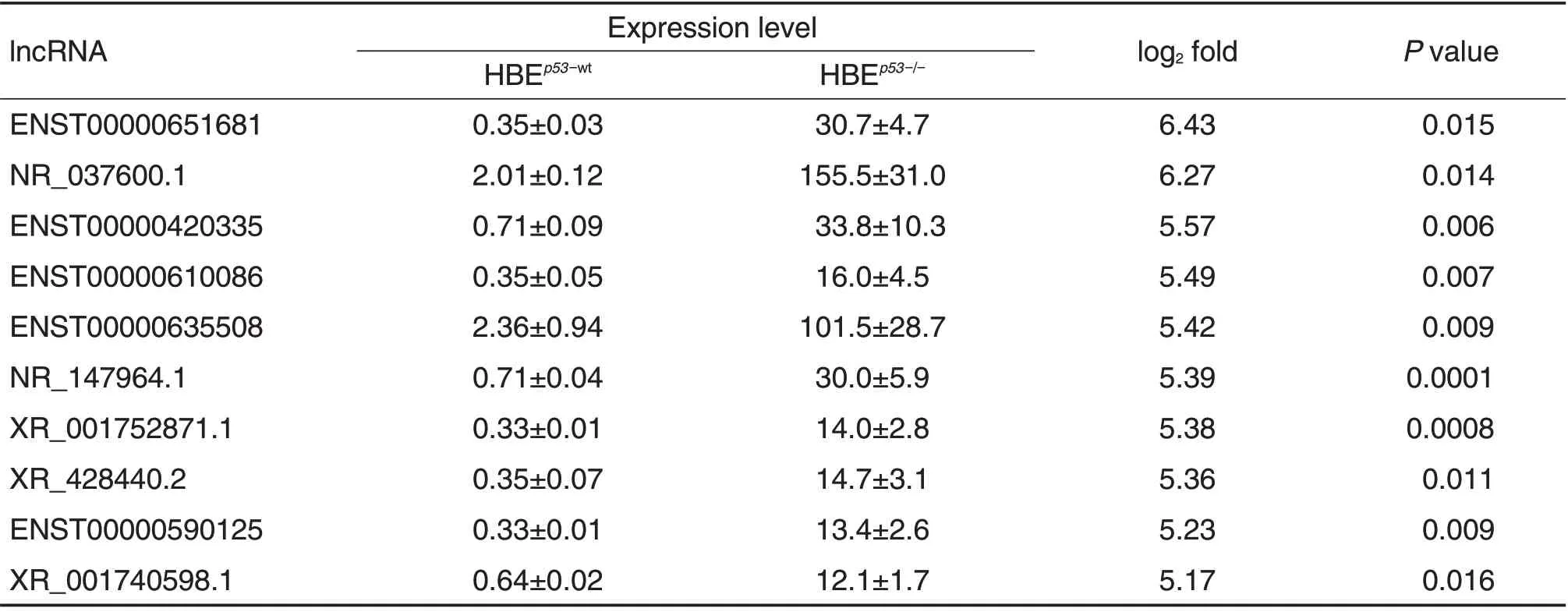
Tab.1 Top ten up-regulated lncRNAs sassociated with p53 deficiency in irradiated HBEp53-/-cells
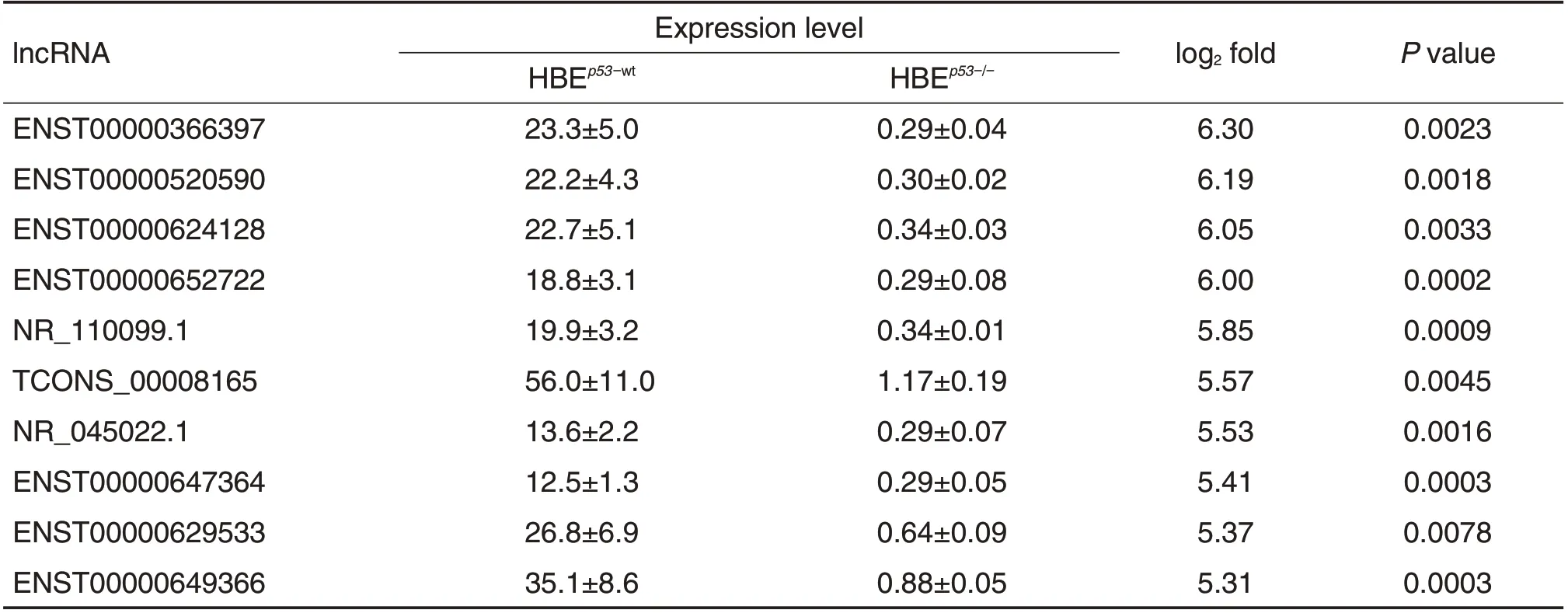
Tab.2 Top ten down-regulated lncRNAs sassociated with p53 deficiency in irradiated HBEp53-/-cells
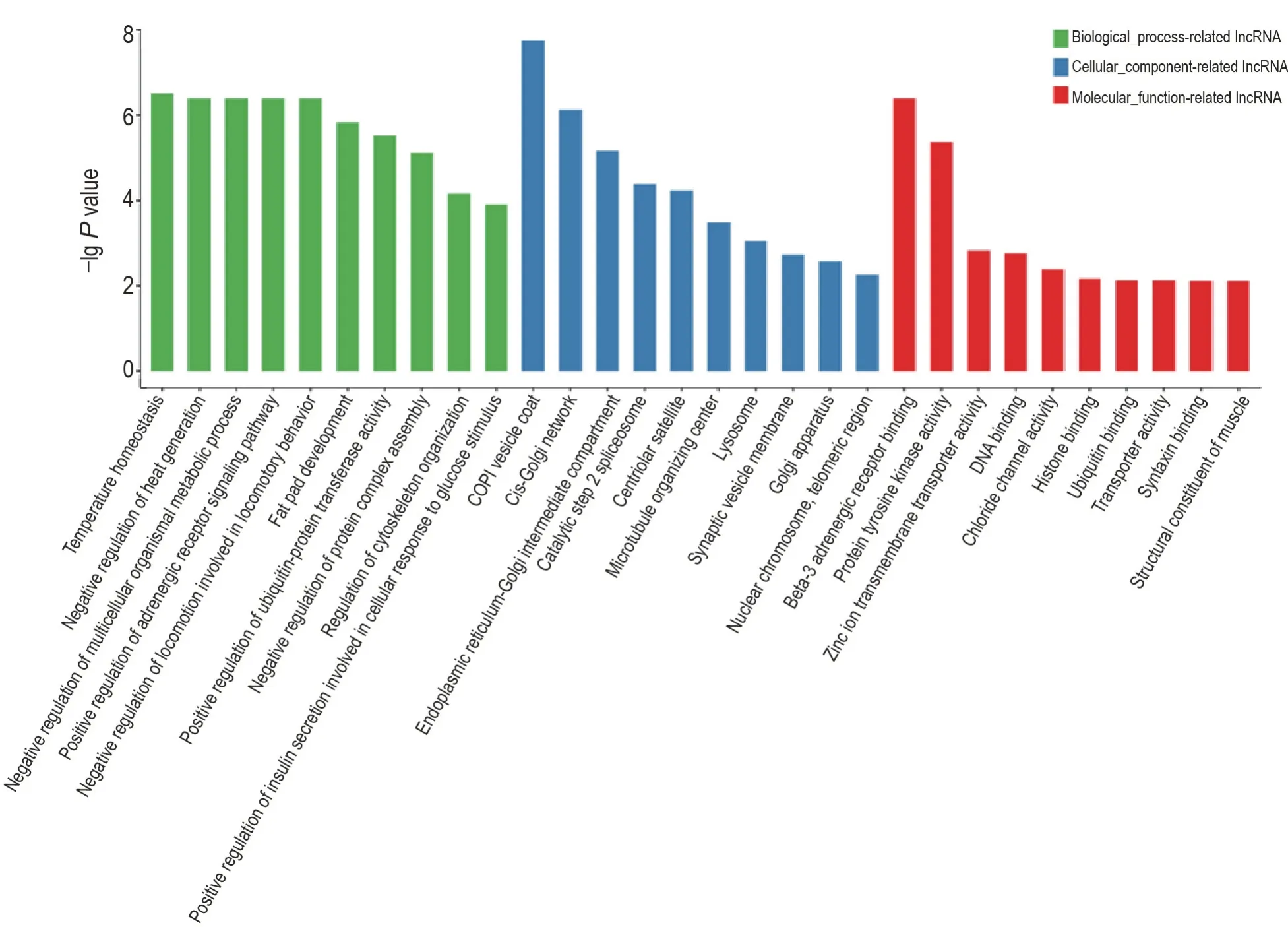
Fig.3 GO analysis of differentially expressed lncRNA in HBEp53-wt and HBEp53-/- cells after irradiation treatment.See Fig.2 for the cell treatment.
2.4 差异表达lncRNA的KEGG分析
图4 显示了差异表达lncRNA 调控靶基因的KEGG 分析结果。从生物体系统通路划分,有感知、神经、免疫、内分泌、环境适应、发育和循环系统等;从代谢划分,有外源物的生物降解、核苷代谢、维生素和辅助因子代谢、脂质代谢和能量代谢等;人类疾病相关的通路与上述生物体系统通路基本吻合;细胞过程通路有转运和分解代谢、细胞迁移、细胞增长和死亡等。
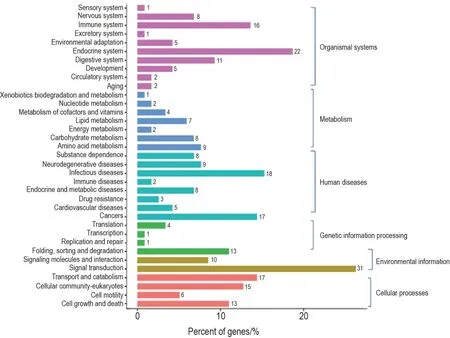
Fig.4 KEGG analysis of targeted genes of differentially expressed lncRNA associated with p53 deficiency in HBEp53-wt and HBEp53-/-cells after irradiation treatment. See fig.2 for the cell treatment.Pink horizontal bar:cellular processes-related signaling pathways;blue horizontal bar:environmental information processing-related signaling pathways;cyan horizontal bar:genetic information processing-related signaling pathways;green horizontal bar:human diseases-related signaling pathways;brown horizontal bar:metabolism-related signaling pathways;red horizontal bar:organism systems-related signaling pathways.
2.5 差异表达lncRNA的实时定量RT-PCR验证
为了验证芯片结果,分别选取上调和下调表达变化前5的lncRNA分子利用实时定量RT-PCR进行验证。芯片结果中参与上调表达的ENST00000651681,NR_037600.1,ENST00000420335,ENST000006-10086和ENST00000635508分子,实时定量RT-PCR结果(图5A)均出现上调变化。芯片结果中参与下调表达的ENST00000366397,ENST00000520590,ENST00000624128,ENST00000652722 和NR_110099.1分子,实时定量RT-PCR结果(图5B)均出现下调变化。提示芯片结果可靠。

Fig.5 Verification of differential expression of lncRNAs from microarray analysis. See Fig.2 for the cell treatment. The top five of up-regulated(A)and down-regulated lncRNAs(B)were selected respectively,and performed by real time RT-PCR assay.,n=3.**P<0.01,compared with HBEp53-wt group.
3 讨论
近期针对p53 与lncRNA 相互作用的研究报道逐渐增多,主要集中在与p53 依赖相关的lncRNA在肿瘤侵袭和转移等中的作用。Mello等[10]使用染色质免疫共沉淀与高通量测序相结合的方法,联合RNA 测序数据集,识别出一个受p53 调控的新lncRNA,即Neat1,发现Neat1 具有抑制细胞转化和癌症起始的功能。Zhu 等[11]研究发现,在肝癌细胞中,lncRNAMEG3 能促进p53 转录活性,lncRNAMEG3 能与P53蛋白的DNA结合区域发生交互作用,引起P53 下游众多靶基因表达发生改变。Chaudhry[12]使用实时定量RT-PCR 技术检测了人TK6 细胞(p53 表达的淋巴母细胞)和WTK1(p53 不表达的淋巴母细胞)经过照射后小核RNA(small nuclear RNA,snRNA)及核仁小RNA(small nucleolar RNA,snoRNA)的变化,发现在p53 表达的TK6 细 胞 中,SNHG1,SNHG6 和SNHG11 等snoRNA 表达水平升高;而在p53 不表达的WTK1细胞中,SNHG 和SNHG11 表达下调,说明照射后细胞中部分lncRNA 的表达改变可能与p53 有关,也是细胞对外界放射性损伤反应的一种调控方式,也提示p53 和lncRNA 可能在照射后的细胞反应中共同发挥作用。有研究报道,肺上皮细胞受照射后,lncRNA 也出现相应改变。本研究通过敲除肺支气管上皮细胞HBE的p53基因表达,利用芯片杂交技术,分析敲除p53 后细胞放射损伤应答lncRNA的差异表达谱变化。本研究设计上与之前报道不同的地方,一是使用CRISPR-cas9技术敲除HBE细胞上的p53表达;二是采用了人正常肺上皮细胞HBE。采用这2 点的原因主要是想了解p53缺失的情况下,肺上皮细胞中lncRNA 在照射后的变化。另外,拟通过这种方法构建p53 依赖性的放射损伤反应细胞模型,以便为今后开展放射性纤维化的机制研究提供基础数据。P53 是DNA 损伤的关键蛋白,其损伤或缺失会直接影响放射所致的DNA 损伤应答和修复信号通路。本实验室前期实验发现,照射后微小lncRNA miR-34a 过表达,通过抑制其靶基因p53 的表达从而降低其下游的DNA 同源重组修复基因RAD51 的转录表达,导致细胞自发DNA 双链断裂损伤残留增加[13]。本研究结果发现,HBEp53-/-细胞受辐照损伤后,多种lncRNA 分子出现显著差异变化。生物信息学分析发现,差异表达的lncRNA 参与多种细胞生物学功能和多个细胞信号通路。如负调控多细胞生物体的代谢过程、正调控肾上腺素能受体信号通路和正调控泛素-蛋白转移酶活性、调控顺式高尔基体网络和内质网应激、参与维生素和辅助因子、内分泌、免疫、脂质代谢通路等。有研究报道,肾上腺素能受体信号通路参与调控上皮间充质转化,如去甲肾上腺素能够诱导Slug 和Snail 蛋白表达,刺激转化生长因子β1分泌,促进细胞的上皮间充质转化。β 肾上腺素能受体拮抗剂心得安能抑制去甲肾上腺素的上述作用[14-15]。本研究发现,在HBE 细胞放射损伤反应中,调控肾上腺素能受体信号通路的lncRNA 分子(XR_001738079.2,XR_001738080.2和TCONS_00008371)表达出现变化。推测这些lncRNA 可能在辐照后,在p53 的调控作用下,对肾上腺素能受体产生作用,从而激活或抑制下游一系列与上皮间质转化相关的基因表达,最终影响上皮间充质变化的进程,这为揭示电离辐射诱发细胞的上皮间充质转化机制提供了新的信息。
总之,p53作为转录调节因子,直接调控其下游编码蛋白的功能靶基因转录活性,在细胞放射损伤反应过程中发挥重要作用。本研究表明,p53 还可通过调控多个lncRNA 分子的表达变化,继而影响下游功能靶基因的转录活性及相应信号通路,同样发挥对细胞放射损伤应答反应的调控作用。这些基于lncRNA 芯片分析技术结合生物信息学手段,发掘出来的p53相关的放射损伤响应lncRNA 表达谱数据信息,对今后生物研究放射损伤反应机制具有一定价值。但是,具体功能还需进一步在细胞水平甚至动物水平上进行功能学实验,以验证预测分析的结果。
本研究的不足之处在于采用的是单一剂量4 Gy照射,未探讨细胞p53缺失受多个剂量辐射后的lncRNA 变化是否与照射剂量有关。另外,本研究仅用1种肺上皮细胞进行了实时定量RT-PCR验证分析,这对芯片测序结果的解读可能有一定影响。
综上所述,本研究表明,HBEp53-/-细胞受4 Gy γ射线照射后lncRNA 表达发生变化,并对差异表达显著的lncRNA 分子的生物学功能进行了预测分析,为今后进一步研究p53 和lncRNA 在细胞放射损伤反应中的作用提供了基础信息。
