高毒力肺炎克雷伯菌血清型、毒力基因分布及分子标志物探索
2019-12-30徐水宝杨思宇翁珊珊陈晨陈澍张文宏金嘉琳
徐水宝,杨思宇,翁珊珊,陈晨,陈澍,张文宏,金嘉琳
复旦大学附属华山医院感染科, 上海 200040
肺炎克雷伯菌(Klebsiellapneumoniae,KP)是一种革兰染色阴性、有荚膜的肠杆菌科细菌,广泛存在于环境中,亦寄生于人类的皮肤、鼻咽部、肠道等,为条件致病菌,主要感染免疫功能低下者[1]。1986年7例由KP引起的肝脓肿并发眼内炎首次被报道,并被定义为高毒力肺炎克雷伯菌(hypervirulentKlebsiellapneumoniae,HVKP)[2]。HVKP也可引起健康人群肝脓肿伴远处播散,如眼内炎、坏死性筋膜炎、中枢神经系统感染等,称为侵袭综合征[2-3]。此后,HVKP的报道在全球范围逐渐增多,早诊断、早治疗可改善其感染的预后,然而目前仍然缺乏确切的分子诊断标准和特异性分子标志物(不同文献之间所述标准不一),对人类健康造成严重威胁。本研究对分离自本院的25株HVKP与28株普通肺炎克雷伯菌(classicKlebsiellapneumoniae,cKP)血清型和毒力基因分布特点进行比较分析,探索HVKP的分子标志物,期望对该病的分子诊断提供数据。
1 研究对象与方法
1.1 对象
从复旦大学附属华山医院(2009―2018年)住院患者中,根据临床病史和病原学检查结果,筛选出侵袭综合征KP阳性患者(表1),从本院保存的菌库中获得相应的非重复KP菌株共25株,将其视为HVKP组;从菌库中随机抽取血流感染的KP菌株,并根据病史剔除有合并其他侵袭性感染的菌株,最终得到28株,将其视为cKP组。
本研究关于HVKP组和cKP组的划分主要通过临床定义。据文献报道,HVKP引起的侵袭综合征主要表现为肝脓肿合并肝外侵袭性感染,如眼内炎、坏死性筋膜炎、中枢神经系统感染等[3]。
血清型主要包括K1、K2、K5、K20、K54和K57[4-6];毒力基因包括[6-9]:①荚膜多糖合成和合成调控相关基因[10-11]wcaG和rmpA、rmpA2、magA;②菌毛合成相关基因[12]fimH、mrkD;③脂多糖相关基因[13]uge、wabG;④铁摄取系统相关基因[14]aero、iucB、iutA、iroNB、ybtA、kfuBC;⑤尿素酶相关基因[10]ureA、allS。
表1 25株HVKP菌株临床特点
Tab.1 Clinical characteristics of 25 strains of HVKP

菌株编号菌株来源侵袭综合征表现KP1血肝脓肿、化脓性腰椎间盘感染、菌血症KP2血肝脓肿、眼内炎、肺脓肿、菌血症KP3血肝脓肿、肺脓肿、泌尿系感染、菌血症KP4脓液肝脓肿、肺脓肿KP5血肝脓肿、皮肤软组织感染、肺部感染、菌血症KP6血肝脓肿、肺脓肿、菌血症KP7脓液肝脓肿、肺脓肿KP8脓液肝脓肿、肺脓肿KP9脓液肝脓肿、脑脓肿、肺部感染KP10脓液肝脓肿、肛周脓肿KP11脓液肝脓肿、皮肤软组织感染KP12血肝脓肿、腰大肌脓肿、菌血症KP13血肝脓肿、眼内炎、菌血症KP14血肝脓肿、皮肤软组织感染、菌血症KP15血肝脓肿、眼内炎、菌血症KP16血肝脓肿、眼内炎、肺部感染、菌血症KP17脓液肝脓肿、中枢神经系统感染KP18血肝脓肿、中枢神经系统感染、菌血症KP19脓液肝脓肿、脑脓肿KP20血肝脓肿、眼内炎、肺部感染、菌血症KP21血肝脓肿、眼内炎、菌血症KP22血肝脓肿、肺脓肿、菌血症KP23血肝脓肿、皮肤软组织感染、肺部感染KP24血颈部蜂窝织炎、化脓性椎间盘感染、菌血症KP25血皮肤软组织感染、菌血症
1.2 方法
菌株进行复苏和培养,采用Tiangen TIANamp Bacteria DNA Kit提取菌株DNA。血清型和毒力基因的引物序列参照文献(表2、表3), 由生工生物工程(上海)股份有限公司合成。PCR体系20 μL: 1 μL DNA模板、0.5 μL引物R、0.5 μL引物F、10 μL Premix Taq (TaKaRa Premix Taq Version 2.0)、8 μL ddH2O。PCR条件:预变性95 ℃ 3 min;变性95 ℃ 30 s,退火(温度见表2、3) 30 s,延伸 72 ℃ 1 min,30个循环;72 ℃ 维持 10 min。PCR产物在1%浓度琼脂糖凝胶中电泳(电压 120 V,时间 30 min),经紫外成像仪拍照保存。
表2 KP血清型PCR引物
Tab.2 Primers used for detecting KP serotypes by PCR

SerotypeSequence (5′-3′)bpAnnealing(℃)K1[10]K1-FGGTGCTCTTTACATCATTGC1 28358K1-RGCAATGGCCATTTGCGTTAGK2[10]K2-FGACCCGATATTCATACTTGACAGAG64158K2-RCCTGAAGTAAAATCGTAAATAGATGGCK5[10]K5-FTGGTAGTGATGCTCGCGA28058K5-RCCTGAACCCACCCCAATCK20[10]K20-FCGGTGCTACAGTGCATCATT74158K20-RGTTATACGATGCTCAGTCGCK54[10]K54-FCATTAGCTCAGTGGTTGGCT88158K54-RGCTTGACAAACACCATAGCAGK57[10]K57-FCCAGTAATCAGTCCAGAAACAACC103758K57-RTAGCTTTTTTCATTCTTGTGTTTGTT
表3 KP毒力基因PCR引物
Tab.3 Primers used for detecting KP virulence genes by PCR
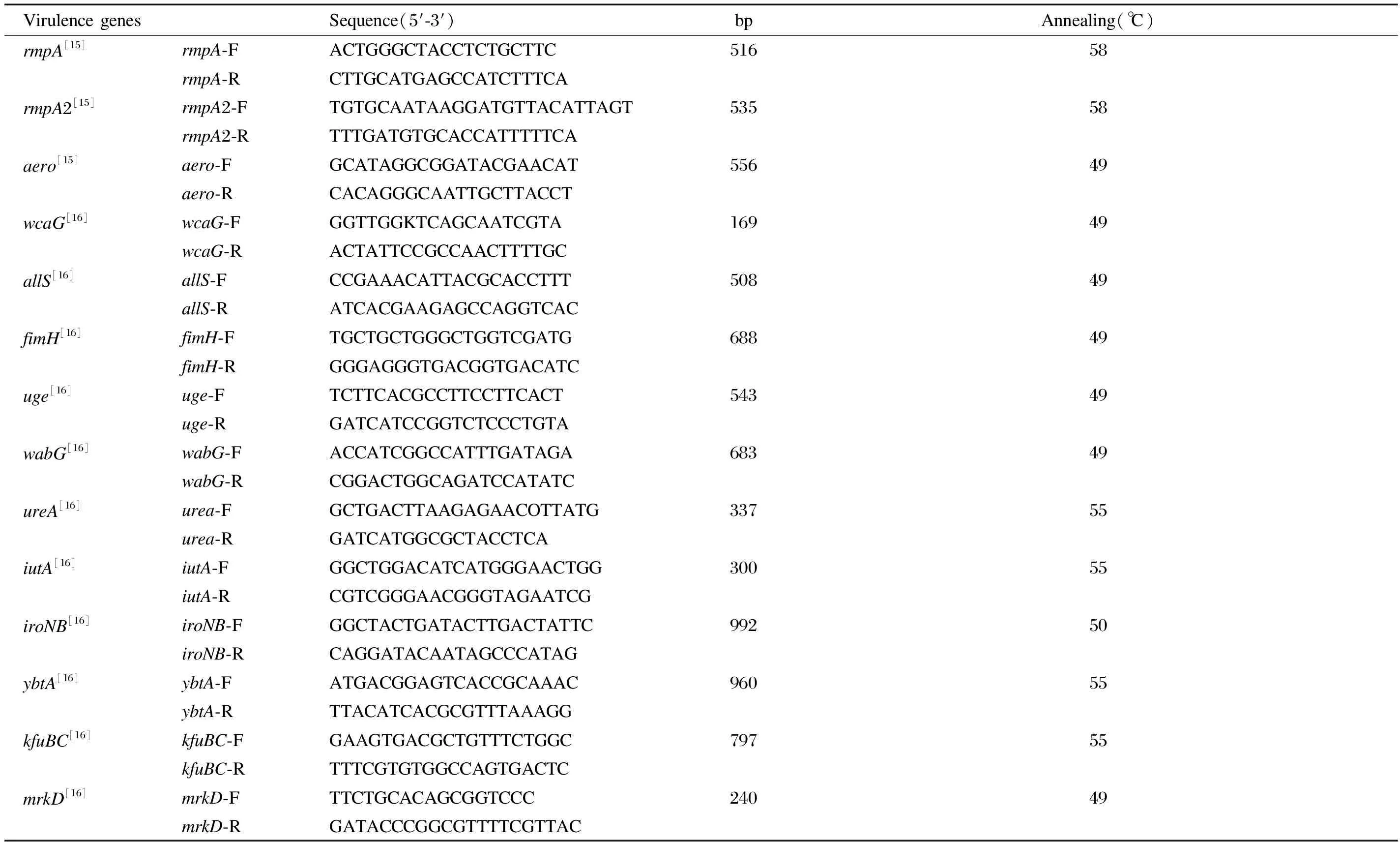
Virulence genesSequence(5′-3′)bpAnnealing(℃)rmpA[15]rmpA-FACTGGGCTACCTCTGCTTC51658rmpA-RCTTGCATGAGCCATCTTTCArmpA2[15]rmpA2-FTGTGCAATAAGGATGTTACATTAGT53558rmpA2-RTTTGATGTGCACCATTTTTCAaero[15]aero-FGCATAGGCGGATACGAACAT55649aero-RCACAGGGCAATTGCTTACCTwcaG[16]wcaG-FGGTTGGKTCAGCAATCGTA16949wcaG-RACTATTCCGCCAACTTTTGCallS[16]allS-FCCGAAACATTACGCACCTTT50849allS-RATCACGAAGAGCCAGGTCACfimH[16]fimH-FTGCTGCTGGGCTGGTCGATG68849fimH-RGGGAGGGTGACGGTGACATCuge[16]uge-FTCTTCACGCCTTCCTTCACT54349uge-RGATCATCCGGTCTCCCTGTAwabG[16]wabG-FACCATCGGCCATTTGATAGA68349wabG-RCGGACTGGCAGATCCATATCureA[16]urea-FGCTGACTTAAGAGAACOTTATG33755urea-RGATCATGGCGCTACCTCAiutA[16]iutA-FGGCTGGACATCATGGGAACTGG30055iutA-RCGTCGGGAACGGGTAGAATCGiroNB[16]iroNB-FGGCTACTGATACTTGACTATTC99250iroNB-RCAGGATACAATAGCCCATAGybtA[16]ybtA-FATGACGGAGTCACCGCAAAC96055ybtA-RTTACATCACGCGTTTAAAGGkfuBC[16]kfuBC-FGAAGTGACGCTGTTTCTGGC79755kfuBC-RTTTCGTGTGGCCAGTGACTCmrkD[16]mrkD-FTTCTGCACAGCGGTCCC24049mrkD-RGATACCCGGCGTTTTCGTTAC
1.3 统计学方法
应用SPSS 20.0进行统计学分析。分类变量用卡方检验做比较。对2组之间有显著差异的分子标志物分别计算其灵敏度、特异度、准确度和约登指数。应用二元Logistic回归(向后:LR)对分子标志物进行多因素分析,P<0.05为有统计学差异。
2 结果
2.1 HVKP组中最常见的血清型为K1型
HVKP组(25株)中最常见的血清型为K1型,占60% (15/25);另外还检测到K2和K20各2株,未测到血清型K5、K54和K57。HVKP组与cKP组相比,血清型K1有统计学差异(χ2=9.983,P<0.05),K2和K20虽然在统计学上无差异,但这2种血清型只在HVKP组中测到(表4)。
表4 HVKP与cKP血清型比较
Tab.4 Comparison of serotypes between HVKP and cKP

SerotypeHVKP (n=25)cKP(n=28)χ2PK115(60.00%)5(17.86%)9.9830.002K22(8.00%)0-0.218K500--K202(8.00%)0-0.218K5400--K5700--
2.2 毒力基因分布
HVKP组中毒力基因阳性率最高的前3种为uge、fimH和wabG,分别占100%、96% 和92%。与cKP组相比,毒力基因有统计学差异的是rmpA2 (χ2=6.335,P=0.012)、magA(χ2=9.983,P=0.002)、fimH(χ2=9.389,P=0.002)、aero(χ2=6.692,P=0.010)、iutA(χ2=23.645,P=0.000)、kfuBC(χ2=14.018,P=0.000)。其他基因虽然在统计学上无差异,但在HVKP组中基因的阳性率基本都高于cKP组。如果增大样本量,可能会得到不同的结果(表5)。
对HVKP与cKP组之间有显著差异的分子标志物,分别计算其灵敏度、特异度、准确度和约登指数。根据约登指数将标志物的诊断效能由高到低排列:iutA>kfuBC>magA(K1)>aero>fimH>rmpA2。经多因素Logistic回归分析,发现iutA在HVKP与cKP组之间有统计学差异(P=0.002),见表6、表7和图1。
表5 HVKP和cKP毒力基因比较
Tab.5 Comparison of virulence genes between HVKP and cKP
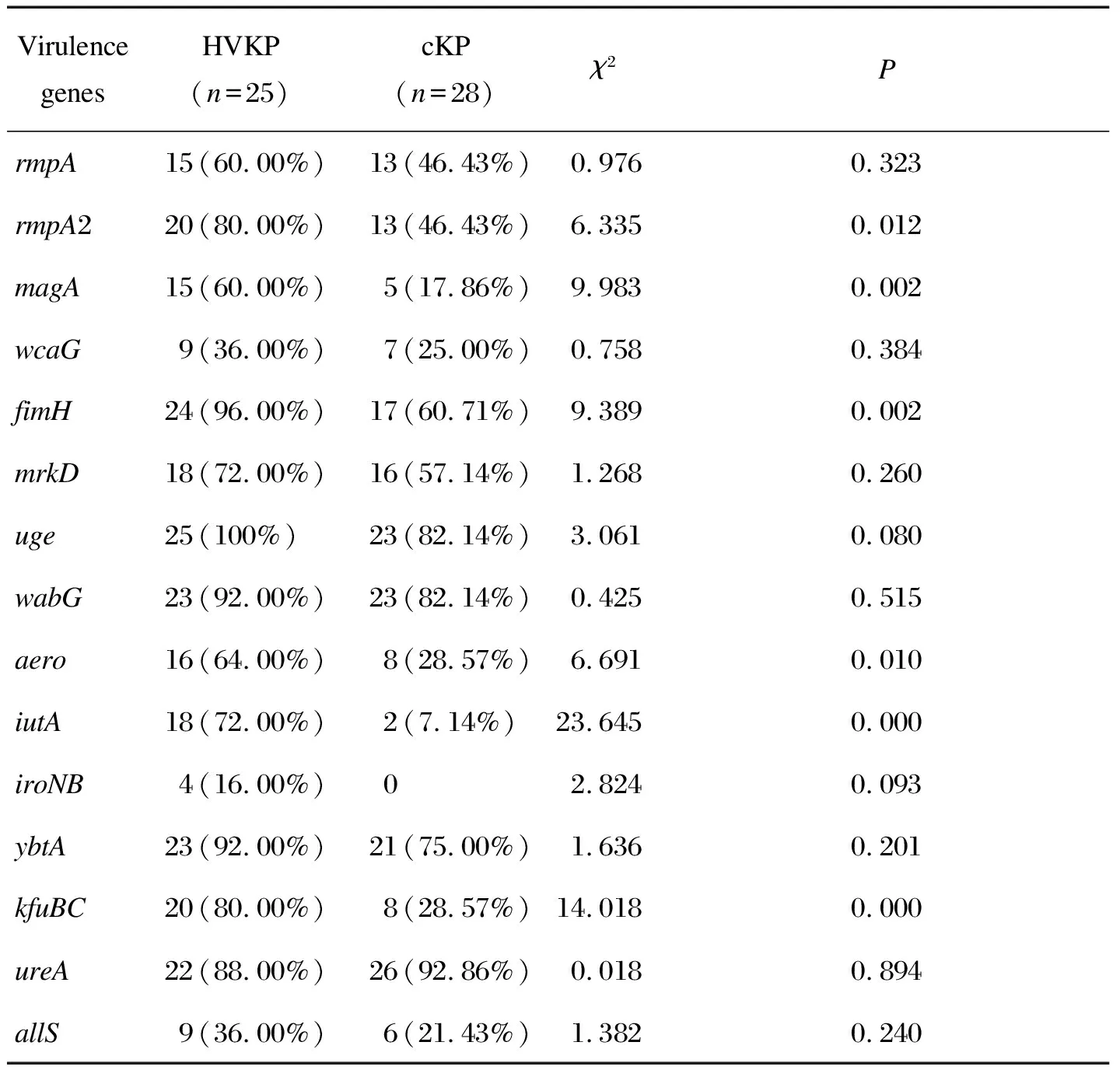
Virulence genesHVKP(n=25)cKP (n=28)χ2PrmpA15(60.00%)13(46.43%)0.9760.323rmpA220(80.00%)13(46.43%)6.3350.012magA15(60.00%)5(17.86%)9.9830.002wcaG9(36.00%)7(25.00%)0.7580.384fimH24(96.00%)17(60.71%)9.3890.002mrkD18(72.00%)16(57.14%)1.2680.260uge25(100%)23(82.14%)3.0610.080wabG23(92.00%)23(82.14%)0.4250.515aero16(64.00%)8(28.57%)6.6910.010iutA18(72.00%)2(7.14%)23.6450.000iroNB4(16.00%)02.8240.093ybtA23(92.00%)21(75.00%)1.6360.201kfuBC20(80.00%)8(28.57%)14.0180.000ureA22(88.00%)26(92.86%)0.0180.894allS9(36.00%)6(21.43%)1.3820.240
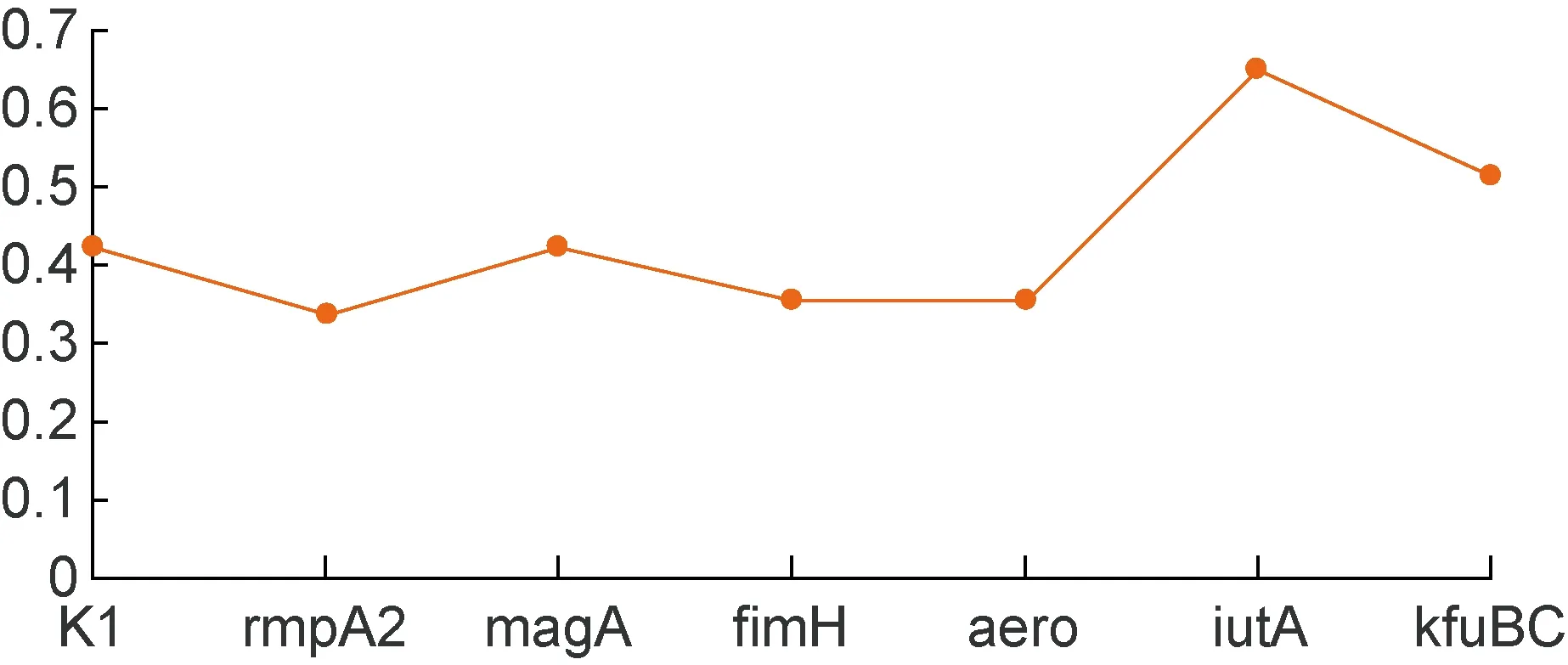
图1 HVKP分子标志物约登指数
Fig.1 Yoden index of molecular markers in HVKP
表6 HVKP分子标志物准确度、灵敏度、特异度和OR值
Tab.6 Accuracy, sensitivity, specificity andORvalue of molecular markers in HVKP

Molecular markersAccuracy(%)Sensitivity(%)Specificity(%)Yoden indexOR(95% CI)K171.760.082.10.4216.900(1.967,24.209)rmpA266.080.053.60.3364.615(1.350,15.784)magA71.760.082.10.4216.900(1.967,24.209)fimH66.096.039.30.35315.529(1.828,131.902)aero67.964.071.40.3544.444(1.397,14.138)iutA52.872.092.90.64933.429(6.215,179.805)kfuBC75.580.071.40.51410.000(2.787,35.885)
表7 HVKP分子标志物多因素Logistic回归分析
Tab.7 Multivariate logistic regression of molecular markers in HVKP
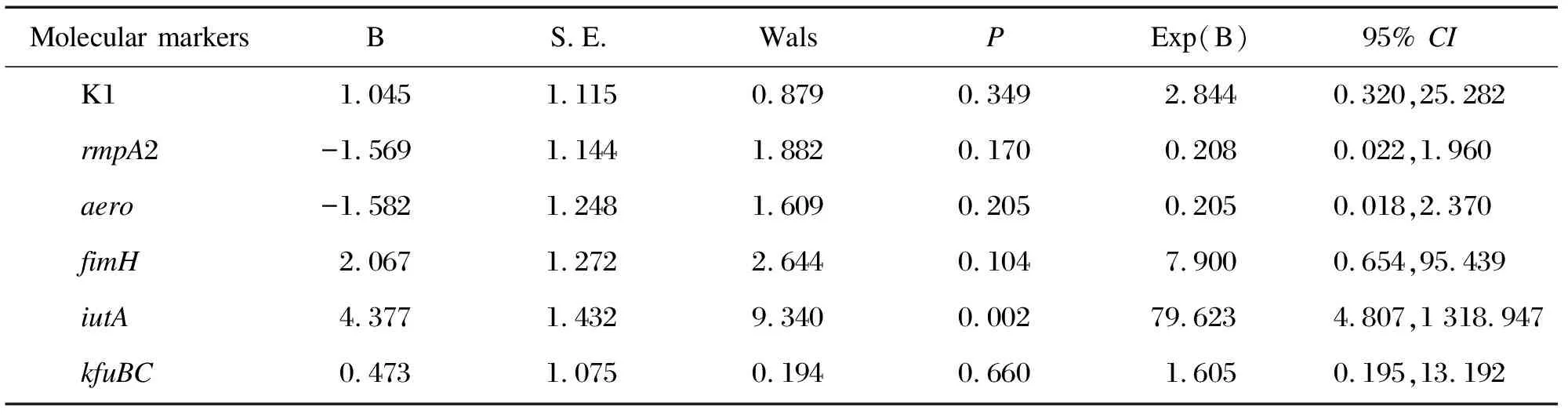
Molecular markersBS.E.WalsPExp(B)95% CIK11.0451.1150.8790.3492.8440.320,25.282rmpA2-1.5691.1441.8820.1700.2080.022,1.960aero-1.5821.2481.6090.2050.2050.018,2.370fimH2.0671.2722.6440.1047.9000.654,95.439iutA4.3771.4329.3400.00279.6234.807,1 318.947kfuBC0.4731.0750.1940.6601.6050.195,13.192
3 讨论
目前,关于HVKP的分子标志物相关报道不多。本研究将侵袭综合征患者中分离的菌株视为HVKP,单纯血流感染患者中分离的菌株视为cKP,通过对既往所报道的KP血清型和毒力基因分别在HVKP组和cKP组中进行检测和比较,筛选HVKP的分子标志物,并评估其效能。
荚膜多糖是KP重要的毒力因子,主要通过抗巨噬细胞吞噬作用、抑制早期炎症反应、抵抗抗菌肽和抑制树突细胞成熟帮助细菌免疫逃逸[6]。在目前发现的82种荚膜血清型中HVKP主要为K1、K2、K5、K20、K54和K57型[6-7, 16]。其中K1和K2型在亚洲地区常见[5-6],血清型K1是亚洲地区最常见的血清型(21.7%),在北美、欧洲和澳大利亚不常见[16]。研究表明K1型与侵袭综合征密切相关,K2型菌株毒力一般低于K1型。本研究中HVKP组K1型占60.00%,cKP组K1型占17.86%,两者之间有统计学差异(χ2=9.983,P=0.002)。除此之外,HVKP组中还检测到K2和K20型各2株,虽然与cKP组之间无统计学差异,这可能与样本量较小有关。本研究和既往研究结果较相符,均表明K1型是HVKP最常见的血清型。
荚膜多糖K1型主要的调控基因是magA[17]。研究发现magA只存在于K1型KP菌株中,而K1型被认为是HVKP的主要血清型[18]。magA与高黏力表型密切相关,且该基因阳性的菌株往往在小鼠实验中表现出较高的毒力[19]。rmpA、rmpA2 是荚膜多糖合成相关的转录调控因子基因,可调控多种血清型合成,形成高黏力表型[6, 20]。一般认为K1、K2型KP菌株高黏力表型多见,其荚膜多糖合成调控基因rmpA和rmpA2阳性率也往往较高[5]。
本研究中HVKP组magA和rmpA2基因分别占60.00%和80.00%,与cKP组之间有统计学差异,可作为HVKP的重要分子标志物,与其他研究结果一致[5]。然而,rmpA在HVKP组阳性率为60.00%,在cKP组阳性率为46.43%,虽然HVKP组阳性率高于cKP组,但是在统计学上无差异,与大部分文献报道不符。这可能是因为样本量太小,若能增大样本量,其更有说服力。但也有一些研究报道,部分菌株rmpA、rmpA2均阳性却没有高黏力表现,而且为低毒力,可能与基因突变有关。
菌毛有助于细菌定植,形成生物膜,T1P和T3P是KP的主要菌毛[6]。T1P由FimA和FimH组成,可介导细菌与宿主细胞上含甘露糖的受体结合,使细菌定植于泌尿生殖道、呼吸道、肠道等[6, 21]。T3P由MrkA和MrkD组成,主要黏附于内皮细胞、呼吸道和尿路的上皮细胞[6]。本研究中,fimH在HVKP组中阳性率为96.00%, 在cKP组中阳性率为60.71%,有统计学差异(χ2=9.389,P=0.002);而mrkD在HVKP组中阳性率为72.00%,在cKP组中阳性率为57.14%,无统计学差异(χ2=1.268,P=0.260)。虽然两者在HVKP和cKP组中阳性率均不低,但是fimH比mrkD的特异性更强,故fimH提示为HVKP的可能性更大。
铁对于细菌新陈代谢至关重要,铁摄取系统是细菌重要的毒力分子机制。研究表明kfuBC编码铁摄取系统,是KP重要的毒力因子[9, 20],在K1、K2血清型的HVKP中多见[22]。本研究中kfuBC在HVKP组中阳性率为80.00%,在cKP组中占28.57%,两者差异较大(χ2=14.018,P=0.000),kfuBC可成为HVKP的分子标志物。
KP有4种铁载体——enterbactin、aerobactin、yersiniabactin和salmochelin,其中enterbactin和aerobactin最为常见。有研究认为aerobactin是KP重要的毒力因子,可使毒力增加100倍[6],是HVKP常见的铁载体。它由aero编码合成,而iutA则编码aerobactin的转运体,转运螯合体进入细胞[23-24]。本研究中aero在HVKP组中阳性率为64.00%,在cKP组中阳性率为28. 57%,两者之间有统计学差异(χ2=6.691,P=0.010),提示aero可作为HVKP分子标志物,与既往文献报道相符。王等研究发现引起肝脓肿的毒力较高的KP菌株中aero阳性率超过90%[1]。小鼠实验发现,低毒力、铁载体阴性的KP菌株经基因编辑插入aero后毒力明显增强,而敲除aero的KP突变体毒力和侵袭性明显下降。这些研究都提示aero对KP毒力十分重要,aero阳性可在很大程度上提示高毒力[1, 25]。 本研究中iutA基因在HVKP组中占72.00%,而在cKP组中仅占7.14%,同样差异明显(χ2=23.645,P=0.000),说明iutA可作为HVKP的分子标志物。
铁载体中yersiniabactin在HVKP中可高达90%,其转运体主要由ybtA编码;enterbactin经c-葡萄糖基修饰后成为salmochelin,而iroNB是它的修饰基因。在本研究中yersiniabactin相关的ybtA基因在HVKP组的阳性率(92.00%)高于在cKP组的阳性率(75.00%),但无统计学差异;enterbactin相关的iroNB基因在HVKP组的阳性率为16.00%,而在cKP中未检测到,可能该毒力基因与HVKP的高毒力有关,但由于样本量较小,在统计学上无差异。所以,本研究中暂认为ybtA和iroNB基因不适合作为HVKP的分子标志物。
毒力基因wcaG与荚膜多糖合成相关,编码合成细菌荚膜中岩藻糖成分,有助于逃逸巨噬细胞的吞噬作用[10]。但本研究中wcaG基因在2组的阳性率均不高,在HVKP组占36.00%,在cKP组占25.00%,故认为wcaG可能不适合作为HVKP的分子标志物。
脂多糖由O抗原、核心多糖和脂质组成,是KP重要的毒力因素[6]。wabG是脂多糖核心多糖的合成酶基因之一,uge是UDP-半乳糖醛酸酯异构酶编码基因,与脂多糖合成相关。本研究结果显示,wabG在HVKP组中占92.00%,在cKP组中占82.14%,uge在HVKP组中阳性率为100%,在cKP组中为82.14%,两者阳性率均较高,且无明显差异,不适合作为HVKP的特异性分子标志物。
尿素酶催化尿素分解为氨和二氧化碳,为细菌生长提供氮源[6]。基因簇ureABCDEFG编码尿素酶,其中ureA、ureB和ureC是其主要的结构亚基[26]。allS编码尿囊素调节子激活剂,同时也与铁载体aerobactin生成相关[10, 26]。本研究中ureA阳性率在HVKP组(88.00%)和cKP组(92.86%)差异不大(χ2=0.018,P=0.894);基因allS的阳性率不高,在HVKP组(36.00%)中阳性率高于cKP组(21.43%),但是无统计学差异(χ2=1.382,P=0.240)。ureA和allS基因不适合作为HVKP的分子标志物。
本研究存在的一些不足之处:①样本量较小,若扩大样本量,结论可能会发生改变。比如部分试验数据表明一些毒力基因和血清型阳性率在HVKP组中高于cKP组,但在统计学上无显著差异,若能增大样本量,可能会得到不同的结果。②HVKP为临床定义,即为引起侵袭综合征的KP菌株,未通过动物实验对其高毒力进行验证,研究缺乏足够的严谨性。 ③虽然本文在选择cKP菌株时对临床病例资料进行了筛选,只选择单纯血流感染的病例,剔除合并其他部位侵袭性感染的病例,减少了混入HVKP组的风险,但并不能完全将其笼统地归为cKP组。
