我国免疫规划疫苗现状及安全问题探讨
2019-12-30蒋逸雯汪萱怡朱为瞿涤
蒋逸雯,汪萱怡,朱为,瞿涤*
1. 复旦大学上海医学院基础医学院教育部、卫健委、医科院医学分子病毒学重点实验室,上海 200032; 2. 复旦大学临床医学八年制,上海 200032; 3. 上海生物制品研究所有限责任公司,上海 201403
疫苗在人类与传染病长期抗争中发挥了积极的作用。疫苗接种后,可以刺激机体产生特异性免疫应答,达到特异性预防传染病的目的。因此,进行大规模有计划的疫苗接种,可控制传染病的流行。我国于2005年出台的《疫苗流通和预防接种管理条例》中,将疫苗分为一类疫苗和二类疫苗, 即必须接种且国家免费提供的疫苗为一类疫苗(免疫规划疫苗),根据公民意愿自费接种的疫苗为二类疫苗(非免疫规划疫苗)。然而近年社会上出现了一些疫苗的相关事件,导致公众对疫苗接种产生疑虑[1-3]。世界卫生组织(World Health Organization,WHO)指出,目前对疫苗接种存在6种误解:改善卫生条件比接种疫苗更能预防疾病;很多人即使接种了疫苗仍会患病;不应该接种那些可能存在严重不良反应的疫苗;疫苗可能存在一些未知的长期不良反应;无须接种在居住国家已经灭绝的传染病疫苗;多价疫苗会削弱免疫效果并可能造成接种者免疫紊乱[4]。为了临床医务工作者和民众能更全面地了解我国的免疫规划疫苗,本文将以脊髓灰质炎为例介绍疫苗接种的重要性,同时就我国一类疫苗和二类疫苗的种类及安全性进行阐述。
1 疫苗在预防传染病中的重要作用——脊髓灰质炎的消灭与疫苗
世界上第1个被消灭的传染病是严重危害人类健康的天花。该疾病的消灭应归功于牛痘苗的全球接种和各国政府的共同努力。随后,WHO于1988年发起了消灭脊髓灰质炎的运动,预期在2018年可在全球消灭脊髓灰质炎。虽然目前仍然没有达到该目标,但其全球发病率已由1988年的 350 000 病例数降低至2018年的33例[5]。WHO总干事特德罗斯·阿达诺姆·盖布雷耶苏斯(Tedros Adhanom Ghebreyesus)博士提出,希望在2019年脊髓灰质炎的传播为“零”,高风险区域的每个儿童都能接种到脊髓灰质炎疫苗。
脊髓灰质炎病毒是一种经粪-口途径传播的肠道病毒,5岁以下的儿童易感。1%~2%感染者因病毒穿过血-脑屏障,破坏脊髓前角运动神经元,而患弛缓性肢体麻痹(又称小儿麻痹症),少数成人感染后也可发生肢体麻痹[5]。美国总统罗斯福在40岁时因感染脊髓灰质炎病毒下肢瘫痪后,推动创建了脊髓灰质炎全国基金会,大力支持脊髓灰质炎疫苗的研发[6]。1953年脊髓灰质炎灭活疫苗(inactivated polio vaccine,IPV)—— Salk疫苗面世,1955年开始在美国大规模试用。1957年脊髓灰质炎减毒活疫苗(live oral polio vaccine,OPV)—— Sabin疫苗也开始试用。OPV的接种相当于隐性感染,疫苗毒株可在肠道复制,不仅可刺激机体产生中和抗体,还可激发细胞免疫和局部SIgA,可阻断野毒株病毒的自然传播,但其热稳定差,需在 -20 ℃ 保存并在2~8 ℃条件下(冷链)运输。IPV的安全性和稳定性更好,不会发生毒力返祖,但其激发的免疫应答相对单一、持续时间短,需接种多次,制造成本高于OPV[7](表1)。各国接种的脊髓灰质炎疫苗的类型及接种程序根据自己的国情而定。
表1 脊髓灰质炎减毒活疫苗和灭活疫苗的对比
Tab.1 The comparison between OPV and IPV
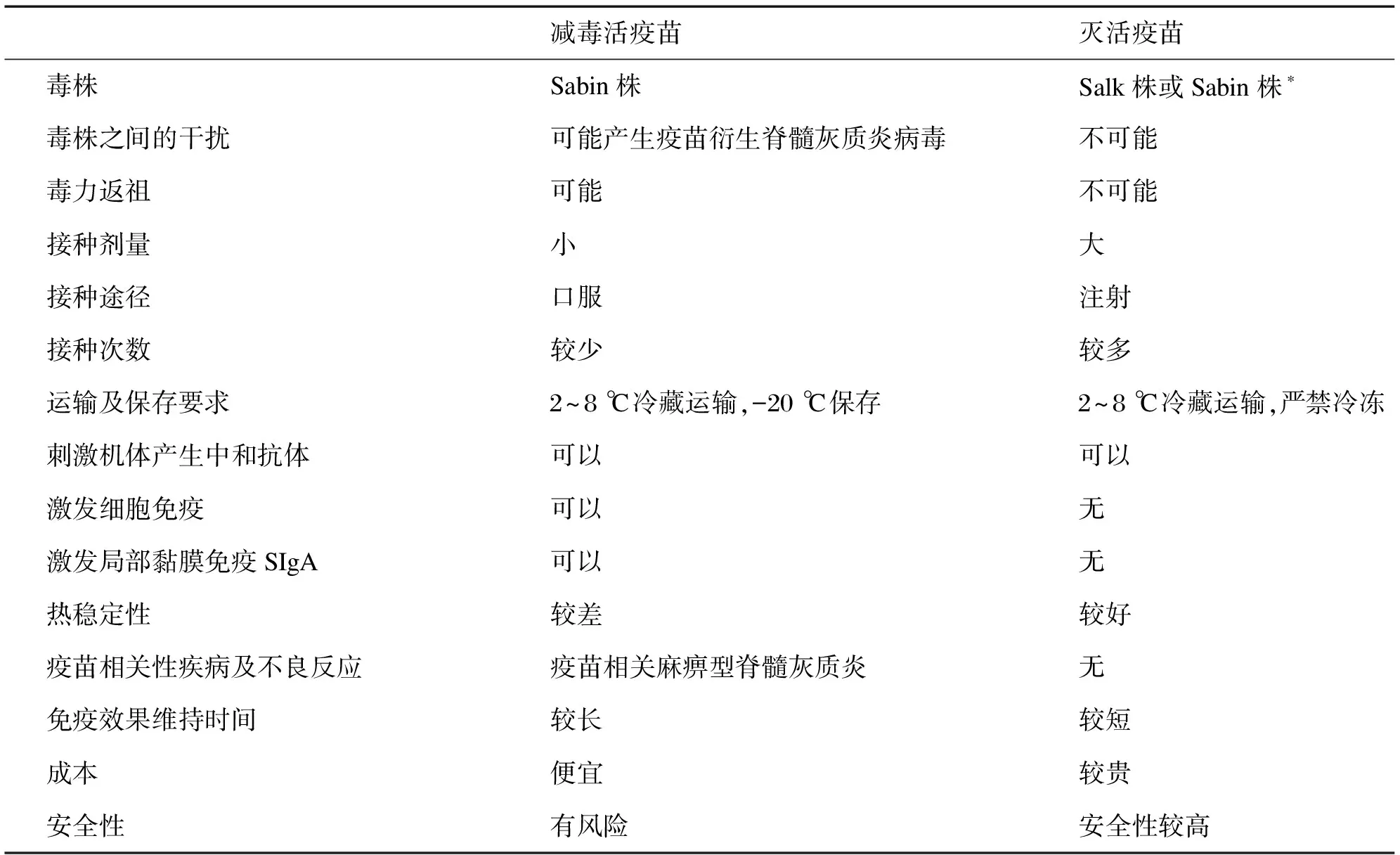
减毒活疫苗灭活疫苗毒株Sabin株Salk株或Sabin株∗毒株之间的干扰可能产生疫苗衍生脊髓灰质炎病毒不可能毒力返祖可能不可能接种剂量小大接种途径口服注射接种次数较少较多运输及保存要求2~8 ℃冷藏运输,-20 ℃保存2~8 ℃冷藏运输,严禁冷冻刺激机体产生中和抗体可以可以激发细胞免疫可以无激发局部黏膜免疫SIgA可以无热稳定性较差较好疫苗相关性疾病及不良反应疫苗相关麻痹型脊髓灰质炎无免疫效果维持时间较长较短成本便宜较贵安全性有风险安全性较高
*: WHO推荐用减毒株,我国国产IPV用减毒株。
在我国免疫规划中,脊髓灰质炎疫苗为一类疫苗。1964年在顾方舟院士的领导下我国自主研发了OPV(糖丸或滴剂,含Ⅰ、Ⅱ和Ⅲ型),并开始在全国范围内推广使用,脊髓灰质炎发病率(2万~4万病例/年)及病死率逐年锐减[8]。2000年,WHO宣布中国为无脊髓灰质炎区域,但我国周边国家如巴基斯坦、阿富汗、印度等仍有脊髓灰质炎病例的报道。2011年我国新疆地区发生了由巴基斯坦输入的脊髓灰质炎病例,经过再次普遍接种OPV,疫情得到了有效控制[9]。WHO于2012年再次宣布我国保持无脊髓灰质炎状态[5]。为了预防输入性脊髓灰质炎,我国仍在进行该疫苗的接种。鉴于Ⅱ型野生型的脊髓灰质炎病毒已在世界范围内消灭,根据WHO的整体安排,自2016年5月起,全球将停用OPV中含有Ⅱ型组分的疫苗,以消除Ⅱ型脊髓灰质炎疫苗株带来的危害[5]。根据WHO的要求,我国自2016年5月1日始在全国范围内进行脊髓灰质炎减毒活疫苗与灭活疫苗接种的转换工作。虽然两种疫苗接种后的免疫效果无明显差异[10],但欧美等发达国家考虑到IPV的安全性更高,于21世纪初已停止使用OPV,而我国及发展中国家仍在使用OPV[11]。我国于2016年5月1日在全国范围内实行的新脊髓灰质炎疫苗接种方案中已全面停用三价减毒活疫苗(tOPV),启用预防Ⅰ型和Ⅲ型的二价减毒活疫苗(bOPV)。首剂疫苗由口服糖丸改为注射IPV,之后3剂为糖丸型或滴剂型bOPV,即1剂IPV+3剂bOPV的免疫程序[12]。转换的主要目的是为了防止疫苗衍生脊髓灰质炎病毒(vaccine derived poliovirus, VDPV)的出现,预防疫苗相关麻痹型脊髓灰质炎(vaccine associated paralytic poliomyelitis, VAPP)的发生。需要引起关注的是,2019年6月在四川省雷波县发现了1例疑似急性弛缓性麻痹的病例,经国家实验室检测,确定为Ⅱ型疫苗衍生脊髓灰质炎病毒。目前,患儿粪便样本检测结果阴性,无脊髓灰质炎体征(http://wsjkw.sc.gov.cn/xx/xwdt/gzdt/201907/t20190704_36833.html)。
2 我国免疫规划疫苗的种类
根据《疫苗流通和预防接种管理条例》第二条,疫苗大致分为两个类别:一类疫苗是指政府免费向公民提供、公民应当依照政府规定受种的疫苗,包括国家免疫规划确定的疫苗,各省、自治区、直辖市人民政府在执行国家免疫规划时增加的疫苗以及县级以上人民政府或者其卫生主管部门组织的应急接种或者群体性预防接种所使用的疫苗;二类疫苗是指由公民自费并且自愿受种的其他疫苗[13]。
我国现行的免疫规划于2007年底颁布,2016年修订,将预防15种传染病的疫苗纳入国家免疫规划一类疫苗,疫苗品种包括在全国范围内使用的乙肝疫苗、卡介苗、脊髓灰质炎灭活疫苗、脊髓灰质炎减毒活疫苗、百白破(百日咳、白喉和破伤风)三联疫苗、白破(白喉和破伤风)二联疫苗、麻风(麻疹和风疹)疫苗、麻腮风(麻疹、腮腺炎和风疹)三联疫苗、A群流脑多糖疫苗、A+C群流脑多糖疫苗、乙脑减毒活疫苗或灭活疫苗、甲肝减毒活疫苗或灭活疫苗[14],以及针对重点地区目标人群和高危人群的流行性出血热(汉坦病毒)疫苗、炭疽疫苗和钩端螺旋体疫苗[15]。相关部门会根据传染病的疫情流行情况进行一类疫苗接种的增补。国内外免疫规划的疫苗种类不尽相同,主要是根据各国的疾病谱、经济实力、民众的接受度等实际国情而决定。
自从我国实行免疫规划以来,传染病预防效果显著。孕产妇和新生儿破伤风已成功消除[16]。5岁以下婴幼儿乙型肝炎表面抗原携带率从 10%下降到1%[17]。结核病的病死率在1990—2014年下降了45%,2017年的发病率已经降至63/10万人,但距离发达国家(低于10/10万人)还有一定差距[18]。然而,疫苗接种也可能引起不同程度的不良反应。本文将我国免疫规划一类疫苗接种的重要性及接种时的注意事项进行了汇总(表2)以供参考。一般而言,患有某些基础疾病(如糖尿病等代谢性疾病、艾滋病等免疫缺陷病、肿瘤等慢性消耗性疾病)的人群接种疫苗时应在专家的指导下进行,综合各因素判断是否可以接种相关疫苗。
此外,中国的首部疫苗法《中华人民共和国疫苗管理法》于2019年6月经人大常务会议通过,并将自2019年12月1日开始施行。严格贯彻执行该法有助于加强疫苗管理,保证疫苗质量和供应,规范预防接种,促进疫苗行业发展,保障公众健康,维护公共卫生安全。
3 我国二类疫苗的种类
相较于一类疫苗,二类疫苗的种类更多。常见的二类疫苗包括流感疫苗、b型流感嗜血杆菌结合疫苗、轮状病毒疫苗、伤寒Vi多糖疫苗、23价肺炎球菌多糖疫苗、ACYW135群脑膜炎球菌多糖疫苗、冻干人用狂犬病疫苗、冻干水痘减毒活疫苗等。二类疫苗中有很多与一类疫苗中预防的部分疾病是相同的,不同点在于疫苗的种类、来源、多价型或联合型等。例如乙肝疫苗,进口者列为二类疫苗,国产者为一类疫苗,接种者可根据自己的经济条件自由选择。但是需要指出的是,根据研究显示,对于15岁以下的儿童,接种国产或进口乙肝疫苗的免疫效果和不良反应发生率相似[24]。本文将常见二类疫苗接种的相关不良反应及注意事项进行了汇总(表3)以供参考。
目前在二类疫苗中最受关注的莫过于HPV疫苗,用于预防HPV感染可能导致的宫颈癌、阴道癌、外阴癌、尖锐湿疣等。根据引起宫颈癌风险程度,将HPV划分为高危型和低危型。研究发现,导致98.8%的宫颈原位癌和90.6%的宫颈浸润癌发生的是HPV 16、18、31、35、39、45、51 、52、56、58、66和68(高危型HPV)[29]。目前涵盖最多亚型的九价HPV疫苗涵盖6个高危型HPV(HPV16、18、31、45、52和58),以及3个引起尖锐湿疣的HPV6、11、33(低危型)。临床研究显示HPV九价疫苗对于HPV6、11、16和18的预防效果不亚于HPV四价疫苗,16~26周岁的女性接种后,可以预防接近90%的宫颈癌和HPV相关外阴、阴道和肛门癌,约70%~85%的宫颈癌前病变,以及90%的肛门生殖器疣[30-33]。完成3针疫苗接种后的血清抗体阳性率几乎全部接近100%,而5年后抗体阳性率为77.5%~100%(不同亚型的血清抗体阳性率不同)[34]。目前HPV疫苗接种主要存在以下问题:①需求量大,尤其是九价疫苗供不应求;②疫苗价格较为昂贵,未进入医保范围,贫困地区妇女和儿童无法负担;③ 疫苗上市时间短,长期效果有待观察;④疫苗接种后存在疼痛、红肿等局部反应,以及发热、乏力、头晕、瘙痒、胃肠道不适等全身反应[28]。此外,目前HPV疫苗仅含9种亚型,覆盖更多亚型的HPV疫苗仍在研究中。
值得注意的是,目前报道的一些接种疫苗后发生的严重不良事件事实上均不是疫苗所致,WHO表示目前没有证据表明需要担心疫苗的安全性问题[35]。其他的二类疫苗目前存在的问题也与HPV疫苗相似,主要是①目标人群普及率不满意;②价格对于贫困人口无法承担;③相较于规划免疫的一类疫苗而言监管不力,可能会导致疫苗安全问题。
4 预防接种的不良反应与疫苗安全
疫苗预防接种的不良事件(adverse events following immunization, AEFI)分为一般反应、异常反应、疫苗质量事故、接种事故、偶合症和心因性反应。其中,一般反应包括接种本身可能引起的接种部位红肿、疼痛,以及特异性免疫反应可能引起的全身反应(包括发热、乏力等),这些都是一过性的,通常会在接种后几天自行消退;异常反应则是在接种了合格疫苗后出现的药品不良反应,包括轻重不一的过敏反应等,其本质是由疫苗本身的特性引起的,相关各方均无过错,发生率也相对较低。而疫苗质量事故是指接种了质量不合格的疫苗所造成的损害,包括疫苗毒株、纯度、生产工艺、附加物、外源性因子、出厂前检定等不符合国家规定[13]。
在接种后可能引起不良反应的疫苗成分中,除了灭活或减毒的微生物以外,还可能是疫苗中添加的佐剂或稳定剂。免疫佐剂的作用是增强疫苗的免疫活性,种类包括矿物盐、微生物提取物、微粒、油乳剂合成佐剂和细胞因子成分[36]。目前,我国获批上市的佐剂只有铝佐剂,临床上接种疫苗后产生的不良反应包括注射部位的红肿、疼痛、皮下结节、接触性皮炎、过敏反应等[37]。此外在疫苗制备过程中使用的原材料也可能引起过敏反应,如使用鸡胚细胞培养毒株制成的疫苗则不宜对卵蛋白过敏者接种。
根据AEFI分类,疫苗质量事故可大致分为两类:一类是由于疫苗在生产过程中未按照批准的工艺进行生产或受到污染或灭活不彻底所致;另一类是在流通环节未严格按照疫苗保存条件运输而导致的。
由于对AEFI的认识不足,疫苗接种的一般或异常反应常被误认为是疫苗质量事故。常见疫苗接种后的一般及异常反应可参见表2和表3。
4.1 生产制备问题导致的疫苗质量事故
生产环节控制不当所产生的疫苗问题危害最为严重,因此我国相关部门对于疫苗生产过程的质控和监管力度很大,一旦发现生产过程中存在违规行为的疫苗,立刻统一召回并销毁。例如,2009年大连金港安迪公司在生产人用狂犬病疫苗时未经许可违法添加核酸佐剂,虽在实验中未对动物造成影响,但可能会对人体造成未知的危害,有关部门发现后及时将问题疫苗召回并销毁[38]。2018年7月国家食品药品监督管理局发现长春长生生物科技有限责任公司生产的冻干人用狂犬病疫苗存在记录造假等违法违规行为,在第一时间控制了所有涉事疫苗,所有涉事批次疫苗均尚未出厂和上市销售[39]。
表2 中国国家免疫规划疫苗一览表
Tab.2 The mandatory vaccination program in China

一类疫苗种类及制备[7]接种时间接种方法预防疾病感染后严重后果接种后不良反应禁忌证[7]卡介苗减毒活疫苗,马铃薯培养基或液体培养基培养出生时皮内注射(严禁皮下或肌内注射)结核病肺内原发感染可导致婴幼儿粟粒样结核,肺外感染可导致肠结核、结核性腹膜炎等一般反应:局部红肿、溃疡和局部淋巴结肿大,一过性发热;异常反应:多淋巴结炎,极罕见骨骼炎和播散性结核病[19]对疫苗成分过敏者,免疫力低下者,进行性神经系统疾病患者,发热、腹泻等急性疾病患者,严重湿疹等皮肤病患者;孕妇脊髓灰质炎疫苗IPV:减毒株灭活疫苗,Vero细胞培养,经甲醛灭活; OPV:减毒活疫苗,人二倍体细胞培养2月龄、3月龄、4月龄各1次,4岁加强免疫1次 IPV:肌内注射;OPV:液体型或糖丸型口服脊髓灰质炎可导致脊髓灰质炎、脑膜炎、弛缓性肢体麻痹,甚至导致延髓麻痹而死亡IPV和OPV接种后的一般反应:发热、恶心、呕吐、腹泻、皮疹;异常反应:严重过敏及极罕见的神经系统反应。IPV可导致注射部位肿痛、硬结,OPV有极低概率毒力返祖,引起疫苗相关麻痹型脊髓灰质炎[20]IPV:发热、腹泻等急性疾病患者;孕妇; OPV:免疫缺陷或免疫抑制治疗患者;乳制品严重过敏患者(禁服糖丸,可用液体型),发热、腹泻等急性疾病患者;孕妇乙肝疫苗基因工程重组疫苗,酵母或CHO细胞中表达,加入铝盐佐剂出生时1月龄,6月龄上臂三角肌肌内注射(臀部注射无效)乙型肝炎病毒感染暴发性肝炎常出现肝性脑病;慢性乙肝可导致肝硬化和肝癌安全性良好,很少发生不良反应,少数有一过性发热或注射部位红肿、疼痛、硬结;极罕见局部无菌性化脓和超敏反应对疫苗成分过敏者,进行性神经系统疾病患者,发热、急性或慢性严重疾病患者;孕妇百白破疫苗无细胞联合疫苗,经甲醛、硫柳汞等灭活,加入铝盐佐剂3月龄、4月龄、5月龄各1次,18月龄加强1次肌内注射百日咳、白喉、破伤风婴幼儿百日咳、白喉可造成窒息、惊厥等,可致死亡;新生儿破伤风起病急,死亡率极高。一般反应:注射部位局部红肿、疼痛、发痒,低热,困倦,易激怒,食欲减退等;异常反应极罕见,包括局部无菌性化脓、超敏反应、过敏性紫癜、血管神经性水肿、神经系统反应等对疫苗成分过敏者,进行性神经系统疾病患者,发热、腹泻等急性疾病患者

(续表2)
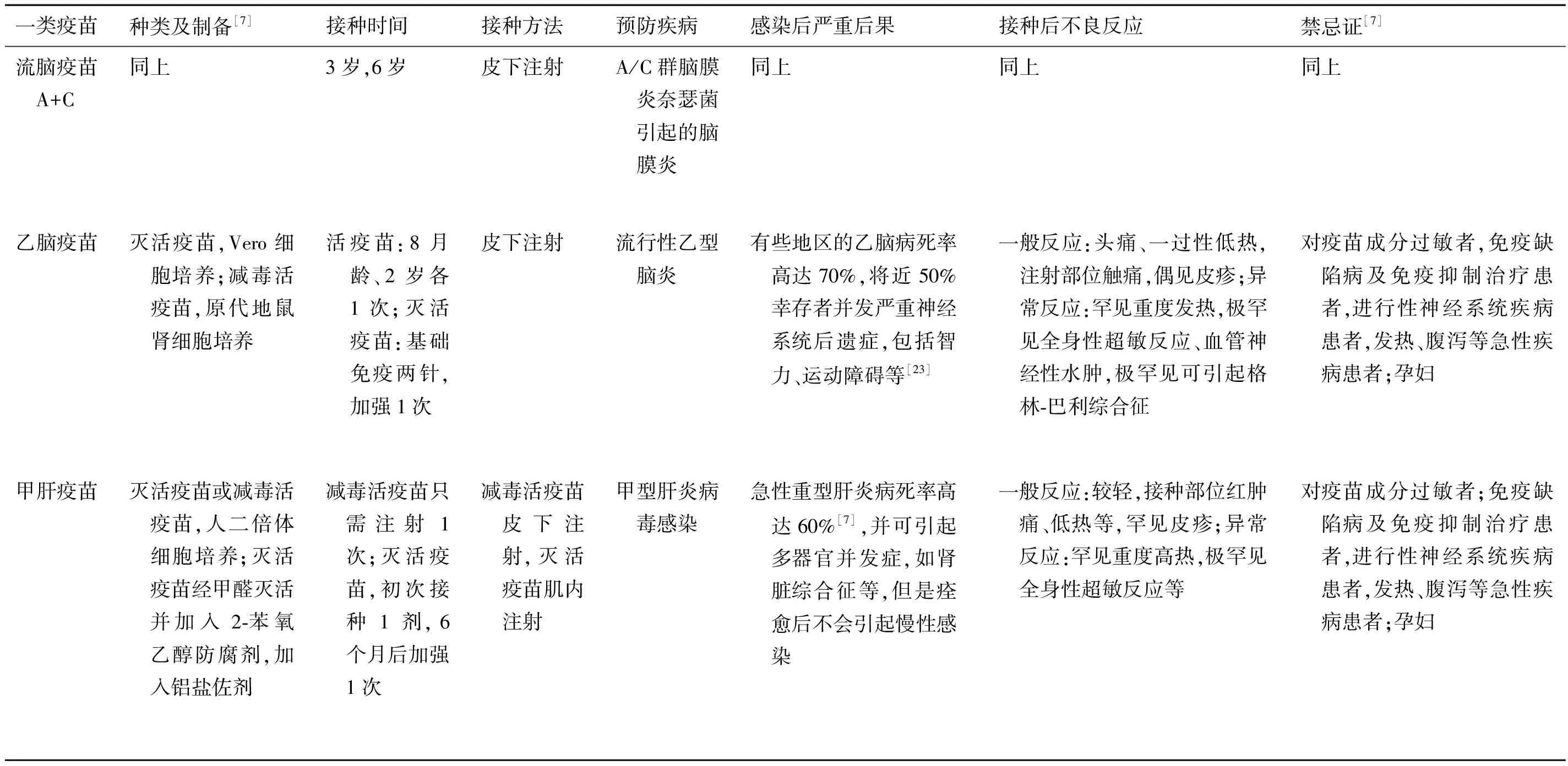
(续表2)
表3 常见二类疫苗
Tab.3 Common alternative vaccinations in China

疫苗种类预防疾病接种对象及时间接种后的不良反应禁忌证[7]流感全病毒灭活疫苗灭活疫苗流行性感冒12岁以上儿童、成年人及老人一般反应为注射部位疼痛、红肿、瘙痒以及一过性发热、头痛等,罕见严重高热,极罕见全身过敏反应、神经系统症状等对疫苗成分过敏者,发热、腹泻等急性疾病患者,格林-巴利综合征患者;孕妇流感病毒裂解疫苗灭活疫苗同上6月龄~3岁儿童接种2剂;成人及3岁以上儿童接种1剂同上同上轮状病毒疫苗减毒活疫苗轮状病毒感染引起的腹泻、发热、呕吐等6月龄~3周岁每年口服1次;3周岁~5周岁的儿童口服1次一般反应为接种部位的红肿痛及一过性的发热、腹泻;异常反应极少,主要为肠套叠免疫缺陷病及免疫抑制治疗患者,发热、腹泻等急性疾病患者,慢性胃肠炎及肠套叠患者,心、肾功能不全者b型流感嗜血杆菌(Hib)疫苗多糖结合疫苗Hib相关疾病如中耳炎、脑膜炎、肺炎等2~6月龄者接种3剂,18个月时加强1剂;6~12月龄者2剂,18月龄时加强1剂;1~5岁者只需1剂。安全性很高,一般反应为接种部位轻微红肿痛、一过性发热,偶见非典型皮疹[25]对疫苗成分过敏尤其是破伤风类毒素过敏者,发热、腹泻等急性疾病患者,严重心脏疾病、高血压、肝脏疾病、肾脏疾病患者伤寒Vi多糖疫苗多糖疫苗伤寒沙门菌引起的肠热症2周岁以上一般反应为注射部位的压痛、发热等,极罕见异常反应包括过敏性皮疹[26]对疫苗成分过敏者,急性疾病期患者23价肺炎球菌多糖疫苗多糖疫苗肺炎链球菌引起的脑膜炎、肺炎、菌血症、中耳炎等2周岁以上一般反应为注射部位的红肿痛,异常反应一般为速发型过敏引起的喉头水肿等发热、腹泻等急性疾病患者

(续表3)
4.2 流通环节问题导致的疫苗质量事故
2016年3月的山东疫苗事件涉及的主要是二类疫苗,警方查获了25种未经严格冷链运输的二类疫苗,总价值达到5.7亿元[40]。事件发生后国家卫生计生委办公厅颁布了《关于加强预防接种工作规范管理的通知》,加强了对二类疫苗的监管[41]。然而,民众对于疫苗的信任度下降。在山东疫苗事件发生后1个月,江苏省的一类及二类疫苗接种率立刻下降了近20%[40]。需要强调的是,山东疫苗事件涉及的二类疫苗本身质量合格。疫苗如果在转运过程中未按要求进行冷链运输和保存,可能会部分或完全失去免疫活性。注射这类失效疫苗虽无毒副作用,但其最主要危害在于失效的疫苗不能激发有效保护力,达不到预期的预防相关传染病的效果。
自从我国在2005年出台的《疫苗流通和预防接种管理条例》中开放二类疫苗市场化后,二类疫苗的安全事件要显著多于国家统一采购、运输和管理的一类疫苗,其中大部分事件是因为在流通过程中缺乏有效的监管制度。虽然目前国内发生的疫苗事件主要涉及二类疫苗,但是一旦出现疫苗安全事件,也会对一类疫苗的接种率造成影响。必须指出的是,通过正规途径接种的疫苗,其安全性是值得信赖的。疫苗在预防传染病中发挥着至关重要的作用,如果不接种疫苗可能会导致传染病的再次流行或暴发,对个人和社会产生严重后果,故绝对不可因噎废食。一些发达国家也有过类似的教训,近期美国反疫苗运动的兴起使得美国民众开始质疑疫苗接种,许多父母通过提交宗教信仰医疗豁免逃避疫苗接种,导致麻疹在多个州暴发流行[42]。
4.3 国外疫苗安全性事件
回顾历史,疫苗安全性事件的发生不限于我国,欧美发达国家也曾发生过多起大型事件。1955年美国的卡特制药厂事件属于疫苗生产缺乏常规监控而导致的结果。由于其所生产的疫苗灭活不彻底,260人感染Ⅰ型脊髓灰质炎[43]。惨痛的代价催生了严格的疫苗监管体系。如今美国只有4家公司有资格生产疫苗,从疫苗的研发到生产、运输、储存、使用,再到反馈,都有非常严格的监管措施。美国疾病控制与预防中心(Center for Disease Control and Prevention,CDC)和美国食品和药物监督管理局(Food and Drug Administration,FDA)下属有专门监管疫苗安全的团队,任何程度的违规操作都会带来严厉的惩罚。除此之外,美国还设立了疫苗不良事件报告系统(Vaccine Adverse Event Reporting System, VAERS),进一步加强疫苗安全监管[44]。具体而言,VAERS的主要职责包括:①及时发现新出现的特殊或罕见不良反应;②监控已知不良反应的发生率;③辨别发生不同异常反应的危险人群;④辨别频发不良反应的疫苗种类;⑤评估新上市疫苗的安全性[45]。正是因为有如此严密、完善的监管系统,美国近年来很少发生疫苗事件,民众对于疫苗安全的信任度也较高。
2011年,我国首次通过了WHO开展的国家监管能力评估,并于2014 年和2017年分别通过再评估,表明我国疫苗国家监管体系已达到或超过WHO的全部标准,疫苗的生产过程、安全性和有效性均符合国际标准。但是长春长生疫苗事件及其他在疫苗生产领域发生的不安全事件提示,我国疫苗生产企业和疫苗流通领域所涉机构必须加强行业自律,在疫苗的监管上或许可以借鉴其他国家的经验,提高公信力,加强宣传教育,进一步改善我国的疫苗安全监管体系。
除此之外,新闻媒体在发生疫苗相关事件后的舆论引导上也有着至关重要的作用。不论是在初期起到传播作用的自媒体,还是在后期起到引导作用的传统媒体[46],都要秉持客观、公正的原则,不隐瞒真相,也不夸大实情,在疫苗安全这一社会问题中承担起应有的职责。
5 展望
疫苗可以从消灭病原体、切断传染源和减轻症状三方面有效控制相应的传染病,对于延长人类寿命、提高生活质量以及对维持社会经济发展和稳定有着不可忽视的重要贡献。虽然近几年发生了多起疫苗安全性事件,但是挑战与机遇并存,在疫苗研发与安全性提高方面,科学家们也始终不懈努力,致力于提高疫苗纯度、去除疫苗中的防腐剂、发明新的生产及检测技术等,相关职能部门正在不断完善疫苗的安全监管体系,政府将不断扩大一类疫苗的种类,新闻媒体在应对疫苗相关事件中,也逐渐发展出成熟的社会舆论引导和危机处理系统。相信在未来,我国的疫苗免疫规划程序可以造福更多公民。
