IgA和IgM双克隆型淋巴浆细胞淋巴瘤1例报道
2019-12-26郭振兴
郑 力,郭振兴
(清华大学第一附属医院血液肿瘤科,北京 100016)
淋巴浆细胞淋巴瘤(LPL)是一种少见的惰性成熟B细胞淋巴瘤,90%~95%的LPL分泌单克隆性IgM,称为华氏巨球蛋白血症(WM),仅小部分LPL分泌单克隆性IgA、IgG或不分泌单克隆免疫球蛋白[1]。现首次报告1例同时分泌IgA和IgM双克隆型LPL,并结合文献进行复习,以提高对此类疾病的认识水平。
1 临床资料
患者,男,86岁,主因“乏力7年,加重伴纳差3月,发热1 d”于2018年4月12日入住本院。患者2011年无明显诱因出现乏力,外院发现重度贫血,肾功能不全(具体不详),血红蛋白最低为42 g/L,给予补充造血原料、促红细胞生成素(EPO)、间断输血支持治疗后,血红蛋白维持在50~65 g/L。2018年1月,患者乏力加重,活动耐量下降,伴纳差、反酸,无腹痛、腹泻,无牙龈出血,无黑便、鲜血便,无咯血、呕血,无血尿。就诊当地医院,查血常规提示:重度贫血(具体不详),诊断为“肾性贫血”,予EPO(10 000 IU皮下注射QW)治疗,同时补充铁剂、叶酸、维生素B12等治疗,效果欠佳。入院前1天,患者无明显诱因出现发热,体温最高为37.7 ℃,无畏寒、寒战,无咳嗽、咳痰,无盗汗、消瘦,为进一步诊治入院。既往有慢性支气管炎、肾囊肿、慢性肾功能不全病史。2013年患脑出血,无后遗症。入院查体:体温 37.7 ℃,心率106次/分,呼吸 18次/分,血压118/66 mm Hg,神清语利,重度贫血貌,全身浅表淋巴结未及肿大,胸骨中下段无压痛,双肺呼吸音低,未闻及干湿罗音,心界不大,心率106次/分,律齐,各瓣膜听诊区未闻及病理性杂音。腹软,肝脾肋下未触及,双下肢无水肿。入院后查血常规:白细胞 2.75×109/L,血红蛋白36 g/L,平均红细胞体积115.5 fL,网织红细胞比例2.12%,血小板142×109/L。肾功能:尿素氮20.40 mmol/L,肌酐 347.0 μmol/L。肝功能及乳酸脱氢酶未见异常。C反应蛋白 5.55 mg/L。血β2微球蛋白 17.84 mg/L,尿β2微球蛋白>88.0 mg/L。24 h尿总蛋白1 019 ng/L,24 h尿清蛋白 73.7 ng/L。贫血组合示铁蛋白、维生素B12 、叶酸不低。肝炎系列阴性。大便潜血(-)。腹部彩超:右肾囊肿。考虑浆细胞肿瘤,行免疫固定电泳:免疫球蛋白及尿轻链测定:IgA 969 mg/dL,IgM 571 mg/dL,IgG 614 mg/dL,IgE<18.2 IU/mL,κ轻链1 580 mg/dL,λ轻链186 mg/dL。尿蛋白κ轻链90.4 mg/dL,λ轻链<5 mg/dL;免疫固定电泳中可见M成分IgA-κ;IgM-κ,尿κ轻链定量高于参考范围(图1)。进一步骨髓细胞形态学结果显示:骨髓增生明显-极度活跃;粒系占13.4%;红系占7.4%;淋巴细胞占76.8%,大部分细胞形态异常:胞体小,染色质不均匀、呈块状,胞质量少或极少,边缘比较整齐。少部分细胞胞浆深染,泡沫感,呈浆细胞样改变。少部分细胞隐约可见核仁;浆细胞占1.2%,双核浆细胞可见;全片见巨核细胞89个。考虑:淋巴瘤可能(图2)。骨髓活检:骨髓有核细胞增生较活跃,三系造血细胞少量残存,可见淋巴细胞样细胞弥漫增生,细胞体积小,胞质丰富,淡染,核中等偏小,类圆或不规则,染色质粗块状,核仁不明显,分裂相少见,部分细胞可见浆样分化,诊断考虑:非何杰金氏淋巴瘤,成熟小B细胞类淋巴瘤可能性大(图3)。骨髓单个核细胞流式细胞术检测:(1)44.37%细胞(占有核细胞)表达ckappa dim、CD19、bcl-2,部分表达CD38、CD20、CD180、CD79b,不表达CD2、CD117、CD56、CD3、CD4、CD8、CD7、clambda、CD229、CD138、CD11c、kappa、lambda、CD5、Ki67、CD10、FMC7、CD103、CD25、CD23、TDT、CD200,为恶性单克隆成熟B细胞,细胞小。(2)1.16%细胞(占有核细胞)表达ckappa、CD38、CD138、CD229dim,部分表达CD19,不表达lambda、CD56,为单克隆浆细胞。考虑为有浆细胞分化的成熟小B细胞淋巴瘤。染色体核型:46,XY[19];另见一个核型为:46,XY,del(2)(q21)[1]。进一步查骨髓MYD88基因突变:检测到MYD88基因c.794T>C/P.L265P位点突变。结合上述实验室检查,患者诊断为:IgA和IgM双克隆型LPL。因患者高龄,患者及家属放弃化疗及靶向治疗,予间断输注压积红细胞、应用EPO等对症支持治疗。目前随访中。
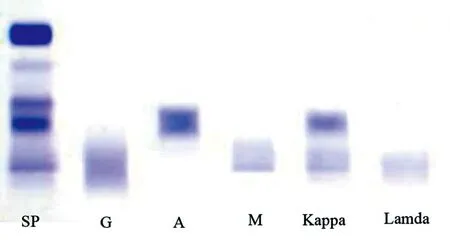
注:血清蛋白电泳及免疫固定电泳中可见M成分IgA-κ;IgM-κ
图1M蛋白测定

注:大部分淋巴细胞形态异常,少部分呈浆细胞样改变,双核浆细胞可见(HE染色)
图2骨髓细胞形态学

注:可见淋巴细胞样细胞弥漫增生,部分细胞可见浆样分化
图3骨髓活检
2 讨 论
LPL是一种少见的惰性成熟B细胞淋巴瘤,在非何杰金氏淋巴瘤中所占比例<2%。在世界卫生组织(WHO)淋巴与造血组织分类中,LPL定义为由小B淋巴细胞、浆细胞样淋巴细胞和浆细胞组成的淋巴瘤,通常累及骨髓、淋巴结和脾脏,同时不符合其他任何一种可能伴浆细胞分化的小B细胞淋巴瘤诊断标准[1]。LPL是一种兼具B淋巴细胞、浆细胞特点的少见的特殊类型的非何杰金氏淋巴瘤。由于此病发病率低,临床表现多样,故极易误诊。90%~95%的LPL分泌单克隆性IgM,称为WM。仅小部分LPL分泌单克隆性IgA、IgG成分或不分泌单克隆免疫球蛋白[1]。该患者血清免疫固定电泳中可见M成分IgA-κ及IgM-κ,为双克隆型,极为罕见。YI等[2]曾报告4例LPL患者同时分泌IgM和IgG异常免疫球蛋白,目前尚无同时分泌IgM和IgA异常免疫球蛋白的LPL病例报道。邹德慧等[3]对13例非IgM型 LPL和120例WM患者临床资料进行了回顾性分析总结,CAO等[4]对比了17例非IgM型LPL患者和312例典型WM患者的临床资料,得出了相同的结论:非IgM型LPL患者和IgM型LPL患者具有相似的临床和生物学特征。目前,非IgM型LPL的诊治参照IgM型LPL(WM)进行[1]。LPL患者诊断时最常见的症状是乏力和易疲劳,这主要和贫血相关[5-6]。该患者乏力7年,以重度贫血及肾功能不全为主要临床表现,贫血考虑为大量小B细胞、浆细胞样淋巴细胞及浆细胞广泛的骨髓浸润所致。该患者尿蛋白κ轻链明显升高,肾功能损伤考虑为过多轻链从肾小球滤过后被肾小管重吸收对肾小管的损伤所致。WM表达B细胞相关抗原,例如:CD19(+),CD20(+),CD22(+),CD5(+/-),CD10(-),CD23(-),CD103(-)[1,6]。CD38和CD138常表达于单克隆浆细胞表面[4,7]。该患者CD19(+),CD20(+),CD5(-),CD10(-),CD23(-),CD103(-),为恶性单克隆成熟B细胞,极少部分细胞表达CD38及CD138,考虑为有浆细胞分化的成熟小B细胞淋巴瘤。MYD88-L265P基因突变的检测对LPL的诊断及治疗具有重要意义。90%以上的WM患者存在功能获得性MYD88-L265P基因突变[1,6-8]。非IgM型LPL MYD88L-265P突变的频率低于IgM LPL(WM),但也是其标志性分子生物学特征[4,7]。该患者基因MYD88-L265P阳性,进一步支持LPL诊断。
LPL具有低度恶性B细胞淋巴瘤特点,病程较长,经治疗可缓解,但不能治愈,自然病程约为5~10年。“观察和定期复查”是无症状LPL患者的标准治疗策略[6,9]。由华氏巨球蛋白血症国际工作组第2次会议(IWWM-2)提出,第8次IWWM确认,WM开始治疗的指征为IgM相关并发症和/或肿瘤侵犯骨髓相关症状如全血细胞减少/躯体症状,以及髓外大包块[10]。利妥昔单抗与化疗药物的联合方案是WM/LPL患者的首选治疗方案[1,6,8,10]。Benda-R方案(苯达莫司汀联合利妥昔单抗)和CHOP-R方案(环磷酰胺、多柔比星、长春新碱及泼尼松联合利妥昔单抗)有效率相似(95%),但Benda-R方案无进展生存期(PFS)更长,且耐受性更好[6,10]。高黏滞综合征患者应进行血浆置换[7,10],单药利妥昔单抗可导致一过性IgM水平升高,故这些患者第一周期化疗应避免应用利妥昔单抗,或联合苯达莫司汀或硼替佐米[6,9]。蛋白酶抑制剂对WM患者有效率很高[6,8-9],国外有文献报道BDR(硼替佐米+利妥昔单抗+地塞米松)有效率为85%,但46%的患者出现了周围神经病变[9]。第二代蛋白酶抑制剂卡非佐米的神经毒性风险明显减低[6,8-10]。BTK抑制剂依鲁替尼是FDA唯一批准用于治疗WM的药物,可用于初治及复发患者[6,8-10]。干细胞移植用于年轻、多次复发或原发耐药的患者[10]。该患者因高龄及经济因素,家属放弃化疗及靶向治疗,采取姑息支持治疗,目前已存活7年。
3 小 结
综上所述,LPL是一种少见的惰性成熟B细胞淋巴瘤,随着分子遗传学的进一步研究及新药的研制,LPL的诊疗方法将更加完善。研究者首次报道1例IgA和IgM双克隆型LPL,由于该病极其罕见,今后的临床实践中需要进一步积累资料,提高对该病的认识水平。
