人工肝联合CRRT治疗复杂先心病术后肝衰竭的临床研究
2019-12-26刘小燕周德江
刘小燕,陈 欣,周德江
复杂先心病是严重危及患儿生命的一组先天性心脏疾病,具有病情复杂、治疗困难、病死率高等特点,目前主要的治疗方式是采用体外循环(CPB)辅助下外科手术治疗。CPB的体外转流过程致使患儿被迫处于控制性休克状态[1],而肝脏细胞对缺血缺氧的耐受较差,所以,CPB极易引起肝细胞代谢功能受损。10%~20%CPB辅助下心内直视术后的患儿,术后第2~3 d胆红素和转氨酶显著增高,表明患儿存在不同程度的肝功能损害[2];而4%的患儿CPB术后会出现肝衰竭[3]。肝衰竭是肝脏功能失代偿的终末状态,其病死率甚至可达75%~80%[3]。目前,临床多采用人工肝血浆置换的方式对CPB术后肝衰竭患儿进行治疗。笔者在临床工作中发现,人工肝血浆置换联合CRRT可以更有效地改善患儿肝功能,本研究对此进行了总结分析,以为该技术的临床应用提供证据。
1 资料与方法
1.1 病例资料 2013年1月~2018年11月医院心血管外科收治26例复杂先心病术后肝衰竭的患儿,其中2013年1月~2015年11月采用人工肝治疗的共12例,作为人工肝组(n=12例),2015年12月~2018年11月在人工肝治疗基础上联合CRRT治疗的共14例,作为联合组(n=14例),均符合肝衰竭诊断标准[4]。 入选标准:(1)年龄 4~13 岁;(2)CPB下行心内直视手术;(3)术后2~3 d出现肝衰竭。排除标准:(1)入 ICU 时间<48 h;(2)有颈静脉置管及股静脉置管禁忌;(3)因各种原因(如患儿家属拒绝接受人工肝及CRRT治疗)未能行人工肝或CRRT治疗的患儿。
1.2 治疗方法 两组均采取全身支持以及药物对症治疗。人工肝组行人工肝血浆置换治疗,采用Prisma机型和TPE1000滤器,选择PE治疗模式,温度设置为36℃,血流量50~70 ml/min,置换速度150~200 ml/h。抗凝药物选择低分子肝素,首剂35~40 U/kg,肝素钠输注速度维持 25~30 U/(kg·h),监测ACT频率为30 min/次。联合组在人工肝血浆置换治疗前2 h内行CRRT,采用CVVH治疗模式,根据患儿血压调节血流速度,置换量为15~20 ml/(kg·h),透析量为20~30 ml/(kg·h)。每位患儿至少连续治疗3 d,每次治疗时间24 h。
1.3 检测指标 分别记录治疗前1 d和治疗后1、3 d,检测患儿的肝功能和凝血指标,包括白蛋白(ALB)、总胆红素(TBIL)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、凝血酶原时间(PT)等;评估急性和慢性健康状况评分系统(APAECHE-Ⅱ)和序贯性器官衰竭评估(SOFA)评分。
1.4 统计学方法 应用SPSS22.0统计软件分析,计数资料用频数和百分率表示,采用χ2检验;计量资料以均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 两组各项临床指标比较无统计学差异(P>0.05,表 1)。
2.2 两组治疗前后肝功能和凝血指标比较 在治疗后 1、3 d, 两组 ALT、TBIL、AST 和 PT 均逐渐降低,而ALB逐渐升高,且联合组的改善幅度均大于人工肝组(P< 0.05,表 2)。
2.2 两组治疗前后APAECHE-Ⅱ和SOFA评分比较 在治疗后1、3 d,两组APAECHE-Ⅱ和SOFA评分均逐渐降低,且联合组均低于人工肝组(P<0.05,表 3)。
3 讨论
肝衰竭是复杂先心病患儿术后出现的严重并发症,其发病机理尚不明确,可能与手术创伤以及术中CPB对心肌的损伤有关。复杂先心病的婴幼儿的心血管系统未完全发育成熟,手术创伤及心肌缺血再灌注损伤对未成熟的心肌影响较大[5]。血液灌注不能供给组织细胞需要,导致代谢障碍,继而发生功能障碍,严重时甚至会导致坏死,从而引起全身多个器官功能障碍[6]。肝细胞对缺血缺氧更为敏感且耐受差。因此,肝脏更容易受到体外循环的影响而造成器官功能障碍,在肝细胞大量坏死的情况下,极易发展为肝功能衰竭。ALF病情危重且预后差,是复杂先心病患儿围手术期的主要致死原因之一[7]。因此,治疗复杂先心病患儿术后ALF的核心在于减少肝细胞变性坏死以及体内毒素蓄积,促使肝细胞再生。非生物型人工肝是治疗ALF最常用的方法[8],在成人ALF治疗中得到了肯定[9]。但是人工肝治疗在复杂先心病患儿术后ALF这一领域应用较少,目前尚无统一的治疗方案。

表1 两组一般资料比较
人工肝血浆置换治疗的原理是,暂时替代部分肝脏的功能,通过血浆分离器将含有毒素的血浆和致病物质滤出,同时用相同量的新鲜血浆进行置换,并适量补充凝血因子和白蛋白,以达到维持患儿内环境稳定的目的,为肝细胞的修复提供更多的时间。因肝细胞大量坏死变性而产生并蓄积的各种毒素,因该疗法可得到清除,阻断了肝脏的进一步受损,最终促进肝脏自我修复而提高患者存活率。国外的研究显示,CRRT能够有效调整机体内环境,使全身各个器官维持稳定,还能够改善患者免疫细胞功能,起到重建体内免疫状态的作用[10]。而且由于CRRT在稳定血液中溶质浓度及容量变化中具有较强的优势,中国心脏重症连续性肾替代治疗专家共识建议,术后早期应用CRRT治疗[11-12]。
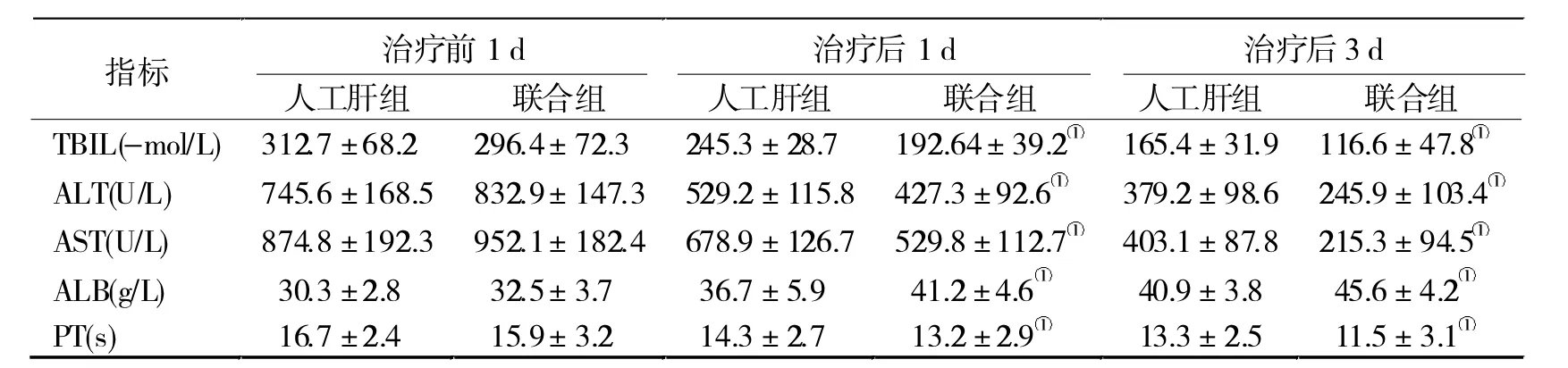
表2 两组治疗前后肝功能和凝血指标比较

表3 两组治疗前后APAECHE-Ⅱ和SOFA评分比较
尽管人工肝和CRRT对ALF的治疗效果均较为显著,但是二者联合治疗ALF的研究较少。本研究发现,联合组在治疗前1 d、治疗1 d、治疗3 d后,TBIL、ALT、AST明显降低,较人工肝组有显著差异(P<0.05),表明联合组肝功能改善效果更显著。同时还发现,联合组较同时间的人工肝组ALB水平明显升高,PT显著缩短。这两项指标对肝功能损害均较为敏感,表明人工肝联合CRRT治疗能够明显改善患儿肝功能,促进和维持机体内环境的稳定。不仅如此,在治疗后1、3 d,两组APAECHE-Ⅱ评分和SOFA评分均逐渐降低,且联合组均低于人工肝组,提示人工肝支持治疗是有效的,而联合使用CRRT治疗的效果更好,可进一步提高疗效[13]。
综上所述,人工肝联合CRRT治疗能明显改善复杂先心病患儿术后肝功能衰竭,为复杂先心病患儿术后肝功能衰竭的治疗提供新的临床思路。
