Poly I:C刺激对裸鼹鼠和小鼠巨噬细胞PKR/eIF2α信号通路影响的比较研究
2019-12-25林丽芳张成财张倩倩李壘辰杨文静崔淑芳
林丽芳, 张成财, 李 煜, 张倩倩, 陈 超, 李壘辰, 杨文静, 李 莉, 崔淑芳
(海军军医大学基础医学院实验动物学教研室, 上海200433)
裸鼹鼠属于掘地动物,其生活的洞穴环境阴暗潮湿, 通风条件不良, 易滋生各种有害微生物。但裸鼹鼠在这种极端环境中寿命能长达30年以上,是同等体型啮齿类动物的10倍左右[1,2], 有研究[3,4]证实与小鼠比较,裸鼹鼠细胞对很多有害物质(如百草枯、高温、重金属、DNA损伤剂、有害异物等)具有更强的抗性。这提示裸鼹鼠在长期的进化中演变出较强的抗疾病损伤能力。因此, 本课题组前期通过聚肌胞苷酸(polyinosinic-polycytidylic acid,Poly I:C)刺激裸鼹鼠后,检测裸鼹鼠肠道组织的病理变化、炎症因子表达、自噬标志蛋白—微管相关蛋白1轻链3B (microtubule-associated protein 1 light chain 3B, LC3B)的表达水平,结果显示,裸鼹鼠具有一定的抗Poly I:C刺激能力[5]。基于该实验结果, 课题组使用Poly I:C干预裸鼹鼠和小鼠的骨髓巨噬细胞,研究Poly I:C的效应蛋白双链RNA依赖性蛋白激酶R(double-stranded RNA-dependent protein kinase,PKR)及其下游因子真核细胞翻译起始因子2α(eukaryotic initiation factor 2α, EIF2α)表达, 以期为裸鼹鼠的抗 Poly I:C刺激机制研究提供分子生物学参考依据。
巨噬细胞由单核细胞移行到各个组织分化成熟而形成,是一种具有强大吞噬功能的免疫辅佐细胞,在机体正常生理过程和病理过程中发挥重要功能。巨噬细胞能够吞噬细菌、病毒、凋亡细胞、抗原抗体复合物等[6,7]; 具有较强的抗原处理和递呈能力[8]; 分泌多种细胞因子发挥免疫调节及介导炎症反应[9,10]。其中,抗病毒能力是巨噬细胞最为重要的功能之一,是病毒感染后作用于病毒的主要吞噬细胞。因此,本研究使用巨噬细胞为对象进行干预实验。
PKR作为病毒产物双链RNA的直接效应蛋白,在抗病毒过程中发挥重要作用。首先能够产生免疫调节因子调节机体的抗病毒作用。其次通过磷酸化下游因子EIF-2α而阻断病毒蛋白的复制。最后PKR能通过激活Fas(一种跨膜蛋白)通路,来激活下游的Caspase-8诱导凋亡的产生,诱导病毒感染的细胞走向凋亡。因此,本实验通过研究裸鼹鼠巨噬细胞的PKR/eIF2α信号通路在Poly I:C刺激中发挥的作用,以期为裸鼹鼠抗病毒功能研究提供可靠的分子调节机制。
1 材料与方法
1.1 实验动物
SPF级C57BL/6J小鼠8只,6~8周龄,雌雄各半,购自上海斯莱克实验动物有限公司[SCXK(沪)2017-0002]; 10~12月龄裸鼹鼠8只,由海军军医大学实验动物中心繁殖,饲养于海军军医大学实验动物中心普通级动物饲养设施内。
1.2 仪器及试剂
主要仪器有:低温高速离心机、垂直电泳仪、凝胶成像系统、三气培养箱等。
主要试剂有:Poly I:C、2-AP、M-CSF均购自美国Sigma公司。DMEM(低糖、高糖)培养基购自美国Gibco公司。Anti-PKR抗体(ab184257)、Anti-PKR (phospho T446)抗体(ab32036)均购自英国Abcam公司; Phospho-eIF2α(Ser51) (D9G8) XP®Rabbit mAb 抗体(3398S)、eIF2α 抗体(9722S)购自美国 Cell Signaling Technology公司;Caspase 8抗体(13423-1-AP)购自美国Proteintech公司。
1.3 骨髓来源巨噬细胞的分离培养
1.3.1 小鼠骨髓来源巨噬细胞的分离培养 每只小鼠使用2 mL体积分数0.75%戊巴比妥钠腹腔注射过量麻醉处死,体积分数75%乙醇溶液浸泡后转移至超净台,无菌环境中分离小鼠的后肢股骨和胫骨;先剥离皮肤和肌肉,去除两端的结缔组织,暴露骨髓腔,用1 mL注射器轻轻插入骨髓腔,用完全培养基冲洗骨髓腔,制成单细胞悬液; 离心后弃上清,红细胞裂解液裂解红细胞,补加完全培养基终止裂解,离心后弃上清,完全培养基重悬细胞,37 ℃, 5% CO2培养 8~12 h; 收集上清, 离心后弃上清,用含60 ng/mL巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)的高糖DMEM(15%胎牛血清)重悬细胞,继续培养6~7 d。倒置显微镜下观察细胞的生长状态和形态特征,待细胞长到70%~80%饱和度时进入干预阶段。
1.3.2 裸鼹鼠骨髓来源巨噬细胞的分离培养 每只裸鼹鼠使用2 mL体积分数0.75%戊巴比妥钠腹腔注射过量麻醉处死,体积分数75%乙醇溶液浸泡2~3 min, 移入超净台,无菌条件下取其两后肢,剥离皮肤和肌肉,分离股骨和胫骨,去掉两端软骨组织;1 mL注射器轻轻插入骨髓腔,用完全培养基冲洗骨髓腔,制成单细胞悬液。离心后弃上清, 完全培养基重悬细胞,35℃,3%O2,5%CO2及 92%N2条件下培养8~12 h; 收集上清, 离心后弃上清,用含60 ng/mL M-CSF的低糖DMEM(15%胎牛血清)重悬细胞, 继续培养6~7 d。倒置显微镜下观察细胞的生长状态和形态特征。待细胞长到70%~80%饱和度时进入干预阶段。
1.4 Poly I:C 刺激对裸鼹鼠PKR及其信号通路的影响
1.4.1 骨髓来源巨噬细胞的Poly I:C刺激及PKR活性的抑制 分别将裸鼹鼠和小鼠的骨髓来源巨噬细胞分成对照组、Poly I:C给药组、Poly I:C+氨基嘌呤(2-AP)给药组、2-AP给药组。Poly I:C给药组加入终浓度10 μg/mL的Poly I:C;对照组加入同等体积的PBS溶液;Poly I:C+2-AP给药组加入终浓度为10 μg/mL的Poly I:C后培养箱继续培养12 h,加入终浓度5 mmol/L的2-AP;2-AP给药组加入终浓度5 mmol/L的2-AP,30 min后分别收集细胞蛋白,进行下一步的检测。
1.4.2 PKR活性抑制后PKR信号通路表达情况检测 分别提取裸鼹鼠和小鼠细胞的对照组、Poly I:C 给药组、Poly I:C+2-AP、2-AP 给药组总蛋白,加热变性后,聚丙烯酰胺凝胶电泳后转膜,脱脂奶粉封闭后一抗、二抗孵育,使用ECL化学发光试剂显色后,Kodak Gel Logic 4000 R成像系统曝光检测。分别检测Poly I:C给药及PKR活性抑制后,细胞的Caspase-8和PKR-eIF2α信号通路相关因子表达情况。
1.5 数据分析
使用2-ΔΔC方法对RT-PCR数据进行统计。数据用±s表示,使用SPSS22.0(SPSS Inc., IL,USA)通过One-way ANOVA进行统计,P<0.05为差异有统计学意义。
2 结果
2.1 Poly I:C给药、PKR活性抑制后巨噬细胞PKR的表达
Poly I:C给药后,小鼠巨噬细胞的PKR磷酸化水平显著降低(P<0.01,图1),而裸鼹鼠则显著升高(P<0.01,图2),表明Poly I:C能抑制小鼠的PKR活性,而裸鼹鼠则相反,其PKR活性被显著激活。
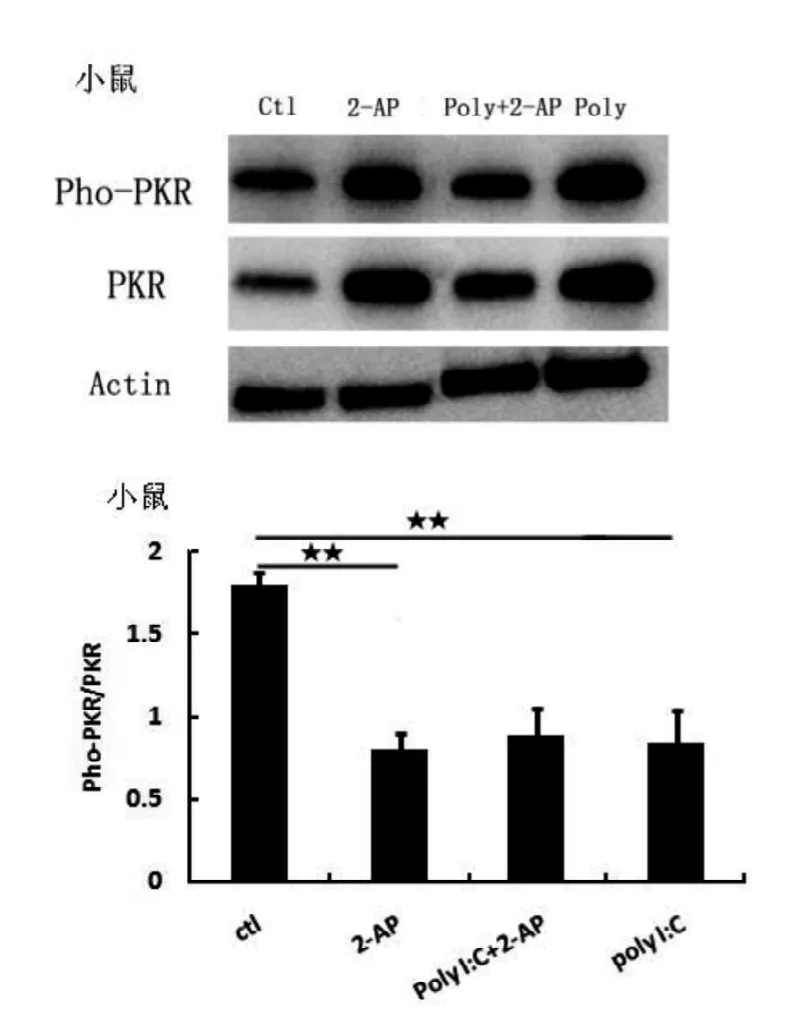
ctl: 对照组; 2-AP: 2-AP 给药组; poly+2-AP: poly I: C 和 2-AP 给药组; poly: poly I: C 给药组; ★ P<0.05, ★★ P<0.01; 下图同图1 小鼠巨噬细胞Pho-PKR蛋白表达水平
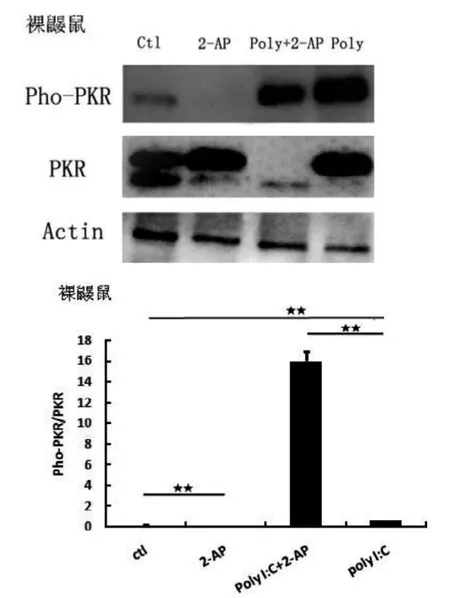
图2 裸鼹鼠巨噬细胞Pho-PKR蛋白表达水平
2.2 EIF2α的表达
单独使用2-AP抑制PKR活性后, 小鼠巨噬细胞的EIF2α磷酸化水平显著降低(P<0.01,图3),但裸鼹鼠巨噬细胞的EIF2α磷酸化水平则显著升高。同时 Poly I:C 给药后加入 2-AP, 与 Poly I:C单独给药组比较,裸鼹鼠细胞中,2-AP对EIF2α的抑制作用尤其显著,基本无蛋白表达(图4)。
2.3 Caspase-8的表达
Caspase-8蛋白表达结果如图5、图6, poly I:C给药后, 无论是小鼠还是裸鼹鼠巨噬细胞, Caspase-8蛋白表达都显著升高(P<0.01), 表明细胞的凋亡水平增强。通过2-AP抑制PKR活性后, 裸鼹鼠细胞的Caspase-8蛋白表达水平显著下降, 表明裸鼹鼠细胞中PKR活性对Caspase-8表达有促进作用。
3 讨论
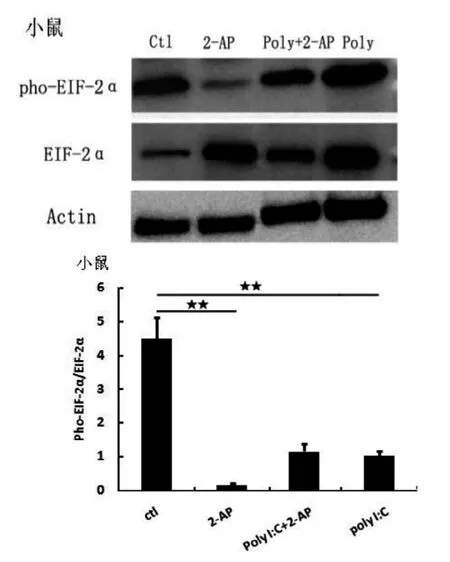
图3 小鼠巨噬细胞Pho-EIF2α蛋白表达水平
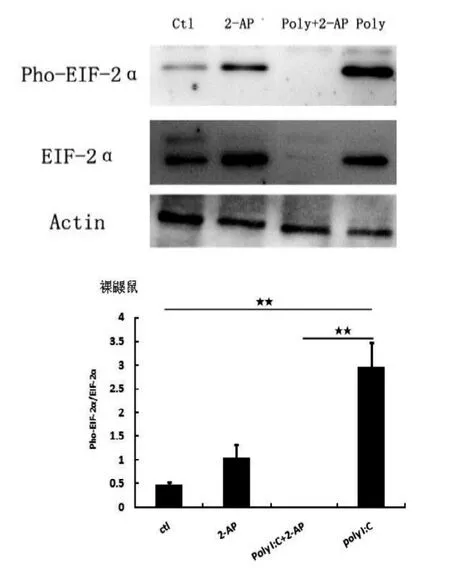
图4 裸鼹鼠巨噬细胞Pho-EIF2α蛋白表达水平
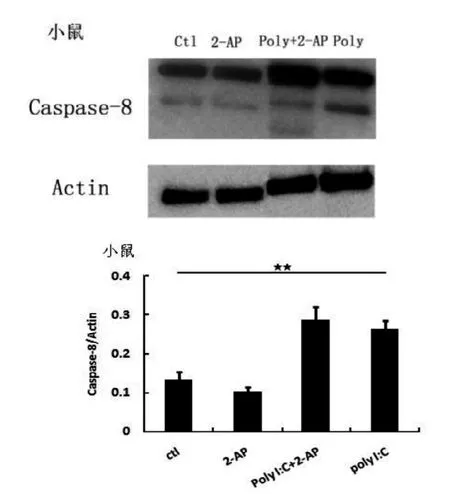
图5 小鼠巨噬细胞Caspase-8蛋白表达水平
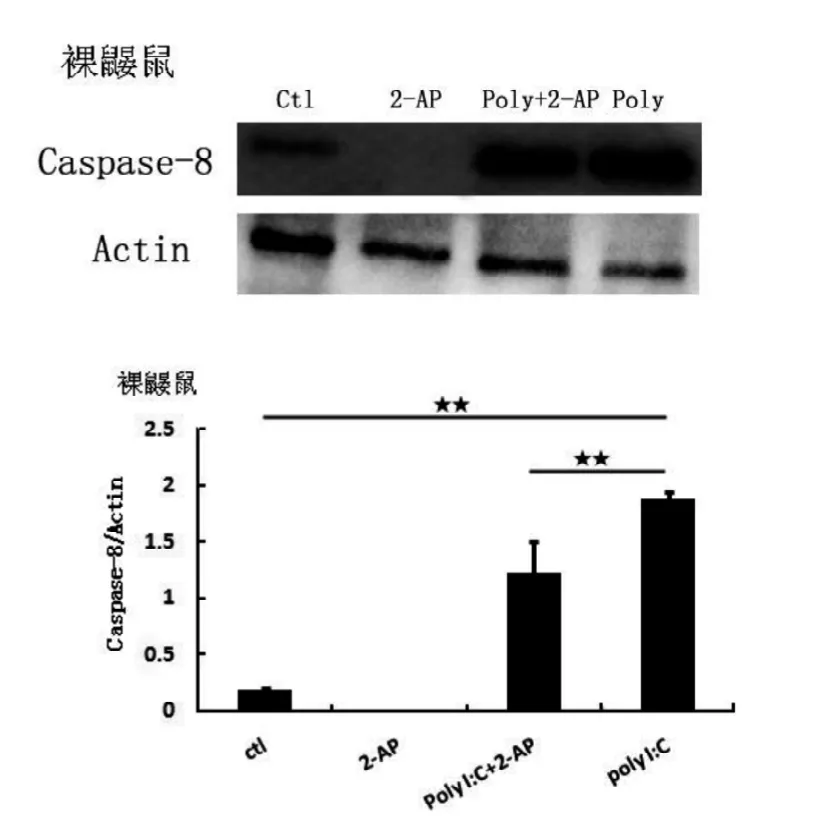
图6 裸鼹鼠巨噬细胞Caspase-8蛋白表达水平
Poly I:C能够诱导炎症反应,导致小鼠、大鼠血浆的白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平上升[11,12]; 诱导小鼠下丘脑的白细胞介素-1β(IL-1β) mRNA水平上升;可以通过多种途径诱导部分细胞的凋亡[11,12]。本课题组前期实验[5]结果表明,Poly I:C能够诱导小鼠产生显著的病理学改变,包括肠道组织腺体广泛性充血,肠组织细胞出现大量的空泡状线粒体,滑面内质网扩张等,而裸鼹鼠除了肠组织细胞中出现线粒体增多,变长,自噬体增多外,未表现出显著的病理学变化。由前期的实验结果表明,裸鼹鼠具有一定的抗Poly I:C刺激能力。而PKR是一种存在于哺乳动物细胞中的丝氨酸/苏氨酸蛋白激酶,能被双链RNA激活,激活后,进一步促使真核翻译启始因子EIF-2α磷酸化,抑制蛋白合成且同时促进多种凋亡相关细胞因子的表达,诱导细胞凋亡,在信号转导、凋亡、细胞生长分化中起着重要的作用。本实验结果显示Poly I:C给药后,小鼠巨噬细胞的PKR和EIF2α磷酸化水平显著降低, 而裸鼹鼠则显著升高, 表明Poly I:C能抑制小鼠的PKR活性,而裸鼹鼠的PKR活性被显著激活。目前的研究[13,14]报道显示,低浓度的双链RNA能活化PKR,而高浓度的双链RNA却抑制PKR的活化。因此,本实验结果显示,同一浓度的Poly I:C给药,对裸鼹鼠细胞是低浓度,而对小鼠细胞却是高浓度,该现象表明裸鼹鼠细胞对Poly I:C刺激具有较高的抗性。
PKR活化后能通过磷酸化EIF-2α抑制蛋白合成,从而促进细胞凋亡。本实验使用Poly I:C干预后通过2-AP抑制PKR活性,结果显示,2-AP给药后下调了小鼠和裸鼹鼠PKR和磷酸化PKR的表达,尤其是裸鼹鼠的PKR,2-AP给药后显著地抑制PKR的表达。单独2-AP给药后小鼠巨噬细胞的活性PKR和活性EIF2α比例显著下降,裸鼹鼠巨噬细胞的活性PKR比例也显著下降。可见,裸鼹鼠细胞的PKR对2-AP的敏感性更强。2-AP是一种强诱变碱基,可抑制PKR的磷酸化,从而阻断其下游效应分子的激活。
PKR引发的凋亡是通过与筋膜相关的死亡域蛋白 (Fas-associated death domain protein,FADD)/Caspase-8实现的。Caspase-8酶原复合物在死亡诱导信号复合物中通过自身切割而被激活,进而切割执行者Caspase-3酶原,产生有活性的Caspase-3,导致细胞凋亡[15]。本实验结果显示,poly I:C给药后,无论是小鼠还是裸鼹鼠巨噬细胞,裂变的Caspase-8蛋白表达都显著升高(P<0.01), 表明细胞的凋亡水平增强。通过2-AP抑制PKR活性后,裸鼹鼠细胞的Caspase-8蛋白表达水平显著下降,但小鼠细胞却无显著差异,该结果表明裸鼹鼠细胞中PKR活性对Caspase-8表达有促进作用。本实验结果显示,与小鼠比较,无论是Poly I:C还是2-AP的刺激,裸鼹鼠细胞的PKR/EIF2α和PKR/Caspase-8信号通路调节作用都比小鼠敏感,对外界的刺激具有较快的调节能力。
