裸鼹鼠海马神经元纯化模型建立及其低氧耐受特性机制的初步研究
2019-12-25杨文静李壘辰许月榕林丽芳崔淑芳
杨文静, 李 煜, 冯 延, 李壘辰, 许月榕, 刘 攀, 林丽芳, 孙 伟, 崔淑芳
(海军军医大学基础医学院实验动物学教研室, 上海 200433)
裸鼹鼠分布于非洲肯尼亚、埃塞俄比亚、索马里等地区,隶属于啮齿目。虽然早在19世纪中期,裸鼹鼠就被发现和命名,但其在生物医学方面研究的优越性引起科学家的关注是在1980年代之后。裸鼹鼠终生生活于黑暗的地下环境,这导致其视觉发生严重退化,以至于完全丧失,所以它是研究神经退行性病变的理想动物模型[1]。裸鼹鼠长期生活于氧含量极低、二氧化碳含量极高的环境,所以对低氧环境具有极强的耐受能力,是研究缺氧相关疾病的天然动物模型[2]。另外,裸鼹鼠的寿命可以长达30年以上,是同体型啮齿类动物10倍左右,所以其可以作为研究抵御慢性衰老症和衰老性病理变化的天然理想动物模型[3]。同时,在裸鼹鼠整个生命过程中均未发生肿瘤,其对癌症具有超强的免疫力,其可能为人类攻克癌症这一医学难题提供一些重要的线索[4,5]。所以,裸鼹鼠作为一种具备诸多优势生物学特性的新型模式动物资源,正逐渐成为医学研究的热点。在裸鼹鼠越来越多地应用于生物医学领域的同时,其具备的诸多优势生理学特征急需进一步阐明。
急性分离的裸鼹鼠海马切片在低氧或者遭受营养剥夺时, 却存在一些独特的神经保护机制[6,7],一个主要的特点就是裸鼹鼠海马在低氧情况下Ca2+波动幅度显著降低,这就极大降低了恢复常氧浓度时因钙超载带来的细胞凋亡风险[4]。由此可见,对于裸鼹鼠这些特殊生理学特性的神经生物学机制研究尚处于起步阶段, 具体的组织、细胞及分子学机制亟待进一步深入揭示。以裸鼹鼠低氧耐受的生物学机制为例, 目前虽有国外学者[4]发现离体培养的海马脑片经历低氧时没有出现显著的Ca2+超载现象,但是离体培养的脑片包含的细胞成分较为复杂,低氧刺激的情况下无法排除其他类型的神经细胞如胶质细胞等是否也发挥了一定的作用。所以,为了进一步证实,我们必须利用纯化培养的裸鼹鼠神经细胞进一步观察和研究,而目前我们尚未发现国内外学者成功建立出裸鼹鼠神经细胞体外纯化培养的细胞模型。因此,本研究期望建立裸鼹鼠海马神经元的体外纯化培养方法,并初步探讨其耐低氧特性。
1 材料与方法
1.1 实验动物
妊娠60~65 d的清洁级封闭群裸鼹鼠由海军军军医大学基础医学院实验动物学教研室提供。
1.2 主要试剂与仪器
1.2.1 主要仪器 超净工作台(苏州金燕净化设备厂)、三气培养箱(德国Memmert公司)、倒置荧光显微镜(德国Leica公司)。
1.2.2 主要试剂 DNA酶购自中国Solarbio生物科技有限公司;神经生长因子(NGF)、5-氟尿嘧啶(5-Fu)、胰蛋白酶、左旋多聚赖氨酸、青链霉素混合液、磷酸盐缓冲液(PBS)等均购自美国Sigma公司;DMEM、低糖DMEM、澳洲来源胎牛血清、Neurobasal培养基、B27无血清添加因子等均购自美国Thermo Fisher Scientific公司;培养皿、培养板和培养瓶购自美国Corning公司、CCK8检测试剂盒均购自中国碧云天公司。一抗:神经元特异核蛋白(NeuN)抗体购自中国Proteintech 公司。二抗: 绿色荧光抗体购自美国Jackson公司。Trizol试剂和SYBGreenI购自美国TaKaRa公司。
混合神经细胞培养基成分为低糖DMEM培养基含有体积分数为10%的胎牛血清,海马神经元纯化培养基为Neurobasal+2%B27+10 μmol/L 5-Fu。海马神经元维持培养基为含有体积分数为2% B27的Neurobasal培养基, 同时添加100 ng/ml NGF,Trizol购自美国TaKaRa公司,RNA反转录试剂盒购自美国Thermo公司,2×SYBR Green I购自美国TaKaRa公司。
1.3 实验方法
1.3.1 裸鼹鼠海马神经元纯化模型建立 裸鼹鼠海马混合神经细胞的收集:将裸鼹鼠在CO2中作窒息处理后立即浸泡于体积分数75%乙醇溶液中进行消毒,然后将其置于无菌玻璃平皿中,并用含青链霉素混合液擦拭裸鼹鼠腹部皮肤,小心剖腹并将其含有胎鼠的子宫完整取出,剪开子宫膜并小心取出胎鼠。将胎鼠颅骨剪开,于体式显微镜下将左右大脑从正中线分成两半,然后小心剥离海马,并剥除海马表面的脑膜结构。用显微剪将海马组织剪碎至1 mm3,加入组织消化液混匀之后,于37 ℃消化15 min。然后用混合神经细胞培养基终止消化,离心去除上清之后,在神经细胞混合培养基中将沉淀重悬并吹打成单细胞悬液。随后将单细胞悬液种于无菌的且预先包被有基质层的24孔板中。
裸鼹鼠大脑海马混合神经细胞的培养:将上述得到的细胞,用神经细胞混合培养基中培养于三气培养箱(5%CO2、10%O2、96%饱和湿度、35 ℃)中培养12 h,待其完全贴壁之后,换为神经元纯化培养基继续培养2 d,然后将培养基更换为神经元维持培养基2 d,如此为一个周期,培养一周。
1.3.2 细胞鉴定 培养在8室细胞培养皿中的裸鼹鼠神经元细胞,吸出培养液,PBS洗一次,质量分数4%多聚甲醛溶液于室温(25 ℃左右)条件下固定15 min, PBS洗涤3次后用10%羊血清于室温封闭1h, 加入抗NeuN抗体(与PBS按1∶100的比例稀释)于4 ℃孵育过夜(12 h以上)。次日,PBS润洗3次后加入荧光二抗(与PBS按1∶100的比例稀释)室温孵育2 h(避光),PBS润洗3次后加入Hoechst33342(与PBS按1∶1 000的比例稀释)室温孵育5 min(避光),PBS润洗3次,利用Leica荧光显微镜进行观察和拍摄(避光)。
1.3.3 海马神经元的低氧耐受能力检测 海马神经元按104/mL按每孔100 μL的体积种于96孔板中, 于5%CO2、8%O2、96%饱和湿度、35℃三气培养箱中脉冲培养并观察8~9 d,常氧组氧浓度为21%,低氧组氧浓度为8%(下同); 检测前小心吸出培养基,PBS润洗3次后, 每孔加入10 μL CCK-8溶液和100 μL培养基,培养箱中继续孵育30 min。每次平行设置3个复孔,同时用加了相应量细胞培养液和CCK-8溶液但没有加入细胞的孔作为空白对照。然后利用分光光度计在450 nm处测定吸光度(A)值。
1.3.4 低氧环境下海马神经元轴突生长情况分析海马神经元按104/mL按每孔100 μL的体积种于8室培养皿中,于5%CO2、8%O2、96%饱和湿度、35 ℃三气培养箱中脉冲培养并观察8~9 d。进行终止培养前4 d将细胞分别于常氧和低氧环境下培养,然后利用质量分数4%多聚甲醛溶液固定细胞后,于光学显微镜下观察轴突生长情况,利用Image-Pro Plus 6.0进行长度分析。
1.3.5 QPCR检测海马神经元中缺氧诱导因子-1α(HIF-1α)水平 培养于常氧和低氧条件下的海马神经元(同上),Trizol法于无RNA酶条件下提取RNA,SYBGreenI进行检测。热循环条件: 95℃3 min,94 ℃ 15 s,60 ℃ 60 s,40 个循环。PCR 扩增反应体积 10 μL: NRase Free dH2O 3 μL,SYBGreenI 5 μL,DNA 模板 1 μL,每个样品3个复孔。采用比较Ct值(2-△△Ct)相对定量,改变的倍数(fold change)=2-△△Ct:△Ct=Ct靶基因-Ct内参,△△Ct=△Ct处理组-△Ct未处理组。以actin为对照。以2-△△Ct表示实验组目的基因的表达相对于对照组的变化倍数。HIF1α引物:HIF-1α正向 5'-GAGGTGGATATGTCTGGGTTG -3',反向 5'- AGGGAGAAAATCAAGTCGTGC -3',actin引物正向5'-TGGAGAAAGCGGCCAAATAC-3',反向 5'-AAAGGTGGAAGAGTGGGTG-3'。
1.4 统计学方法
2 结果
2.1 裸鼹鼠海马神经元的形态特征
光学显微镜下,裸鼹鼠皮层神经元胞体较大,具有1个或数个较短的树突,另一端具有一个细长的轴突(图1)。

图1 光学显微镜下的裸鼹鼠海马神经元
2.2 裸鼹鼠海马神经元鉴定
免疫细胞化学鉴定结果如图2所示,在无血清培养基中,细胞能够保持NeuN阳性(绿色荧光)。裸鼹鼠神经元具备典型的皮层神经元形态,胞体较大,具有1个或数个较短的树突,另一端具有一个细长的轴突,免疫细胞化学染色显示其呈NeuN阳性。所培养裸鼹鼠海马神经元(307.67/310)纯度达99%。
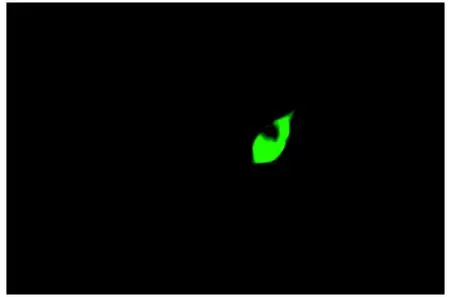
图2 裸鼹鼠海马神经元免疫荧光染色
2.3 裸鼹鼠海马神经元低氧耐受特性
低氧处理4~48 h,裸鼹鼠海马神经与的存活率均高于常氧对照组(P<0.05)(图3)。
低氧处理后海马神经元轴突长度[(56±9) μm]是常氧环境下[(33±6) μm]的2倍左右(P<0.05)(图 4)。
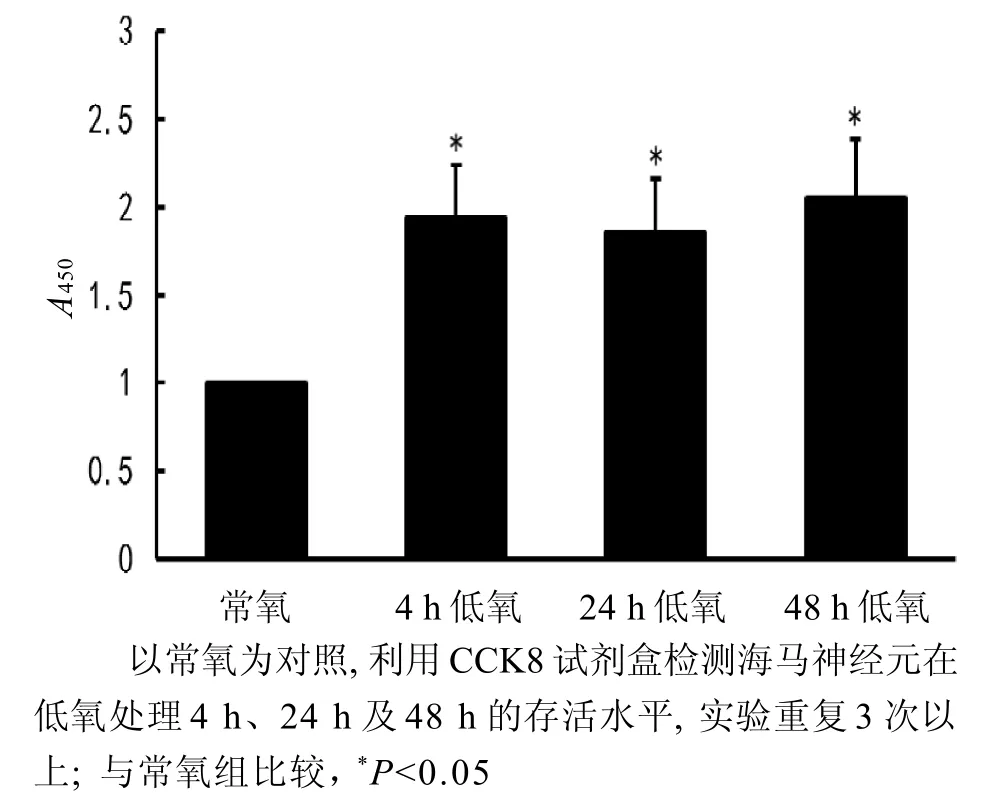
图3 CCK8检测裸鼹鼠海马神经元在低氧环境中存活情况
低氧情况下裸鼹鼠海马神经元中HIF1α的表达水平(相对数值1.0)是常氧时(相对数值3.2±0.5)的3 倍以上(P<0.05)。
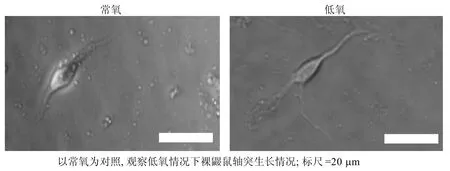
图4 低氧及常氧时裸鼹鼠神经元轴突生长情况示意图
3 讨论
海马在机体多种功能中发挥着举足轻重的作用,特别是记忆的采集与整合、学习能力的获得以及空间导航等过程中[9,10]。多种神经退行性疾病和神经系统发育过程中出现的疾病都在一定程度上与海马的结构及功能异常有这一定程度的联系,并且海马结构和功能的异常可能最终会加剧神经系统疾病的发生发展。以中风为例,据世界卫生组织最新统计,每年中风可导致670 万人死亡,已经跃居世界范围内致残及致死性疾病的首位,而缺血性中风位居第二[11]。目前,中枢神经系统低氧耐受机制尚未被彻底阐明,旨在疏通脑血管的溶栓疗法及外科手术治疗等常规疗法只能在血液供应上进行改善,但是无法从源头上遏制神经元的死亡[11],并且容易带来其他潜在的风险。裸鼹鼠特殊的低氧耐受能力恰可作为天然的动物模型[7,8],对于人类相应的疾病机制以及治疗策略的研究意义重大。挖掘裸鼹鼠海马神经元抗缺血缺氧损伤的特性及机制用于治疗靶标的筛选,对于中枢神经系统缺血缺氧性损伤疾病的攻克有着至关重要的意义。
本研究综合使用多种培养基从裸鼹鼠胎鼠海马分离并纯化培养海马神经元,摸索出了适于变温的啮齿类哺乳动物裸鼹鼠海马神经元的合理培养方法,海马神经元的纯度能够达到98%以上,为深入揭示海马神经元在神经系统疾病发生发展中的作用奠定了基础。
2011年,中国华大基因联合韩国梨花女子大学对1只经历7 d低氧处理的雄性裸鼹鼠脑,肝,肾脏基因进行了差异表达测序、并利用生物信息学软件对低氧条件下表达显著上调或者下调的基因进行了系统的生物功能分类,鉴定出一批可能与低氧适应有关的基因[1],这也成为我们深入研究裸鼹鼠神经系统特殊结构和功能并在细胞水平阐明其分子机制的一个重要桥梁。作为一种与人类基因有着93%相似度的哺乳动物[1],裸鼹鼠这些特殊生理功能的发现以及机制探索将为其在生物医学领域的应用奠定扎实的理论基础[11-15]。裸鼹鼠天然耐低氧的海马神经元模型的建立,可作为生物医学领域的便捷研究工具。
本研究通过分析对低氧及常氧情况下裸鼹鼠海马神经元轴突生长情况及HIF1α的表达水平分别从功能及基因水平阐述裸鼹鼠海马神经元的低氧耐受特性。在给予低氧刺激时, 裸鼹鼠海马神经元轴突长度显著长于常氧情况。这与常氧生存的实验动物存在显著的不同。为了更好地进行解释, 本研究进一步对裸鼹鼠海马神经元在低氧时的基因表达情况进行了分析。我们比对了很多基因(未全部展示),发现HIF1α在接受低氧刺激时,表达水平显著上调。初步证实裸鼹鼠海马神经元HIF1α在低氧情况下高表达,可能与其低氧耐受特性有直接的关系。HIF1α是低氧调控的关键因子, 其表达水平上调会引起细胞产生一系列低氧耐受的瀑布效应[16], 不仅能够促进海马神经元的存活能力,而且表现在形态学上,就是本研究发现的裸鼹鼠海马神经元轴突长度的显著增长。神经元轴突的长度对于神经元之间建立突触联系,完成神经元之间的信号传递有着至关重要的作用。并且更为重要的是,树突棘的生长也会同时增强,帮助机体在必要时随时建立新的突触联系[16]。
综上所述,本研究建立了裸鼹鼠体外海马神经元的培养方法,并且通过对裸鼹鼠海马神经元低氧适应机制的初步研究,将为中枢神经系统缺血缺氧性疾病的预防和治疗提供依据,同时也将为人类适应低氧作业条件及缺血缺氧性疾病的防治提供借鉴。
