瑞舒伐他汀对局灶性脑缺血再灌注大鼠Bax Bcl-2和脑含水量的影响
2019-12-25杨霄鹏
周 宾 冯 涛 贺 生 杨霄鹏
1)南阳医学高等专科学校第一附属医院神经内科,河南 南阳 473058 2)郑州大学第二附属医院神经内科,河南 郑州 450003
急性脑梗死是临床上最常见的脑血管疾病之一,对于超早期急性脑梗死患者,及时给予血管再通,恢复有效的脑缺血区血液供应,对恢复缺血半暗带区(Ischemic Penumbra,IP)神经细胞功能意义重大。但在脑组织恢复血流再灌注中,高灌注可以导致神经元内钙离子超载,大量兴奋性氨基酸(EAA)生成造成的毒性,小胶质细胞大量激活介导过度免疫炎症反应以及血脑屏障的破坏等一系列反应,引起脑细胞发生毒性水肿、功能丧失,神经元变性、凋亡。神经元凋亡是受许多凋亡基因和抗凋亡基因控制,主要是Bcl-2基因家族中Bax促凋亡基因和Bcl-2抑制凋亡基因[1]。他汀类药物具有强化降脂、稳定斑块,抗血管内膜炎等作用,常用于心脑血管疾病。近年来很多研究表明,他汀类药物在影响血脂之外,具有抑制小胶质细胞过度激活,降低免疫炎症反应的多效性作用。目前有关他汀类药物对缺血性卒中颈动脉斑块内血管新生及对缺血性卒中预防[2-4]方面研究较多。对急性脑缺血再灌注的脑保护作用研究较少,机制不完全清楚。本研究通过观察瑞舒伐他汀对急性脑缺血再灌注损伤大鼠Bax、Bcl-2、脑含水量的影响,探讨他汀类药物脑保护作用机制。
1 材料与方法
1.1动物及分组动物管理符合实验动物伦理学基本要求,本研究报请医院动物伦理委员会批准。雄性健康SD大鼠72只,月龄2~3个月,体质量(280±20)g,清洁级,由郑州大学医学院实验动物中心供,合格证号为SCXK(豫):2011-0005。实验SD大鼠在造MCAO模型前3d带回实验室。避免刺激,实验室温度保持21~26℃,湿度50%~60%,提供昼夜光变规律。自由进食水。发现不符合实验要求大鼠去除不用,重新补齐。随机将72只SD大鼠平均分假模型组为A组,模型组为B组,干预组为C组,每组分为24 h、72 h、7 d时间点,各时间点8只SD大鼠分别进行神经功能评分、脑梗死容积百分比、Bax、Bcl-2及脑含水量测定。
1.2药物与试剂大鼠MCAO栓线购于北京沙东生物技术有限公司,线栓头球直径(0.32±0.02)mm。氯醛、2,3,5苯四氮唑(tetrazolium1 chloride,TTC) 由北京化学试剂公司生产。多聚甲醛(Cat#KGT558)、磷酸盐缓冲液(phosphate buffered saline,PBS,Cat#EGT549)、柠檬酸钠(Cat#KGT553)由南京凯基生物科技发展有限公司出品。Bax、Bcl-2抗体、SP9001试剂盒、DAB试剂盒购于北京中杉生物工程公司。磷酸二氢钠由汕头市光华化学厂提供。采用德国Lecia显微照像系统采集图像,应用日本奥林巴斯光学显微镜。瑞舒伐他汀钙(瑞旨,鲁南贝特制药有限公司),规格:5 mg/片,生产批号:H20080240。
1.3制备大鼠MCAO模型采用改良Zea Longa[5-6]线栓法制备SD大鼠大脑中动脉缺血再灌注(MCAO)模型。大鼠在实验前禁水4 h、禁食12 h。利用白炙灯直接照射能使大鼠肛温保持在 37 ℃左右,采用10%水合氯醛(350 mg/kg)进行腹腔注射麻醉,选择左颈正中旁切口,切开皮肤、皮下,分离迷走神经。分别游离出左颈外动脉(ECA),左颈总动脉(CCA),左颈内动脉(ICA),近心端动脉夹依次夹闭CCA和ECA,再远心端线扎ECA,提起ECA将线栓[线栓头直径(0.32±0.02)mm]缓慢向ICA插入颅内方向约18~20 mm,有轻微阻力即达左侧大脑中动脉分叉处,去除动脉夹,栓线末端外露皮肤外,局部皮肤缝合。2 h后轻轻外拔线栓4 mm行大脑中动脉的缺血再灌注,3 h后采取姿势反射实验对MCAO模型大鼠行行为学评分(3分制)[7],造模成功大鼠为评分大于1分。
1.4实验方法A组大鼠仅麻醉后切开皮肤,分离迷走神经后缝合皮肤。B组即行MCAO大鼠,模型成功后每日一次生理盐水2 mL灌胃。C组是在模型成功后行舒伐他汀钙2 mg·kg-1(2 mL溶液)灌胃。3组大鼠到各时间点后腹腔注射水合氯醛深度麻醉,生理盐水从左心室加压灌后用4%多聚甲醛溶液固定,留取脑组织标本,在4%多聚甲醛液内固定24 h后脱水,浸蜡,包埋石蜡,制作厚度4 μm的冠状切片。
1.5观察指标
1.5.1 脑含水量测定:应用干湿质量方法对大鼠脑含水量进行测定,各个时间点大鼠处死后放置有定性滤纸的培养皿中。去软脑膜、脑干、小脑,分离梗死侧大脑半球称取湿质量后放置100 ℃电热恒温箱中烘干24~48 h,记录干质量,脑含水量(%)=(脑湿质量-脑干质量) /脑湿质量×100%。
1.5.2 神经功能评分:采用Zea Longa 5分制标准[8]对3组各个时间点大鼠进行评分,无神经功能缺损为0分;右前肢不能伸展呈屈曲状为1分;行走时才右侧肢体不能自主活动并伴有画圈步态为2分;行走时右侧肢体完全瘫痪向左侧倾斜为3分;无活动并意识不清为4分。1~3分大鼠为造模成功入选实验,0、4分大鼠等量补齐,重新造模评分。
1.5.3 免疫组织化学染色(SP法)步骤:SP检测试剂盒由北京诺博莱德科技有限公司提供,货号SP-9001。石蜡冠状切片应用二甲苯行2次脱蜡,后进行2次酒精脱蜡,每次各3~5 min。在高温的柠檬酸修复液中进行修复,冷却,常温下持续。孵育在3% H2O2去离子水中,滴加山羊血清封闭液,封闭采用内源性生物素。Bax、Bcl-2抗体稀释100倍,分别滴加,温控4 ℃一夜。常温下复温、冲洗、滴二抗液、冲洗、滴辣根酶液、孵育、冲洗后加上DAB显色剂、复染、冲洗、脱色,梯度酒精脱水(浓度由低到高)、封片。在高倍镜(400×)观察大鼠海马区,呈棕黄色染色改变即为阳性细胞,阳性区平均积分光密度值在计算机图像采集后进行分析。
1.5.4 脑梗死容积百分比:各组各个时间点取2只大鼠10%水合氯醛腹腔麻醉,断头取脑,全脑在冰冻状态下行冠状厚度为2 mm切片,共5片,快速置于2% TTC溶液(由北京化学试剂公司生产,产品编号:SIGMA-T8877)中,37 ℃避光温孵30 min后用ImageJ软件对大鼠半球面积及脑梗死面积行定量测定。经TTC染色正常脑组织染成紫红或粉红色,梗死区域染成白色。
1.5.5 HE染色:切片置烤箱内脱蜡、复水、分化、返蓝、复染、染色、二级透明、脱水、封片,鼠海马区神经元采用高倍显微镜(400×)进行观测。
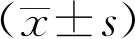
2 结果
2.1各组大鼠神经功能评分比较A组大鼠神经功能评分为0分,无神经缺损症状。MCAO后24 h时B、C组大鼠神经功能评分无明显差异(P>0.05)。在72 h、7 d时B、C 2组大鼠神经功能评分有显著性差异(P<0.05)。C组大鼠神经功能评分明显低于B组,表明瑞舒伐他汀可明显降低大鼠脑缺血再灌注后神经功能缺损症状。见表1。
2.2大鼠脑含水量改变结果A组大鼠各个时间点脑含水量无明显改变(P>0.05),MCAO后24 h时B、C组大鼠脑含水量开始升高,72 h明显增加,7 d达到高峰,与A组比较有显著性差异(P<0.05)。MCAO后24 h、72 h时C组大鼠脑含水量与B组比较下降不明显(P>0.05),7 d时C组大鼠脑含水量与B组比较脑含水量明显降低(P<0.05)。见表2。
2.3各组大鼠海马区Bax、Bcl-2的激活比较各时间点A组大鼠Bax、Bcl-2均可见激活的阳性细胞。MCAO后24 h时B、C组大鼠Bax激活阳性细胞增多,Bcl-2激活阳性细胞下降,72 h时改变明显,7 d时达到高峰,与A组比较有显著性差异(P<0.05)。与B组相比,C组7 d时Bcl-2激活阳性细胞明显增多,Bax激活阳性细胞明显减少,有显著性差异(P<0.05)。见表3。
2.4大鼠脑梗死容积及海马区神经元HE染色目测到大鼠脑梗死灶主要位于大脑中动脉支配血供的皮质、皮质下白质及基底神经节区。A组大鼠无明显梗死灶。MCAO后24 h、72 h、7 d时B组脑梗死容积百分比分别为(15±5.3)%、(27±6.7)%、(29±4.9)%,C组脑梗死容积百分比分别为(12±7.1)%、(14±5.7)%、(12±6.1)% 。MCAO后24 h B组脑梗死容积百分比与C组相比无明显差异(P>0.05),72 h、7 d时B组大鼠脑梗死容积百分比较24 h时增大(P=0.02),C组脑梗死容积比较B组减少,差异有统计学意义(P<0.05)。见图1A~C。
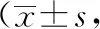
表1 各组大鼠神经功能评分比较分)
注:与B组相比,1)P>0.05,与B组相比,2)P<0.05
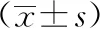
表2 各组大鼠脑含水量比较
注:与B组相比,1)P>0.05;与B组相比,2)P<0.05
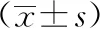
表3 各组大鼠7 d时Bax、Bcl-2阳性细胞比较
注:与B组相比,1)P<0.05
镜下观察3组大鼠7 d时海马区神经元改变,A组大鼠神经细胞整齐排列,细胞膜、细胞核完整无损伤,胞浆正常。无细胞变性、空泡现象。B、C组大鼠神经细胞数明显减少,细胞膜结构破坏,细胞形态破坏紊乱,细胞浆浑浊变质,细胞核裂解浓缩,神经细胞出现空泡,大量变性坏死。C组与B组相比,神经细胞数增多多,细胞膜及细胞核空泡及变性损伤程度明显减轻。见图1D~F。
3 讨论
由于脑的解剖及生理特点决定其对缺血、缺氧耐受性较差敏感。在脑梗死早期脑缺血半暗带(ischemic penumbra,IP)区神经元功能具有可逆性,因此早起进行颅内缺血再灌注对恢复IP区神经元功能具有重要意义[9-11]。但脑缺血再灌注损伤也是临床研究的重点。缺血再灌注损伤病理生理基础为炎症反应、兴奋性氨基酸(EAA)毒性、氧自由基大量产生、血脑屏障破坏、钙超载、小胶质细胞大量激活、脑水肿、细胞抗凋亡基因及凋亡基因的失衡等。急性脑梗死后的缺血再灌注损伤主要有梗死中心区域神经元坏死及IP区的神经元凋亡。近年来研究较多的调控凋亡基因主要是Bcl-2家族,包括Bax,Bcl-2,Bcl-X,Bag-l,Bak等[12]。其中Bcl-2为凋亡抑制基因,Bax为促凋亡基因,两者比例决定神经元损伤后是凋亡还是存活,是调控细胞生长再生的重要基因[13]。
急性脑缺血及缺血再灌注均可引起不同程度脑水肿,影响颅内代谢及颅内环境的平衡,严重时导致颅内压升高、脑移位及脑疝,甚至死亡。有研究显示抗氧自由基剂和他汀类药物可以通过下调p38丝裂原活化蛋白激酶及水通道蛋白4表达减轻局灶性脑缺血再灌注小鼠脑水肿和脑损伤[14],积极防治脑水肿也是治疗急性脑缺血再灌注损伤的重要方法之一。急性脑梗塞病人,脑细胞水肿在脑缺血缺氧后30分即产生,24小时达高峰。目前药物如脱水剂、激素、白蛋白等治疗是防治脑水肿的主要措施,均有明显的毒副作用,探讨他汀类药物对脑水肿的影响可以保护神经元,降低脑缺血再灌注损伤程度,成为临床上治疗缺血性脑血管病新的治疗方法。
他汀类药物除了其降脂作用外,还有减轻免疫炎症反应,减少血管内皮素(ET)分泌,抑制血管紧张素Ⅱ受体,抑制金属基质蛋白酶活性,并具有抑制血小板活化等多效性作用。他汀类药物的多效性是其抑制胆固醇生物合成通路中间产物异戊二烯类的合成,提高一氧化氮合酶(eNOS)浓度,抑制C反应蛋白浓度,降低核转录因子kB表达[15-16]。抑制P-selectin、细胞粘附分子-1(VCAM-1)、E-selectin等表达,抑制基质金属蛋白酶(MMP-2、9)等核心炎症反应通路抑制血管内膜炎,稳定动脉粥样硬化斑块[17-18],是他汀类药物治疗心脑血管疾病基础。
本实验显示MCAO后24 h大鼠脑含水量开始升高,Bax激活阳性细胞增多,Bcl-2激活阳性细胞下降,脑梗死容积百分比也逐渐增高,7 d达到高峰。通过瑞舒伐他汀对MCAO进行干预后72 h、7 d时大鼠神经功能评分明显高于模型组,7 d时大鼠脑含水量明显低于模型组,凋亡抑制基因Bcl-2明显高于模型组,促凋亡基因BaxB明显低于模型组,脑梗死容积百分比也明显低于模型组。对大鼠海马区神经元HE染色也表明瑞舒伐他汀干预后神经元损伤明显减轻,凋亡细胞及空泡明显减轻,残存神经元数目明显增多。充分表明瑞舒伐他汀能通过影响抑制脑水肿、调控凋亡基因等保护神经元,减轻神经功能缺损症状,具有脑保护作用。本研究还存在着样本量少,对动脉模型观察时间短,可能不能完全反映急性脑缺血再灌注过程中各项指标的演变过程,海马区比较弥散,故取材定位缺血区与实际缺血可能有差距等不足之处,再下一步的研究中克服不足。
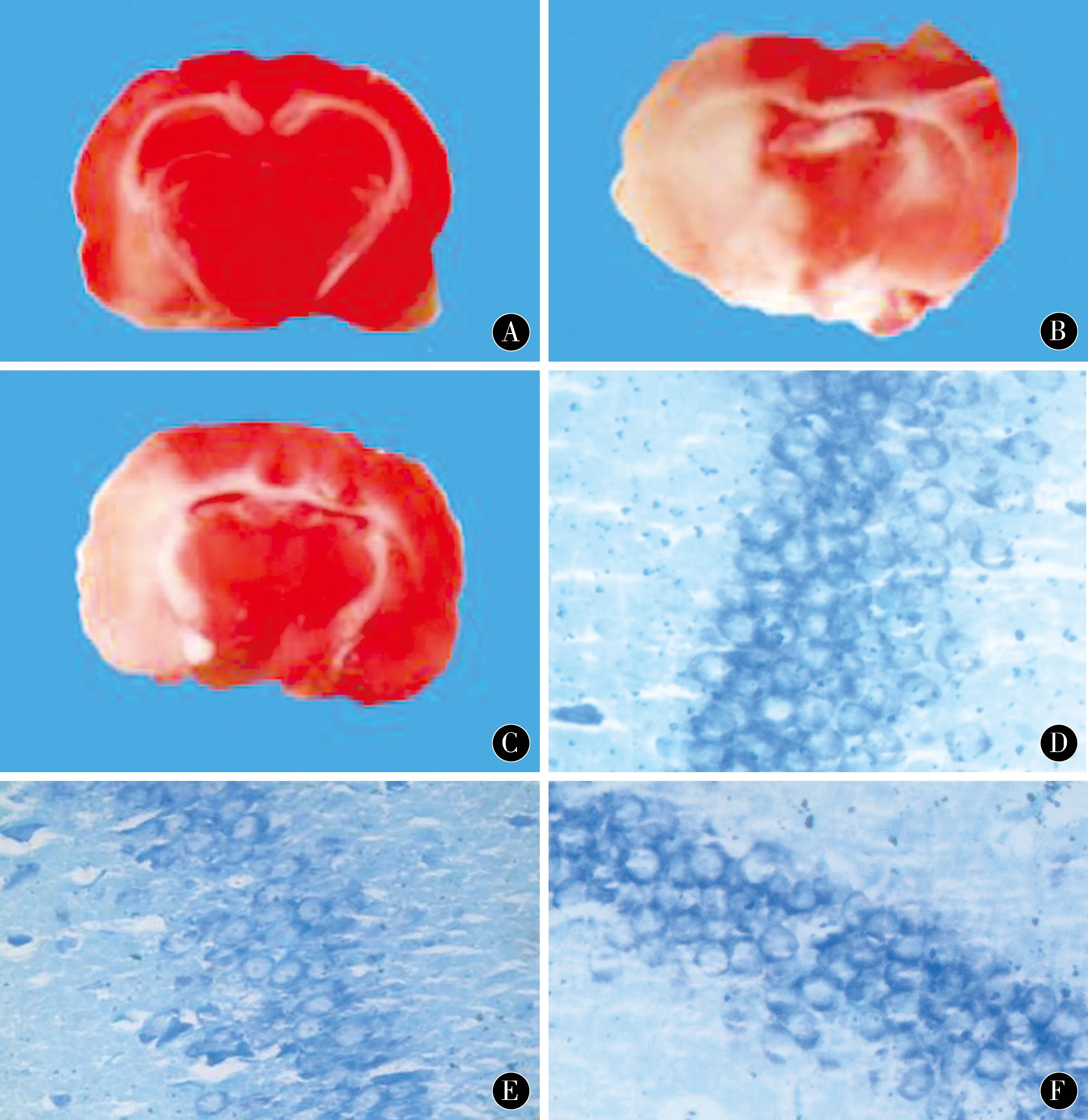
图1 A:A组7 d时TTC染色;B:B组7 d时TTC染色;C:C组7 d时TTC染色;D:A组7 d时海马区神经元HE染色(×400);E:B组7 d时海马区神经元HE染色(×400);F:C组7 d时海马区神经元HE染色(×400)Figure 1 A:TTC staining at 7d in group A.B:TTC staining at 7-day in group B.C:TTC stainingat 7-day in group C.D:HE staining of hippocampus neurons in group A at 7-day (×400).E:HE staining of hippocampus neurons in group B at 7-day (×400).F:HE staining of hippocampus neurons in group C at 7-day (×400)
