安罗替尼一线治疗晚期非小细胞肺癌的临床疗效观察
2019-12-20高亭何小鹏李敏王鹏军
高亭 何小鹏 李敏 王鹏军
肺癌是目前恶性肿瘤中发病率最高的肿瘤之一,其中非小细胞肺癌(NSCLC)占80%~85%[1-2]。近年来,对驱动基因人表皮生长因子受体(EGFR)、ALK、ROS-1阳性的患者应用一、二线靶向药物进行治疗,可使其生存明显获益[3]。但是,对于驱动基因阴性和使用一、二线靶向药物治疗后出现耐药的患者,目前仍无有效的治疗方案。安罗替尼是一种口服多靶点的酪氨酸激酶受体抑制剂[4]。前期研究结果显示,安罗替尼通过选择性地抑制血管内皮细胞生长因子受体(VEGFR)2、VEGFR3、成纤维细胞生长因子受体(FGFR)1、FGFR2、FGFR3、FGFR4、血小板衍生生长因子受体(PDGFR)α、PDGFRβ来抑制肿瘤细胞的增殖,并诱导肿瘤细胞的凋亡[5]。临床实验表明,安罗替尼可以延长NSCLC患者无进展生存期(PFS)和总生存期(OS)[6]。但安罗替尼作为一线药物治疗晚期NSCLC临床疗效如何,目前鲜有报道。本研究应用盐酸安罗替尼胶囊一线治疗晚期NSCLC患者,并与同期化疗治疗晚期NSCLC患者的疗效进行比较,以评估安罗替尼治疗效果及安全性,现将结果报道如下。
1 对象和方法
1.1 对象 选取2018年6月至2019年4月本院呼吸内科及肿瘤科收治且全身评估诊断为晚期NSCLC的43例患者为研究对象。其中男32例,女12例;年龄38~73(54±11)岁。根据患者病情及家属治疗意愿,遵循自愿原则选择治疗方案,其中安罗替尼一线治疗21例,全身化疗22例。安罗替尼组男13例,女8例;年龄48~73(51±6)岁;ⅢB期2例,ⅢC期6例,ⅣA期4例,ⅣB期9例;肺鳞癌 12例,肺腺癌 9例;随访时间5~10(5.2±1.1)个月。全身化疗组男15例,女7例;年龄43~74(48±8)岁;ⅢB期4例,ⅢC期8例,ⅣA期3例,ⅣB期7例;肺鳞癌 14例,肺腺癌 8例;随访时间3~10(4.8±1.3)个月。两组患者性别、年龄、肿瘤分期、肿瘤类型、随访时间比较,差异均无统计学意义(均P>0.05)。本研究经咸阳市中心医院伦理委员会审批通过,患者及其家属知情同意。
1.2 入组标准 在患者病情分别符合安罗替尼组、全身化疗入组条件的前提下,充分遵循患者及家属的治疗意愿进行分组。安罗替尼入组条件:(1)基因靶向检测提示驱动基因阴性;(2)病理学检查诊断为晚期NSCLC且有可测量病灶;(3)体力状况美国东部肿瘤协作组(ECOG)评分 0~1 分;(4)预计生存期>3 个月;(5)既往未用过盐酸安罗替尼胶囊。排除小细胞肺癌患者(包括小细胞肺癌与NSCLC混合的肺癌),存在咯血(>50ml/d)或中央型、有空洞的肺鳞癌患者,有深静脉血栓或肺栓塞,有精神疾病或无法停用精神类药品,最近4周参与过其他抗肿瘤临床药物试验的患者。全身化疗入组条件:(1)确诊为晚期NSCLC,多学科会诊评估无手术机会;(2)基因靶向检测提示驱动基因阴性;(3)体力状况ECOG评分0~1分;(4)预计生存期>6个月。排除心肺功能较差而不能耐受全身化疗的患者。
1.3 治疗方法
1.3.1 安罗替尼一线治疗 给予盐酸安罗替尼胶囊(12mg/粒,国药准字H20180004,正大天晴药业集团股份有限公司)12mg/次,1次/d;用药2周、停1周;每6周评估疗效1次,若疾病控制及不良反应耐受良好则持续用药,直至疾病进展终止。
1.3.2 全身化疗 对于肺鳞癌患者,应用白蛋白紫杉醇+顺铂方案;对于肺腺癌患者,应用培美曲塞+顺铂方案。
1.4 观察指标 (1)临床疗效:所有靶病灶消失为完全缓解;靶病灶最长径之和较基线状态至少减少30%为部分缓解;介于部分缓解与疾病进展之间为疾病稳定;经治疗后原发肿瘤灶最长径较前增加20%,或出现一个或多个新病灶为疾病进展。客观有效包括部分缓解、完全缓解;疾病控制包括完全缓解、部分缓解、疾病稳定。(2)生存指标:以中位PFS为主要疗效终点,中位OS为次要疗效终点。(3)影像学指标:根据薄层CT检查图像测量原发灶及肺内转移灶最长径,每8周评估1次。(4)不良反应:参照美国国立癌症研究所的常见毒性反应分级标准4.0进行评价[7]。
1.5 统计学处理 应用SPSS 21.0统计软件。计数资料组间比较采用χ2检验或Fisher确切概率法;采用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较 两组患者客观有效率、疾病控制率比较,差异均无统计学意义(均P>0.05),见表1。
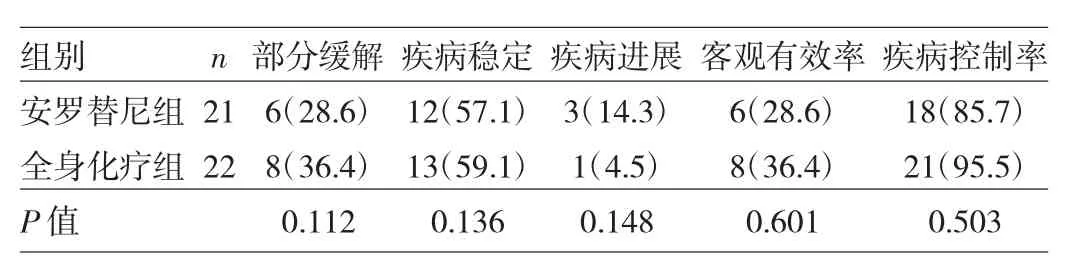
表1 两组患者临床疗效比较[例(%)]
2.2 两组患者生存情况比较 全身化疗组患者中位OS为9个月,中位PFS为7个月;安罗替尼组患者中位OS为9个月,中位PFS为6个月。两组患者OS及PFS的生存曲线比较见图1。

图1 两组患者OS及PFS的Kaplan-Meier生存曲线(a:OS;b:PFS)
2.3 安罗替尼治疗后病灶长径变化 安罗替尼治疗后原发灶长径在短期内变化不明显,仅治疗10个月时与治疗前比较差异有统计学意义(P<0.05);肺内最大转移灶长径在短期内缩小,治疗4、6、8、10个月时与治疗前比较差异均有统计学意义(均P<0.05),见表2。
2.4 安罗替尼治疗过程中不良反应 21例晚期NSCLC患者在安罗替尼治疗过程中出现高血压12例(57.1%)、乏力10例(47.62%)、手足综合征7例(33.33%)、腹泻3例(14.29%)、咳嗽3例(14.29%)、促甲状腺激素轻度升高1例(4.76%),均为2级以内的不良反应;给予对症处理后好转。
3 讨论
肺癌是目前发病率最高的恶性肿瘤之一,全球肿瘤致死率中位居第一。依据组织学分类,肺癌可分为NSCLC和小细胞肺癌,其中NSCLC约占肺癌的4/5。手术治疗是早期NSCLC的主要治疗手段,但中晚期NSCLC治疗仍以传统的放化疗为主。但随着对EGFR信号通路研究的进展,发现了一系列靶向药物作用的靶点,并开发了相应的靶向治疗药物。目前肺癌治疗已提升至分子靶向治疗水平[8]。但对于驱动基因阴性的晚期NSCLC患者,含铂类药物的两药联合化疗仍是标准治疗方案,近年来并无突破性进展。安罗替尼是我国自主研发的一种新型口服酪氨酸激酶抑制剂,能够有效抑制VEGFR、PDGFR、FGFR、干细胞因子受体(c-Kit)等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的双重作用[9]。在多项实体瘤的临床研究中,应用安罗替尼均获得了良好的治疗效果。一项全国多中心的随机、双盲Ⅱ期临床研究结果显示,安罗替尼组中位PFS(4.8个月)明显优于安慰剂组(1.2个月)[10]。另一项多中心随机、双盲的Ⅲ期临床研究针对接受过2种化疗方案且使用靶向药物治疗后出现耐药或不能耐受的ⅢB/Ⅳ期患者,结果显示安罗替尼能延长患者的中位OS和PFS,其中OS延长3.3个月,PFS延长4.0个月[11]。基于上述研究结果,中国食品药品监督管理局将安罗替尼单药作为治疗晚期NSCLC的三线及以上治疗药物。但是,目前关于安罗替尼作为一线治疗晚期NSCLC的研究鲜有报道。

表2 安罗替尼治疗后病灶长径变化(cm)
本研究对驱动基因阴性的晚期NSCLC患者分别予安罗替尼一线治疗或全身化疗,结果显示两组患者OS均为9个月,全身化疗组PFS略高;在治疗过程中,安罗替尼对原发灶的控制效果较转移灶略差,药物不良反应均在2级以内,予对症处理后好转。此外,两组患者疾病缓解率、疾病控制率比较差异均无统计学意义,可能与本研究样本较少、随访时间较短有关。
目前安罗替尼并未作为肺癌一线治疗药物进行推荐。但在临床实际工作中,许多晚期NSCLC患者对放疗强烈抗拒,甚至拒绝治疗;若基因靶向检测提示驱动基因阴性,那么安罗替尼可能是延长此类患者生存的有效药物。但在应用之前,必须充分取得患者及家属知情同意。总之,晚期NSCLC治疗的主要模式仍是联合放化疗,随着对安罗替尼临床应用研究的深入,未来可能出现安罗替尼联合化疗、靶向治疗等新模式,从而为患者带来更好的获益。
