基于miR-34a/SIRT1轴探讨奥沙拉秦钠治疗溃疡性结肠炎的作用机制
2019-12-20江巧丽朱佳杰戴蕾罗灵和杨珠莹
江巧丽 朱佳杰 戴蕾 罗灵和 杨珠莹
溃疡性结肠炎是一种肠道疾病,病程较长,同时具有易复发甚至癌变等特点,严重影响患者生活质量及身心健康[1]。溃疡性结肠炎所致的肠道炎性反应环境,会导致活性氧及活性氮含量明显增加进而引发氧化应激反应,最终加重病变严重程度[2]。传统抗结肠炎药物5-氨基水杨酸与新型生物制剂均可提高炎症性肠病疗效,但由于溃疡性结肠炎病因尚未完全明确,治疗效果尚不理想。奥沙拉秦钠是当前治疗溃疡性结肠炎常用的药物,不仅效果较好,且不良反应少,已在临床推广用,但关于其具体作用机制及通过调控哪些信号通路发挥作用均未明确[3]。有研究表明微小RNA-34a(microRNA-34a,miR-34a)表达水平降低可缓解肝细胞氧化应激损伤并发挥保护作用[4]。相关研究报道沉默信息调节因子 1(silent information regulator 1,SIRT1)是 miR-34a靶基因,人晶状体上皮细胞氧化应激反应中miR-34a表达水平上调并可通过下调靶基因SIRT1表达进而促进氧化应激反应发生[5]。由此猜测miR-34a/SIRT1途径与氧化应激反应密切相关。因此,本研究通过建立溃疡性结肠炎小鼠模型,探讨奥沙拉秦钠对溃疡性结肠炎的治疗效果及其与miR-34a/SIRT1轴在氧化应激方面的可能作用机制。
1 材料和方法
1.1 实验动物 SPF级雄性小鼠80只,体重20~30g,购自浙江大学实验动物中心,许可证号:SYXK(浙)2017-0023。所有小鼠在温度21~26℃、湿度45%~56%环境下适应性饲养3周,每天光照12h,白昼交替。
1.2 主要试剂与仪器 奥沙拉秦钠胶囊购自天津力生物制药股份有限公司(批号:20160218,规格:0.25g);Lipofectamine2000(批号:170618)与 Trizol试剂(批号:170521)均购自美国Invitrogen公司;阴性转染质粒与pHLV-U6-ZsGreen-Puro载体均购自上海吉凯基因技术有限公司;miR-34a过表达载体混合溶液由本实验室构建并保存;2,4,6-三硝基苯磺酸 (TNBS)(批号:20161221)购自美国 Sigma公司;反转录与 SYBRTMGreenERTMKit试剂盒均购自美国Thermo Fisher公司;兔抗鼠SIRT1抗体(批号:8469)购自美国CST公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG抗体(批号:20170416)购自北京博尔西科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)(批号:20170312)、丙二醛(malondialdehyde,MDA)(批号:20170321)、髓过氧化物酶(MPO)(批号:20170411)、NO(批号:20170310)、一氧化氮合成酶(inducible nitric oxide synthase,iNOS)(批号:20170312)、谷胱甘肽-过氧化物酶(glutathione peroxidase,GSH-Px)(批号:20160413)试剂盒均购自南京建成生物科技有限公司;IL-1β(批号:20160111)、IL-6(批号:20160216)、TNF-α(批号:20160213)、IL-8(批号:20160318)、ELISA 试剂盒均购自北京雅安达生物技术有限公司;PBS缓冲液(批号:20170412)购自上海远慕生物科技有限公司。qRT-PCR仪购自美国Bio-Rad公司;DS-U3型凝胶成像分析系统购自日本Nikon公司;Image-proplus 6.0分析软件均购自美国Media Cybernetics公司;Eclipse CI型正置光学显微镜购自南京斯高谱仪器有限公司。
1.3 实验方法
1.3.1 溃疡性结肠炎小鼠模型建立、给药及分组 小鼠适应性饲养5d后随机选取10只小鼠为对照组,对其余70只小鼠采用TNBS法建立溃疡性结肠炎小鼠模型,具体方法为小鼠禁食24h后分别注射40mg/kg戊巴比妥钠,0.6ml TNBS溶于0.25ml乙醇溶液中,制作橡胶软管插入小鼠肛门(深度为8cm),将上述混合液经注射器注入橡胶软管,将小鼠倒立30s后,平放使其自然恢复。参照杨强[6]报道的实验方法,建立溃疡性结肠炎小鼠模型。按照随机数字表法将造模成功的70只小鼠分为模型组、(奥沙拉秦钠)低、中、高剂量组、阴性转染组、miR-34a过表达组和奥沙拉秦钠高剂量+miR-34a过表达组(HG组)7组,每组10只。奥沙拉秦钠胶囊研磨后用100目筛过滤,与蒸馏水配制成质量浓度为50mg/ml(低)、100mg/ml(中)、150mg/ml(高)混悬奥沙拉秦钠药液,置于4℃冰箱保存。低、中、高剂量组分别给予227.5、455.0、682.5mg/kg奥沙拉秦钠药液灌胃,灌胃体积均为4.55ml/kg,奥沙拉秦钠剂量相当于成人治疗剂量1.5g/d、3.0g/d、4.5g/d的9.1倍[7]。阴性转染组在小鼠尾部静脉注射100μl阴性转染质粒;模型组与对照组均在小鼠尾部注射100μl PBS;miR-34a过表达组在小鼠尾部静脉注射100μl miR-34a过表达载体混合溶液;HG组在小鼠尾部静脉注射100μl miR-34a过表达载体混合溶液;均连续给药10d。对照组、模型组、低、中、高剂量组5组观察比较奥沙拉秦钠对小鼠结肠组织病理学和miR-34a、SIRT1 mRNA表达水平的影响;对照组、模型组、高剂量组、阴性转染组、miR-34a过表达组、HG组6组小鼠观察比较奥沙拉秦钠对小鼠结肠组织氧化应激水平、血清炎性因子表达水平和结肠组织中miR-34a、SIRT1表达水平的影响。
1.3.2 结肠组织病理变化观测 根据小鼠日常活动参照相关文献[8]报道进行疾病活动指数(DAI)评分评定。连续给药10d后禁食1d,于第12天处死小鼠并剪开小鼠腹腔,沿结肠与远端回肠切取整个肠段,采用0.9%氯化钠溶液冲洗,展开结肠组织并仔细观察。切取病变结肠组织,约0.11g,常规固定后制备石蜡切片,采用HE染色观察结肠组织病变,光镜下观察结肠组织学变化,按照组织学损伤程度进行病理评分(HI)[9]。
1.3.3 结肠组织中miR-34a、SIRT1 mRNA表达水平检测 采用qRT-PCR法。给药处理12d后,颈部脱臼处死小鼠,采集对照组、模型组、低、中、高剂量组小鼠结肠组织,液氮中研磨结肠组织,加入10μl Trizol试剂提取总RNA,反转录,qRT-PCR法检测小鼠结肠组织中miR-34a、SIRT1 mRNA 表达水平。反应条件 :95℃5min,95℃ 30s,60℃ 30s,72 ℃ 30s,共 40 个循环。miR-34a以U6为内参基因,SIRT1以GAPDH为内参基因,采用 2-ΔΔCt相对定量法计算 miR-34a、SIRT1 mRNA 的相对表达量。
1.3.4 结肠组织氧化应激水平检测 采用硝酸还原酶法。取各组小鼠冻存结肠组织,采用黄嘌呤氧化酶法检测SOD水平;硫代巴比妥酸反应产物比色法检测MDA水平;采用硝酸还原酶法检测NO水平;采用髓过氧化物酶检测MPO水平;按照iNOS检测试剂盒检测iNOS水平;采用酶促反应计算GSH-Px水平。
1.3.5 血清炎性因子表达水平检测 采用ELISA法。给药处理12d时采用脱颈法处死小鼠,并采用心脏取血法采集小鼠血液样本置于离心管内,3 000r/min离心15min,取上血清置于-80℃超低温冰箱保存,采用ELISA法检测各组小鼠血清IL-1β、IL-6、TNF-α、IL-8表达水平。
1.3.6 结肠组织中SIRT1蛋白表达检测 采用Western blot法。取50mg小鼠结肠组织并加入蛋白裂解液提取总蛋白,采用BCA法测定蛋白浓度,SDS-PAGE凝胶电泳反应分离蛋白,移至PDVF膜,脱脂奶粉封闭,2h后加入SIRT1一抗(稀释比均为 1∶1 000),置于 4℃冰箱孵育过夜,次日加入二抗(稀释比1∶10 000),ECL显影后置于凝胶分析系统观察蛋白条带,采用Imageproplus6.0图像分析系统分析蛋白条带积分光密度值,SIRT1蛋白相对表达量=SIRT1蛋白条带积分光密度值/GADPH条带积分光密度值。
1.4 统计学处理 采用SPSS 21.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t或SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 5组小鼠结肠组织病理变化比较 与对照组小鼠相比,模型组小鼠结肠黏膜明显充血、水肿且结肠长度缩短;与模型组小鼠相比,奥沙拉秦钠低、中、高剂量组结肠外观明显改善,见图1。HE染色显示对照组小鼠结肠组织黏膜完整且腺体结构均呈排列整齐,没有出现明显溃疡现象;与对照组小鼠相比,模型组小鼠结肠黏膜出现缺损且腺体结构出现分离,同时出现中性粒细胞浸润;低剂量组与模型组相似,中剂量组小鼠结肠黏膜出现一定缺损及隐窝损伤,中性粒细胞浸润明显减少且可见部分腺体结构;与模型组相比,高剂量组小鼠结肠组织结构与腺体结构均较为完整,仅见少量中心粒细胞浸润,未见隐窝损伤,见图2。与对照组相比,模型组、低、中、高剂量组小鼠DAI评分与HI评分均明显升高(均P<0.05);与模型组相比,低、中、高剂量组小鼠DAI评分与HI评分均明显降低(均P<0.05);与高剂量组相比,低、中剂量组小鼠DAI评分与HI评分均明显升高(均P<0.05),见表1。
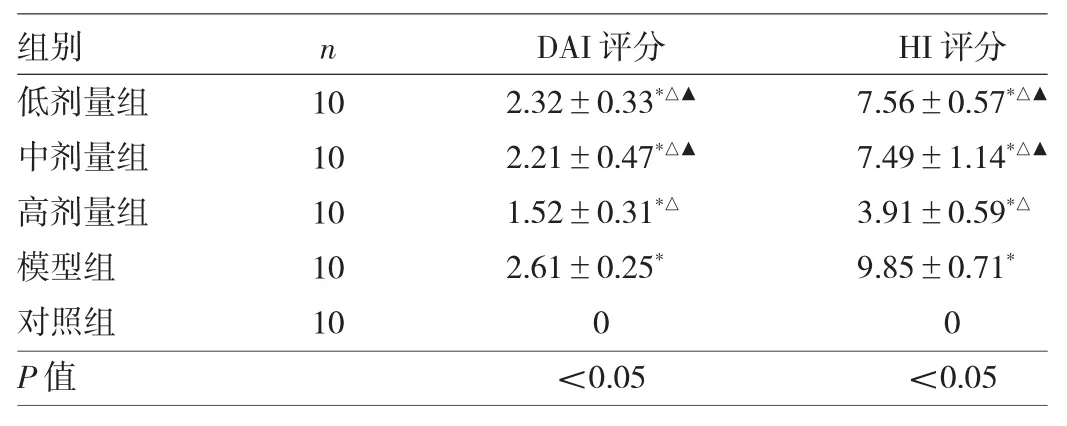
表1 5组小鼠DAI、HI评分比较(分)

图1 5组小鼠结肠外观图
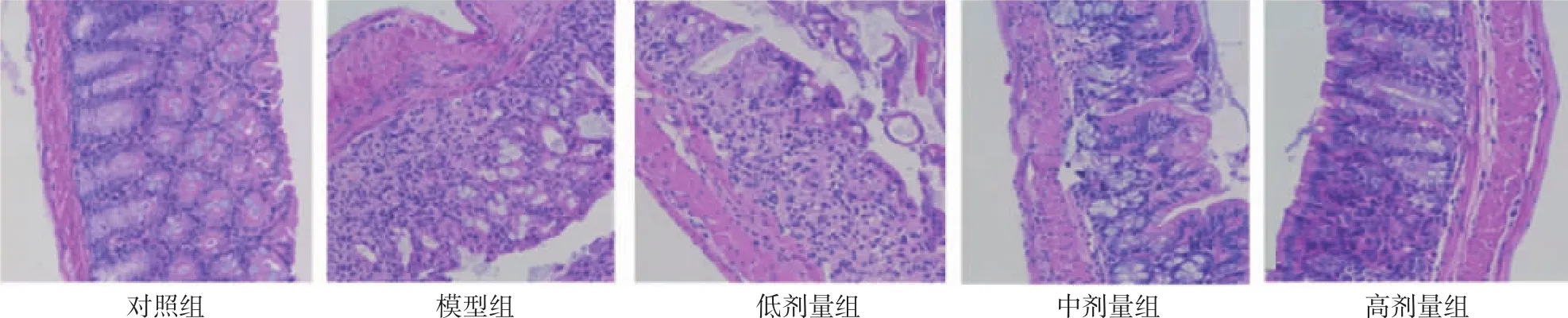
图2 5组小鼠结肠组织HE染色结果比较(×200)
2.2 5 组小鼠结肠组织中miR-34a、SIRT1 mRNA表达水平的比较 与对照组相比,模型组小鼠结肠组织中miR-34a表达水平明显升高,SIRT1 mRNA表达水平明显降低(均P<0.05);与模型组相比,奥沙拉秦钠低、中、高剂量组小鼠结肠组织中miR-34a表达水平均明显降低,SIRT1 mRNA表达水平均明显升高(均P<0.05);与高剂量组相比,低、中剂量组小鼠结肠组织中miR-34a表达水平均明显升高,SIRT1 mRNA表达水平均明显降低(均P<0.05)。见表2。
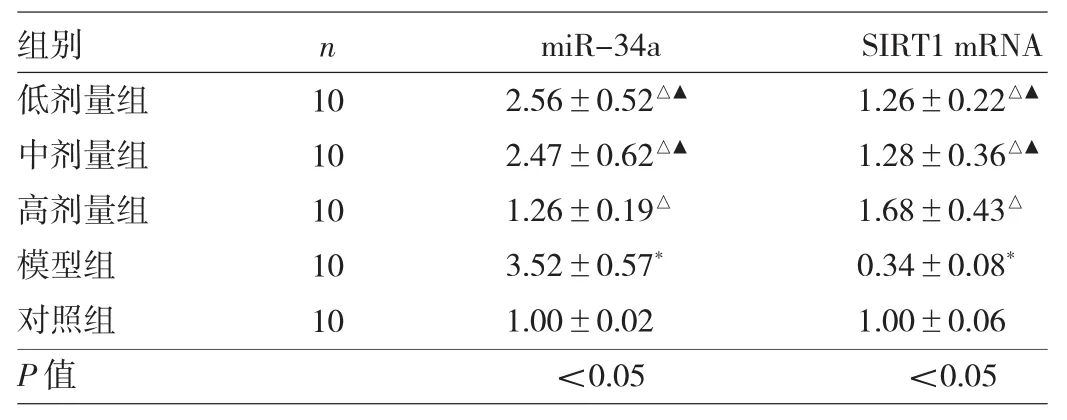
表25组小鼠结肠组织中miR-34a、SIRT1mRNA表达水平的比较
2.3 6 组小鼠结肠组织氧化应激水平的比较 与对照组相比,模型组小鼠结肠组织MDA、MPO、NO、iNOS水平均明显升高,SOD、GSH-Px水平均明显降低(均P<0.05);与模型组相比,高剂量组小鼠结肠组织MDA、MPO、NO、iNOS水平均明显降低,SOD、GSH-Px水平均明显升高(均P<0.05);与高剂量组相比,miR-34a过表达组与HG组小鼠结肠组织MDA、MPO、NO、iNOS水平均明显升高,SOD、GSH-Px水平均明显降低(均P<0.05);与阴性转染组相比,miR-34a过表达组小鼠结肠组织MDA、MPO、NO、iNOS 水平均明显升高,SOD、GSH-Px 水平均明显降低(均P<0.05)。见表3。
2.4 6组小鼠血清炎性因子表达水平的比较 与对照组相比,模型组小鼠 IL-1β、IL-6、TNF-α、IL-8 表达水平均明显升高(均P<0.05);与模型组相比,高剂量组IL-1β、IL-6、TNF-α、IL-8表达水平均明显降低(均P<0.05);与高剂量组相比,miR-34a过表达组与HG组IL-1β、IL-6、TNF-α、IL-8表达水平均明显升高(均P<0.05);与阴性转染组相比,miR-34a过表达组 IL-1β、IL-6、TNF-α、IL-8表达水平均明显升高(均P<0.05)。见表4。
2.5 6组小鼠结肠组织中miR-34a、SIRT1 mRNA、蛋白表达水平的比较 与对照组相比,模型组小鼠结肠组织中miR-34a表达水平明显升高,SIRT1 mRNA及蛋白表达水平均明显降低(均P<0.05);与模型组相比,高剂量组小鼠结肠组织中miR-34a表达水平均明显降低,SIRT1 mRNA及蛋白表达水平均明显升高(均P<0.05);与高剂量组相比,miR-34a过表达组与HG组小鼠结肠组织中miR-34a表达水平均明显升高,SIRT1 mRNA及蛋白表达水平均明显降低(均P<0.05);与阴性转染组相比,miR-34a过表达组miR-34a表达水平均明显升高,SIRT1 mRNA及蛋白表达水平均明显降低(均P<0.05),见图 3、表 5。
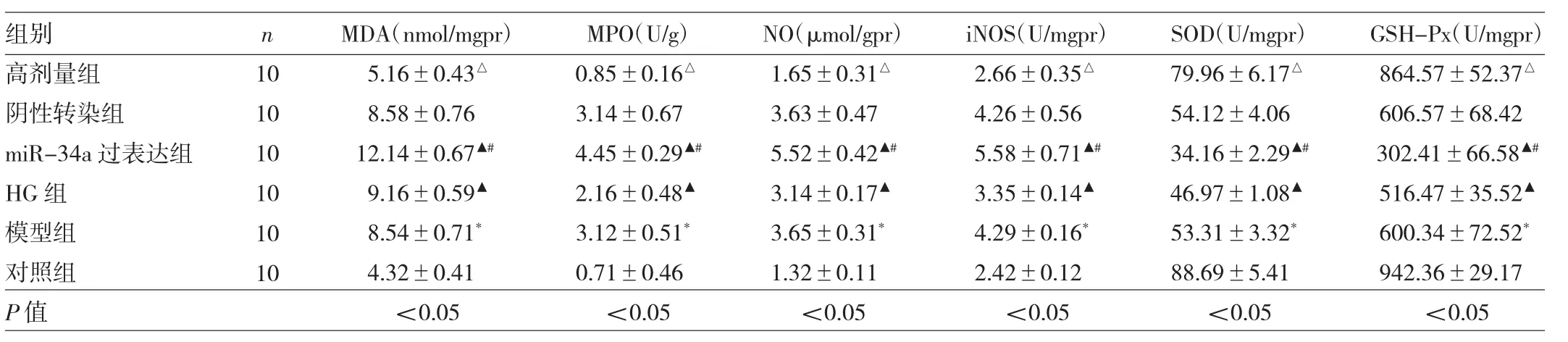
表3 6组小鼠结肠组织氧化应激水平的比较
3 讨论
溃疡性结肠炎病变部位位于直肠与结肠黏膜层,其病理学变化主要为炎症、糜烂及溃疡,患者临床表现为腹泻、腹痛及黏液脓血便等,随着病情严重程度加重可能发展为结肠癌[10]。溃疡性结肠炎病因尚未明确且临床缺乏特异性治疗方法,因而如何控制溃疡性结肠炎进展并减少患者复发率成为当前研究难点。因此,积极寻找溃疡性结肠炎治疗药物成为热点研究问题。
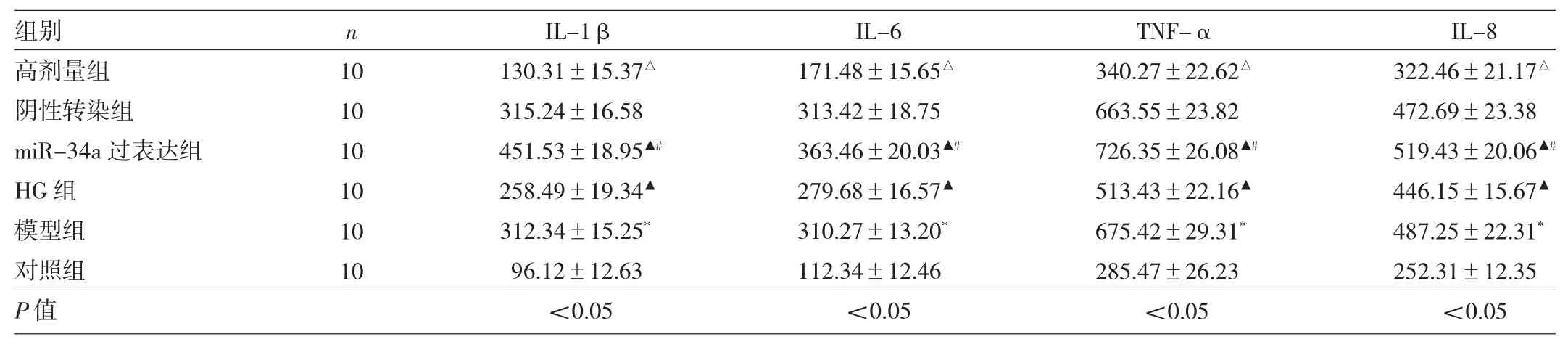
表4 6组小鼠血清炎性因子表达水平的比较(pg/ml)

图3 6组小鼠结肠组织中SIRT1蛋白电泳图
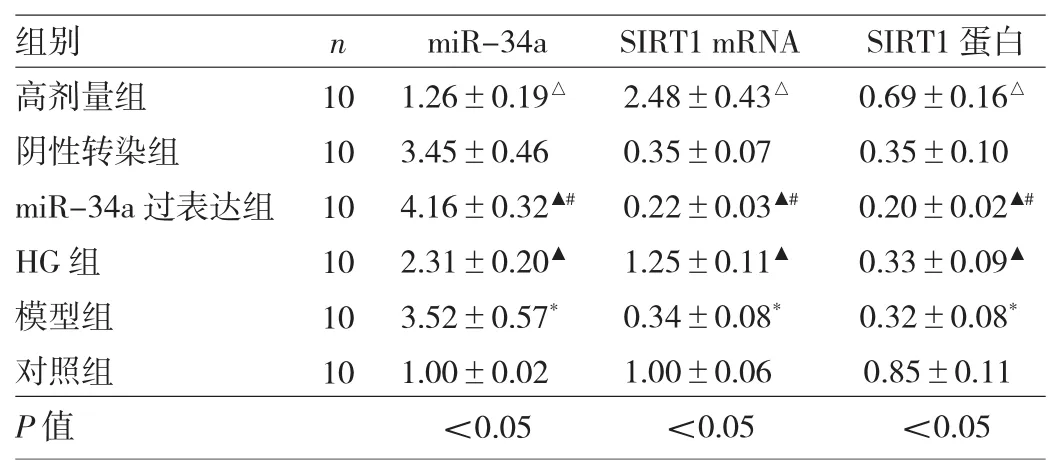
表5 奥沙拉秦钠对转染小鼠结肠组织中miR-34a、SIRT1表达水平的影响
奥沙拉秦钠可有效治疗反复发作型溃疡性结肠炎并可缓解患者临床症状,其作用效果明显优于柳氮磺吡啶等药物,同时患者胃肠道不良反应发生率均明显降低[11-12]。本研究通过建立溃疡性结肠炎小鼠模型,采用HE染色法观察奥沙拉秦钠对小鼠结肠组织病理学的影响,结果显示低、中、高剂量组DAI评分与HI评分均低于模型组并可有效改善结肠外观充血水肿现象,说明奥沙拉秦钠有助于减缓溃疡性结肠炎小鼠病理症状并减轻肠道黏膜损伤,提示奥沙拉秦钠可有效治疗溃疡性结肠炎,与临床研究相似。miR-34a表达水平与氧化应激损伤程度密切相关,随着氧化应激反应加剧miR-34a表达水平明显升高并可加重机体氧化应激损伤[13]。机体受到氧化应激损伤时SIRT1蛋白可通过减少细胞凋亡进而发挥抗氧化应激反应功能[14]。研究发现白内障大鼠中miR-34a表达水平升高可抑制靶基因SIRT1表达并加重机体氧化应激损伤,进而促进白内障发生[15]。本研究结果显示模型组小鼠结肠组织中miR-34a表达水平高于对照组,而SIRT1表达水平明显降低,高剂量组小鼠结肠组织中miR-34a表达水平明显降低,SIRT1表达水平明显升高,说明miR-34a/SIRT1途径参与溃疡性结肠炎发生过程,奥沙拉秦钠干预后可能通过降低miR-34a表达水平并上调SIRT1表达进而发挥抗氧化作用。提示奥沙拉秦钠可有效治疗溃疡性结肠炎小鼠,其可能通过调控miR-34a/SIRT1途径发挥作用。
溃疡性结肠炎所致肠道炎症损伤与氧化应激反应密切相关,活性氧自由基大量释放或抗氧化系统功能减弱均可造成组织损伤,MDA含量越高预示溃疡性结肠炎大鼠体内脂质过氧化程度及细胞氧化程度加重,MPO含量增加直接反映肠道炎性细胞浸润及炎症反应程度并可作为评估肠道炎症严重程度的重要指标,同时肠道中性粒细胞及巨噬细胞均可产生诱导型iNOS进而促使NO生成量增加,NO又可进一步促进炎症反应并造成细胞出现不同程度损伤,同时抗氧化系统中SOD与GSH-Px均具有抗氧化及抑制溃疡性结肠炎肠组织脂质过氧化等重要作用[16-18]。本研究为了进一步探究奥沙拉秦钠是否通过调控miR-34a/SIRT1途径发挥作用,同时奥沙拉秦钠高剂量对溃疡性结肠炎的治疗效果最为明显,因而本研究构建miR-34a过表达载体并将其经注射器注入奥沙拉秦钠高剂量小鼠中,比较分析各组小鼠结肠组织氧化应激水平,结果显示模型组小鼠结肠组织MDA、MPO、NO、iNOS水平均明显高于对照组,SOD、GSH-Px水平均明显降低;高剂量组小鼠结肠组织MDA、MPO、NO、iNOS水平均明显低于模型组、miR-34a过表达组、HG组,而SOD、GSH-Px水平均明显升高,说明奥沙拉秦钠可通过抑制miR-34a表达并上调SIRT1表达进而促使SOD、GSH-Px活性升高并增强溃疡性结肠炎小鼠抗氧化系统。提示奥沙拉秦钠可通过调控miR-34a/SIRT1途径进而抑制溃疡性结肠炎小鼠结肠组织氧化应激反应。溃疡性结肠炎小鼠肠组织炎症反应加剧,其中炎性因子IL-1β、IL-6、TNF-α、IL-8等释放量增加并可进一步诱发周围组织损伤[19-20]。本研究结果显示模型组小鼠血清IL-1β、IL-6、TNF-α、IL-8水平均明显高于对照组,高剂量组小鼠血清 IL-1β、IL-6、TNF-α、IL-8 水平均明显低于模型组、miR-34a过表达组、HG组,说明奥沙拉秦钠可降低溃疡性结肠炎小鼠炎症反应,其可能通过抑制miR-34a表达并间接上调SIRT1表达发挥作用。同时本研究检测各组小鼠结肠组织miR-34a、SIRT1表达水平,结果发现模型组小鼠结肠组织中miR-34a表达水平高于对照组,SIRT1表达水平明显降低;高剂量组miR-34a表达水平明显低于模型组、miR-34a过表达组、HG组,而SIRT1表达水平均明显升高,进一步证实奥沙拉秦钠可调控miR-34a/SIRT1途径,提示奥沙拉秦钠可通过调控miR-34a/SIRT1途径进而抑制溃疡性结肠炎小鼠肠道组织炎症反应及氧化应激反应。
综上所述,本研究通过建立溃疡性结肠炎小鼠模型并应用奥沙拉秦钠治疗,初步证实奥沙拉秦钠基于miR-34a/SIRT1轴治疗溃疡性结肠炎的作用机制。进一步研究奥沙拉秦钠基于miR-34a/SIRT1轴治疗溃疡性结肠炎的作用效点及其与其他信号通路的可能作用机制均具有重要意义。今后将从分子水平及药代动力学角度分析奥沙拉秦钠治疗溃疡性结肠炎的有效性。
