三七皂苷改善狼疮肾炎小鼠激素耐药状态及脂代谢紊乱的作用研究
2019-12-20徐峥丁伟森鲁盈
徐峥 丁伟森 鲁盈
狼疮肾炎是系统性红斑狼疮最为常见和最为严重的并发症,具有病程长、易反复且并发症多的特点。糖皮质激素是治疗狼疮性肾炎的一线药物,但部分患者对激素治疗不敏感,且由于激素和疾病本身带来的心血管疾病风险,患者往往会出现脂代谢紊乱的状态,很大程度上影响其生活质量及远期生存。以往在临床实践中发现使用三七制剂联合激素治疗狼疮肾炎的疗效优于单纯使用激素,推测三七具有逆转激素耐药的作用[1]。笔者对三七皂苷改善狼疮肾炎小鼠激素耐药状态及脂代谢紊乱的作用作了进一步研究,现将结果报道如下。
1 材料和方法
1.1 实验动物 NZB/WF1狼疮肾炎小鼠36只,16周龄,雌雄各半,体重20~30g,委托南京大学-南京生物医药研究院从美国Jackson实验室引进;正常健康ICR小鼠6只,16周龄,雌雄各半,体重20~25g,由浙江省中医药研究院动物实验中心提供。
1.2 主要试剂和仪器 三七总皂苷(冻干粉,100mg/支,国药准字Z20025652,批号14071610,广西梧州制药股份有限公司);甲泼尼龙片(4mg/片,进口药品注册证号H20110064,批号 X836A,Pfizer Italia Srl公司);过氧化物酶体增殖物激活受体(PPAR)γ-siRNA(冻干粉,1OD分装,按比例溶于DEPC水后使用)、沉默信息调节因子(SIRT)1-siRNA(冻干粉,1OD分装,按比例溶于DEPC水后使用)及阴性对照(无沉默SIRT1基因作用序列,冻干粉,1OD分装)委托上海吉玛制药技术有限公司设计合成。主要仪器:HITACHI7600生化分析仪;Beckman3通道流式细胞仪;Bio-rad蛋白电泳系统。
1.3 建模及分组药物处理 所有小鼠均予高脂饲料(在普通饲料中加入15%脂肪、1.25%胆固醇和0.5%粗盐)喂养。6只狼疮肾炎小鼠设为A组,另30只按0.8mg/kg甲强龙(4mg溶于50ml的0.9%氯化钠溶液中)1次/d连续灌胃4周诱导激素耐药,建立激素耐药模型,继续灌胃4周维持并按随机数字表法分为5组,每组6只。A组予0.9%氯化钠溶液约0.8ml、1次/d灌胃8周;B组为激素耐药模型组,仅予甲强龙灌胃8周;C组为SIRT1-siRNA组,予甲强龙灌胃8周,同时在第4、6、8 周尾静脉各注射 SIRT1-siRNA(14.286μg/10g)1次;D组为SIRT1-siRNA阴性对照组,予甲强龙灌胃8周,同时第5周开始每周注射SIRT1-siRNA阴性对照(14.286μg/10g)1次;E组为低剂量三七皂苷组,予甲强龙灌胃8周,同时第5周开始腹腔注射三七皂苷50mg/kg(200mg溶于40ml的0.9%氯化钠溶液中),1次/d;F组为高剂量三七皂苷组,予甲强龙灌胃8周,同时第5周开始腹腔注射三七皂苷100mg/kg,1次/d。另将6只ICR小鼠设为G组,予0.9%氯化钠溶液约0.8ml灌胃8周,1次/d。在给药过程中,密切观察小鼠的精神状态、被毛亮泽度、反应性、活动度、体重增减、饮水和进食等情况,记录有无死亡情况发生。
1.4 尿糖水平检测 在实验前、中(第4周)、后(第8周结束前1d)留取小鼠24h尿液样本,采用班氏法检测尿糖水平。
1.5 肾功能及血脂水平检测 给药8周后处死小鼠并采集血液标本,使用全自动生化分析仪测定小鼠血肌酐(Scr)、尿素氮(BUN)、甘油三酯(TG)、总胆固醇(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)水平。
1.6 血C反应蛋白(CRP)、内皮型一氧化氮合酶(eNOS)水平检测 采用ELISA法检测小鼠上述血液标本CRP、eNOS表达水平,具体操作按试剂盒说明书步骤进行。
1.7 腹主动脉内皮细胞凋亡率检测 采用流式细胞术。剖取小鼠腹主动脉(约0.5cm长),分离周围脂肪组织,分别以一型胶原酶、胰蛋白酶孵育,收集解离的动脉内皮细胞;使用BDannexinV、PI双染试剂盒检测内皮细胞凋亡率。早期凋亡提示细胞非正常死亡,晚期凋亡提
示细胞正常死亡。凋亡率为早期凋亡与晚期凋亡之和。1.8 肝脏细胞PPARγ、SIRT1 mRNA表达水平检测处死小鼠后打开腹腔,分离小鼠肝脏,分装于EP管中,置于-80℃冰箱冻存。取冻存的小鼠肝脏组织100mg,研磨成粉末状。按照日本Takara公司RNAiso Plus提取小鼠肝组织总RNA并进行纯度检测、反转录,采用RTPCR法检测PPARγ、SIRT1 mRNA表达水平。
1.9免疫共沉淀检测 取冻存的小鼠肝组织,提取蛋白,加入SIRT1 IP一抗,摇动孵育,proteinA/G plus-agarose捕捉抗原抗体复合物,沸水浴游离抗原、抗体、琼脂糖珠,取上清液,采用Western blot法检测PPARγ蛋白表达。若检测到PPARγ蛋白表达,提示PPARγ与SIRT1之间存在互相作用。
1.10 统计学处理 应用SPSS 17.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;组内各时段比较采用重复测量数据的方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 7组小鼠不同实验时段的尿糖水平比较 实验后,A、C、D组小鼠尿糖水平较实验前均明显升高(P<0.05);与G组比较,A、D组尿糖水平均明显升高(均P<0.05);与A组比较,C、E、F组尿糖水平均明显降低(均P<0.05);C、E、F 组间两两比较,差异均无统计学意义(均P>0.05),见表 1。

表1 7组小鼠不同实验时段的尿糖水平比较(mmol/L)
2.2 7组小鼠肾功能检测结果比较 7组小鼠Scr及BUN水平比较,差异均有统计学意义(均P<0.05)。与G组比较,A、B、C、D组小鼠Scr水平均明显升高(均P<0.05),C、D、E、F组BUN水平亦明显升高(均P<0.05);与A组比较,D、E、F组BUN水平均明显升高(均P<0.05);与B组比较,D组BUN水平明显升高(P<0.05),见表2。
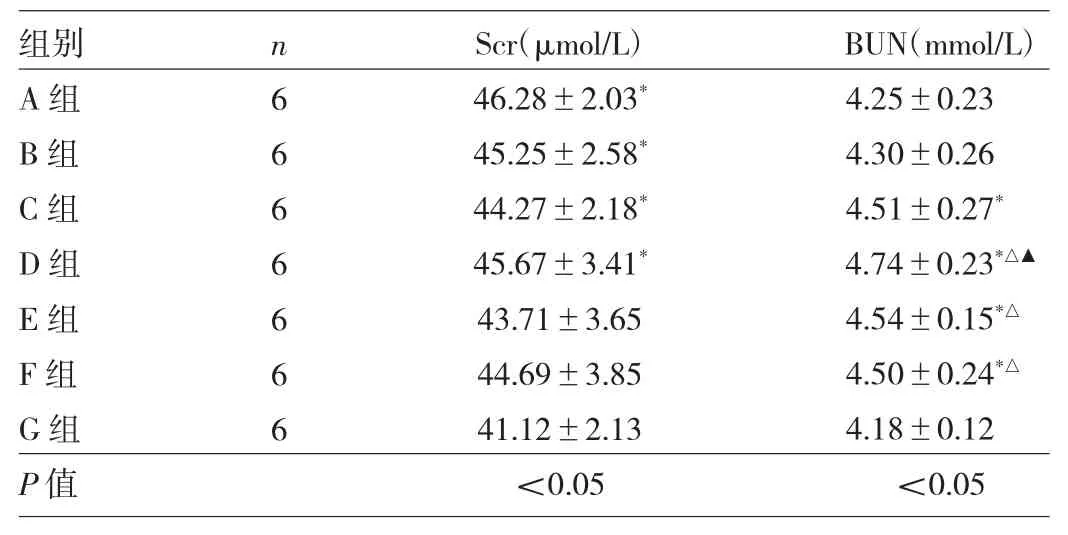
表2 7组小鼠肾功能检测结果比较
2.3 7组小鼠血脂水平比较 7组小鼠TC、TG、LDL-C、HDL-C水平比较,差异均有统计学意义(均P<0.05)。与G组比较,其他6组小鼠上述4项血脂水平均明显升高(均P<0.05);与 A、B 组比较,C、E、F 组 TC、TG、LDL-C水平均明显降低(均P<0.05);与C组比较,E、F组TG水平均明显降低(均P<0.05),见表3。
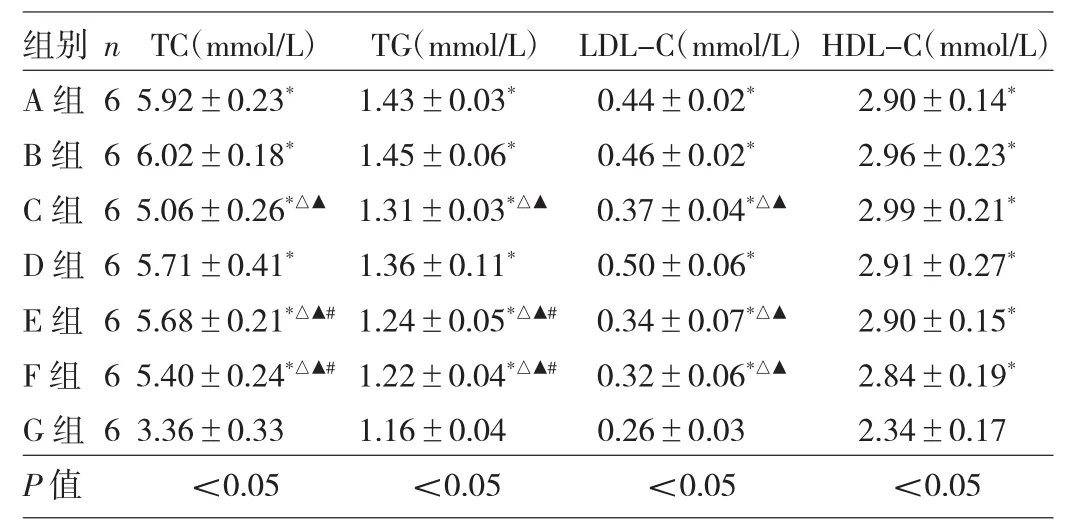
表3 7组小鼠血脂水平比较
2.4 7组小鼠血CRP、eNOS水平比较 7组小鼠血CRP、eNOS水平比较,差异均有统计学意义(均P<0.05)。与G组比较,其余6组小鼠血CRP水平均明显升高(均P<0.05),其中 C、E、F 组低于 A、B 组(均P<0.05)。C、D、E、F组小鼠eNOS水平与A、B组比较,差异均无统计学意义(均P>0.05),见表4。
2.5 7组小鼠腹主动脉内皮细胞凋亡率比较 7组小鼠腹主动脉内皮细胞早期凋亡率、晚期凋亡率和凋亡率比较,差异均有统计学意义(均P<0.05);其中B组晚期凋亡率较A组明显升高,C组凋亡率较E、F组降低,差异均有统计学意义(均P<0.05),见表5。G组小鼠腹主动脉内皮细胞并不表现为凋亡状态,其余各组小鼠腹主动脉内皮细胞均呈有不同程度的凋亡,以A、B、D组凋亡最明显,见图1。

表4 7组小鼠血CRP、eNOS水平比较

表5 7组小鼠腹主动脉内皮细胞凋亡率比较(%)

图1 7组小鼠腹主动脉内皮细胞凋亡率的流式细胞图
2.6 7组小鼠肝脏组织PPARγ、SIRT1 mRNA表达水平比较 7组小鼠肝脏组织PPARγ、SIRT1 mRNA表达水平比较,差异均有统计学意义(均P<0.05)。与C组比较,A、B组SIRT1 mRNA表达水平均明显升高(均P<0.05),PPARγ mRNA 表达水平均明显降低(均P<0.05);与B组比较,C、E、F组SIRT1 mRNA表达水平均明显下降(均P<0.05),PPARγ mRNA表达水平均明显升高(均P<0.05),见表 6。
2.7 PPARγ与SIRT1之间的互相作用 冻存的小鼠肝组织提取蛋白后进行免疫共沉淀检测,结果显示主要存在于细胞核内的SIRT1与主要存在于胞质的PPARγ存在互相作用,见图2。
3 讨论
本研究结果显示7组小鼠尿糖水平升高,提示狼疮肾炎小鼠在实验结束后出现一定程度的代谢紊乱状态,或基础存在的肾脏损害加重;而SIRT1-siRNA和三七皂苷具有一定的改善脂代谢及肾脏保护作用。血生化检查提示激素诱导耐药后,狼疮肾炎小鼠体内本身存在的脂代谢紊乱加重,SIRT1-siRNA和低、高剂量三七皂苷均有降血脂、改善脂代谢的作用。血CRP、eNOS水平检测结果提示狼疮肾炎小鼠体内存在慢性炎症状态,而使用三七皂苷能起到一定程度的抗炎作用。内皮细胞凋亡检测提示狼疮肾炎小鼠动脉内皮细胞大量死亡,内皮功能受损,预示着动脉粥样硬化的发生;而使用三七皂苷后表现出与SIRT1-siRNA类似的保护血管内皮的作用,其中高剂量的疗效更明显。

表6 7组小鼠肝脏组织PPARγ、SIRT1 mRNA表达水平比较

图2 狼疮肾炎小鼠肝组织SIRT1与PPARγ之间相互作用的电泳图
PPAR是一种Ⅱ型核激素受体,参与调控脂肪前体细胞分化的多个基因转录,主要与脂肪细胞分化[2]、脂类代谢[3]和血管病变[4]等有关。SIRT1是SIRT家族的7种同源体之一,参与调节核糖体DNA重组、基因沉默、DNA修复等重要生理过程[5]。近年来针对PPARγ与SIRT1的关系研究较多。Cao等[6]研究发现,PPARγ/SIRT1反馈环路在人膀胱癌的细胞周期代谢中发挥作用。另一项研究结果显示,肝星状细胞脂代谢中SIRT1还受到PPARγ的反馈性调节[7]。本研究以小剂量甲泼尼龙诱导狼疮肾炎小鼠产生激素耐药后,肝组织内SIRT1表达升高,PPARγ表达下降;以SIRT1-siRNA干预后,PPARγ表达升高,结合免疫共沉淀检测结果,证实狼疮肾炎小鼠体内存在SIRT1/PPARγ负性反馈作用。我们的前期研究证实,三七皂苷能通过调控SIRT1/FoxO1/MDR1mRNA通路影响P-糖蛋白表达,起到改善狼疮肾炎激素耐药的作用[8]。本研究低、高剂量三七皂苷处理后的小鼠SIRT1表达下调,PPARγ表达上调,在证实前期研究结果的同时,也提示SIRT1、PPARγ间反馈环路的存在。
本研究结果显示狼疮肾炎小鼠血脂水平高于正常小鼠,提示体内本身已存在脂代谢紊乱。使用SIRT1-siRNA干预后,血LDL-C水平下降,提示SIRT1可影响体内脂质代谢。SIRT1活性缺失时,LDL的生成减少或分解增多,血中游离的脂质成分减少(可能由于极低密度脂蛋白异化形成LDL以及肝脏合成LDL减少)。有研究表明,脂肪细胞中SIRT1表达上调,可抑制PPARγ活性和脂质累积[9];而下调SIRT1表达水平和活性,则能上调PPARγ表达,降低脂肪细胞外TG,促进小鼠外周血脂肪酸氧化分解[10]。这说明SIRT1/PPARγ通路的激活能降低血TC及LDL-C水平,对维持机体的脂类代谢平衡具重要作用。相关研究表明,PPARγ具有防止动脉粥样硬化的作用,主要表现为抑制炎症反应和调节内皮细胞增生和迁移[11-12]。SIRT1具有改善血管内皮功能、稳定粥样硬化斑块的作用[13],该作用是通过抑制VCAM表达、抑制巨噬细胞向泡沫细胞转化和抗氧化应激反应实现的[14-15]。PPARγ与SIRT1均有抗炎、抗动脉粥样硬化的作用,但两者间存在负反馈调节效应,因此笔者推测在动脉粥样硬化的病理过程中,两者存在协同的保护作用,PPARγ/SIRT1表达的平衡对延缓动脉粥样硬化进程具有积极意义。本研究中,狼疮肾炎小鼠体内血CRP水平较正常小鼠升高,SIRT1-siRNA干预后,CRP水平降低,说明狼疮肾炎小鼠体内存在慢性炎症状态,SIRT1活性被抑制后,炎症减轻,分析可能原因是PPARγ表达上调后,由其介导的抗炎症反应亦得到强化所致。
综上所述,三七皂苷通过对PPARγ/SIRT1通路的调控作用起到改善狼疮小鼠激素耐药及脂代谢紊乱状态的双重效应。
