丹酚酸B对成骨细胞氧化损伤的保护作用
2019-12-20荣彩丽桑春辉陈东唐琪
荣彩丽,桑春辉,陈东,唐琪
(1.宁波市鄞州第二医院 口腔科,浙江 宁波 315000;2.宁波市海曙区口腔医院 牙体牙髓科,浙江 宁波 315000;3.宁波市鄞州第二医院 病理科,浙江 宁波 315000;4.浙江大学医学院附属第二医院 口腔科,浙江 杭州 310009)
各类原因导致的牙列缺损是口腔修复科患者最常见的疾病类型之一,对患者口腔的美观和功能具有极大影响[1]。种植牙是将与人体骨质兼容性高的材料以外科手术的方式植入缺牙区的牙槽骨内从而使上部修复体固位稳定的一种修复方式,已成为口腔医学界公认的缺牙的首选修复方式[2]。然而,研究发现,在骨质疏松症中骨质和骨量明显下降的情况下,种植牙的成功率明显受限[3]。骨质疏松症是一种以单位体积内骨量减少为主要特征的代谢性骨疾病[4]。我国低骨量人群庞大,是骨质疏松症发病的高危人群,且其发病率随着年龄的增高而显著上升[5]。然而,迄今为止,骨质疏松症的机制仍未能完全揭晓,如何有效地预防和治疗骨质疏松,避免牙种植术的失败仍是目前重要的研究方向。
成骨细胞的活性和分化功能在骨骼发育和维持中起着至关重要的作用。研究发现骨质疏松症患者机体氧化应激水平明显增高[6],成骨细胞的活性和功能受到抑制[7]。因此,拥有抗氧化活性的生物活性剂有望成为治疗骨质疏松症的新型药物。
丹酚酸B(salvianolic acid B,Sal B)是从丹参中提取出的主要活性成分。作为传统中药,丹参一直被广泛应用于功能性食品、制药、化妆品和营养品等行业[8]。研究发现,丹参的药用功效与其主要活性成分Sal B具有的显著的抗氧化作用密不可分[9-10]。Sal B可通过抗氧化功效对抗过氧化氢、高糖、低氧等有害刺激引起的氧化损伤[11-13]。然而,Sal B所具有的抗氧化特性对成骨细胞的氧化损伤是否能产生保护作用目前国内外鲜见相关报道。为此,本研究构建成骨细胞氧化损伤模型,从细胞活性,胞内活性氧水平和分化矿化功能等方面检测Sal B的保护作用,为今后Sal B在骨质疏松症中的防治应用提供实验依据。
1 材料和方法
1.1 材料 MC3T3-E1小鼠前成骨细胞系购于美国ATCC公司。α-MEM培养基、胰酶、胎牛血清、青链霉素购于美国Gibco公司,Sal B(纯度≥95%)、叔丁基过氧化氢(tert-butyl hydroperoxide,TBHP)、二甲基亚砜(dimethyl sulfoxide,DMSO)、抗坏血酸、β-甘油磷酸、茜素红S、MTT、多聚甲醛(paraformaldehyde,PFA)购于美国Sigma公司,2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescin diacetate,DCFH-DA)荧光染料、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染料购于美国Life公司,反转录试剂盒、扩增试剂盒购于日本Takara公司,引物、Trizol试剂购于美国Invitrogen公司,其余试剂均为国产分析纯或进口分装。
1.2 方法
1.2.1 细胞培养:普通培养时将MC3T3-E1细胞用含有10%胎牛血清和1%青链霉素的α-MEM培养基在含5% CO2的37 ℃培养箱中培养。培养基每周更换2次。诱导成骨分化时,在细胞汇合后,在培养基中加入5 mmol/L β-甘油磷酸盐和100 mg/mL抗坏血酸配成矿化诱导液,矿化诱导液每3 d更换1次。
1.2.2 细胞活力测定:将MC3T3-E1细胞以1×104个细胞/孔的密度接种在96孔板中,进行不同处理后,通过MTT法在不同时间段进行细胞活力测定。具体操作方法:细胞处理完毕后将96 孔板中液体吸尽用0.01 mol/L PBS洗涤2次,然后加入100 μL含有l.5 mg/mL浓度MTT溶液的α-MEM在37 ℃下孵育4 h。 小心地吸去上部液体,加入100 μL DMSO溶解底部的晶体。将板振荡15 s彻底混匀后,用酶标仪测量490 nm处的吸光度值。
1.2.3 ROS测定:将MC3T3-E1细胞以3×104个细胞/孔的密度接种在放置有爬片的48孔板中。使用DCFH-DA荧光染料检测细胞总ROS水平。每孔加入 10 μmol/L浓度的DCFH-DA在37 ℃下孵育30 min。用PBS清洗3次,以除去多余染料。将细胞在室温下在4% PFA中固定30 min。用PBS再次洗涤3次后,将固定的细胞在室温下用20 μg/mL的DAPI染色15 min,然后用荧光显微镜对细胞成像,并使用NIH Image J软件进行荧光强度分析。
1.2.4 qPCR:将MC3T3-E1细胞以6×105个细胞/孔的密度接种在6孔板中。采用Trizol试剂提取各组细胞样本的总RNA,通过OD280/OD260比值来测定其纯度,比值在1.8~2.0为合格。使用带有gDNA Eraser的PrimeScript RT试剂盒,用1 mg RNA进行cDNA合成。使用表1中列出的基因特异性引物扩增cDNA。按照TB Green Premix Ex Taq试剂盒的操作说明进行30个循环的扩增,包括:94 ℃(变性),60 ℃(退火)和72 ℃(延伸)各1 min。每个cDNA样本设2个复孔,实时监测每个反应的循环荧光信号,获得循环阈值(cycle threshold,Ct)。然后根据目的基因和管家基因的Ct值,通过相对定量方法2-△△Ct进行统计分析。每个样本重复测试3 次,取平均值。
1.2.5 矿化实验:将MC3T3-E1细胞以3×104个细 胞/孔接种在48孔板中,并用成骨分化培养基诱导分化14 d。在成骨分化后,将细胞用PBS轻轻洗涤2次,并在4 ℃下用4% PFA固定30 min。用去离子水清洗2遍后,将细胞用0.1%茜素红染液在室温下染色1 h。然后用去离子水洗涤细胞以除去过量的染料,并在体视显微镜下拍摄染色的照片。
1.3 统计学处理方法 采用SPSS19.0统计软件进行统计学分析。计量资料以表示,多个样本均数的比较采用单因素方差分析,2组间比较用LSD-t检验。P<0.05为差异有统计学意义。

表1 引物序列
2 结果
2.1 TBHP对MC3T3-E1细胞活性的抑制呈浓度和时间依赖性 与对照组(不添加TBHP)相比,浓度为125、250、500 μmol/L的TBHP在1 h内对MC3T3-E1细胞活性影响差异无统计学意义(P>0.05);随着浓度和时间的增加细胞活性呈下降趋势,250 μmol/L TBHP作用3 h细胞活性降低为66.4%(P<0.01),当作用6 h后,活性下降为49.6%(P<0.001),达到半数抑制,见图1。因此后续的实验采用250 μmol/L浓度及6 h作用时间的处理条件作为MC3T3-E1细胞氧化损伤模型的构建条件。
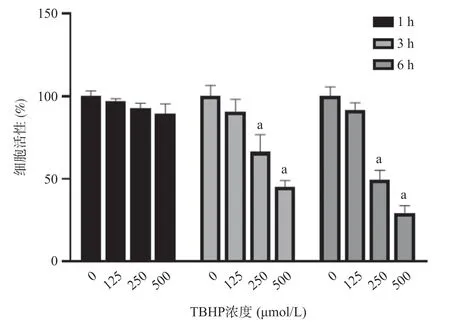
图1 不同浓度TBHP对MC3T3-E1细胞活性的影响
2.2 Sal B恢复TBHP引起的MC3T3-E1细胞活性的下降 为了确定Sal B的安全应用浓度范围,本研究首先检测了不同浓度的Sal B应用48 h对MC3T3-E1 细胞活性的影响。结果显示1、10、25、50、 100 μmol/L的Sal B处理48 h不影响细胞活性(P> 0.05),当浓度达到125 μmol/L时细胞活性下降 (P<0.05),见图2。将1~100 μmol/L不同浓度梯度的Sal B以不同的预处理时间处理MC3T3-E1细胞后用250 μmol/L TBHP处理6 h,细胞活性结果提示50 μmol/L预处理24 h组显示了最高的恢复效果 (P<0.01),与100 μmol/L的效果一致(P>0.05)。因此本研究选用50 μmol/L浓度预培养24 h作为后续检测的Sal B处理条件。见图3。

图2 不同浓度Sal B对MC3T3-E1细胞活性的影响
2.3 Sal B抑制TBHP引起的MC3T3-E1细胞内ROS的升高 为了检测Sal B的抗氧化作用,本研究通过DCFH-DA荧光染色,将不同组别的细胞内ROS的水平通过荧光强度进行对比。结果显示250 μmol/L TBHP作用6 h导致MC3T3-E1细胞内ROS水平显著升高,而50 μmol/L Sal B预处理24 h后明显抑制了ROS水平的升高(P<0.001),见图4。
2.4 Sal B恢复MC3T3-E1细胞的分化和矿化功能 为了检测MC3T3-E1细胞的分化矿化功能,用诱导培养基对MC3T3-E1细胞进行成骨诱导。3 d后检测成骨分化相关关键基因:碱性磷酸酶(alkaline phosphatase,ALP),I型胶原(collagen I,COLI),骨钙素(osteocalcin,OCN)和Runt相关转录因子2(runt-related transcription factor 2,RUNX2)的表达水平,结果显示TBHP显著抑制了该类基因的表达,而Sal B的应用明显恢复了MC3T3-E1细胞的分化功能(P <0.01),见图5。成骨分化诱导14 d后,通过茜素红染色对细胞外基质中形成的钙结节进行显色分析的结果与基因检测一致(P <0.01),见图6。
3 讨论

图3 Sal B恢复TBHP引起的细胞活性下降
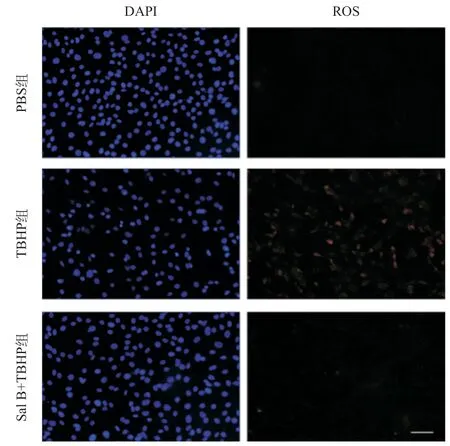
图4 Sal B抑制TBHP引起的ROS升高(刻度尺为100 μm)

图5 Sal B恢复MC3T3-E1细胞分化功能
鉴于骨质疏松对牙种植修复成功率的重要影响,本研究从骨质疏松症的病因出发,通过检测 Sal B对成骨细胞氧化损伤的保护作用,探寻新型治疗途径,为临床上骨质疏松症患者种植体骨整合水平的改善和提高奠定基础。
氧化应激诱导的成骨细胞功能障碍在骨质疏松症发病和疾病进展过程中起重要作用[14-15]。过量产生的活性氧类如H2O2、和-OH,是氧化损伤发生的一大重要诱因[16]。TBHP是有机过氧化物的一个重要分支,是一种最常用的自由基反应的引发剂,其热稳定性好,具有使用安全,易于控制等优点,目前已被认为是广泛接受的细胞氧化损伤模型的引发剂[17-19]。本研究发现TBHP可以导致MC3T3-E1细胞产生大量ROS,细胞活力降低。同时TBHP也导致了成骨细胞分化和矿化功能的下调。
Sal B作为我国传统中药丹参的主要活性成分,可以清除自由基发挥良好的抗氧化功能,已被用于对抗众多系统性疾病的实验研究,如糖尿病性心脏病[12]、癫痫[20]、类风湿性关节炎[21]等。本研究结果表明,Sal B的应用显著减弱了TBHP对MC3T3-E1细胞的氧化损伤。DCFH-DA染色显示Sal B可显著抑制TBHP诱导产生的ROS。同时,MTT检测结果显示其显著恢复了细胞活性。
对于细胞的成骨功能,qPCR结果和茜素红染色结果也证明Sal B进一步恢复了MC3T3-E1细胞的分化和矿化功能。本研究检测的成骨分化相关基因中,ALP和OCN分别是早期和晚期成骨细胞分化的标志物,Col-I是骨组织基质的主要成分,与早中期的成骨分化密切相关,而RUNX2作为其他分化相关基因的转录调节因子,在成骨细胞分化和骨形成中起关键作用。同时,研究证明RUNX2是WNT/β-catenin信号通路的直接靶标,该信号通路的激活可直接激活RUNX2启动子,从而促进相关成骨分化基因的表达[22]。由此可以推测β-catenin蛋白对RUNX2的正向调节与Sal B对成骨细胞成骨功能的恢复有着必然联系。而Sal B如何影响WNT/β-catenin信号通路,β-catenin如何调节下游的成骨分化,需要今后更多的实验研究。

图6 Sal B恢复MC3T3-E1细胞矿化功能
以上实验结果均为Sal B抑制氧化应激微环境下成骨细胞内源性ROS的产生,预防和修复成骨细胞的氧化损伤提供了强有力的证据。当然,关于Sal B对成骨细胞氧化损伤保护作用的分子机制还需要进一步的实验探索,而且我们也希望通过动物模型对Sal B的药理作用进行进一步验证。本研究为探讨Sal B对骨质疏松症患者的防治作用的应用前景提供了前期的理论基础和实验依据,有望为临床上各类氧化应激微环境下的成骨修复及种植体的骨整合提供新型治疗途径和方向。
